L’hydroxylamine est un composé inorganique de formule chimique NH2OH. C’est un solide cristallin blanc, mais en raison de sa nature hygroscopique, on le trouve et l’utilise presque toujours en solution aqueuse.
L’hydroxylamine, initialement signalée par LOSSEN en 1865, a ensuite été isolée comme sa base libre en 1891 par LOBRY DE BRUYN. RASCHIG a obtenu un brevet pour la première méthode industrielle de production de sulfate d’hydroxylammonium en Allemagne (1908) et aux États-Unis (1911).
L’importance des sels d’hydroxylamine et de leurs solutions réside dans leur rôle important en tant qu’intermédiaires dans divers procédés industriels, notamment dans la fabrication du caprolactame. La capacité annuelle mondiale de production d’hydroxylamine est estimée à 800 000 tonnes métriques.
Table des matières
1. Propriétés physiques de l’hydroxylamine
L’hydroxylamine, de formule chimique NH2OH, a la particularité de former des cristaux transparents, incolores et sans odeur.
Il est très soluble dans l’eau, ainsi que dans le méthanol et l’éthanol. Plusieurs propriétés physiques associées à l’hydroxylamine sont les suivantes :
| Propriété | Valeur |
|---|---|
| Masse molaire | 33,03 g/mol |
| Point de fusion (mp) | 32,05 °C |
| Point d'ébullition (bp) à 29 kPa | 56 °C |
| Pression de vapeur à 0 °C | 0,36 kPa |
| Pression de vapeur à 32 °C | 7,1 kPa |
| Enthalpie de Formation | -114 kJ/mol |
1.1. Sulfate d’hydroxylammonium
Le composé de sulfate d’hydroxylammonium, également connu sous le nom de (NH3OH)2SO4 ou (NH2OH)2·H2SO4, existe sous une forme cristalline qui se dissout facilement dans l’eau mais ne présente qu’une faible solubilité dans les solvants organiques.
La forme solide de ce composé a une densité de 1,883 g/cm3, tandis que la densité apparente est d’environ 1,10 g/cm3.
Il est important de noter que le sulfate d’hydroxylammonium subit une décomposition lorsqu’il est exposé à des températures supérieures à 120 °C.
Les solutions aqueuses de sulfate d’hydroxylammonium sont limpides et incolores. Dans une solution aqueuse à 1 % en poids à 20 °C, le pH mesure 3,6.
1.2. Chlorure d’hydroxylammonium
Le chlorure d’hydroxylammonium cristallin, également appelé (NH3OH)Cl ou NH2OH·HCl, est un sel hygroscopique qui forme des cristaux. Il présente une solubilité élevée dans l’eau et le méthanol.
L’ajout de 0,5 % en poids de silice pyrogénée empêche efficacement l’agglutination, où le gel de silice agit comme un composant insoluble et inerte.
Le chlorure d’hydroxylammonium a une masse volumique de 1,676 g/cm3 et une masse volumique apparente d’environ 0,780 g/cm3.
Sa décomposition se produit à des températures supérieures à 120 °C. Lorsqu’elle est dissoute dans l’eau, une solution aqueuse à 1 % en poids de chlorure d’hydroxylammonium à 20 °C a un pH de 3,2.
2. Réactions chimiques de l’hydroxylamine
Lors du chauffage, les sels d’hydroxylammonium subissent une décomposition, et si un chauffage local se produit, cela peut entraîner une décomposition exothermique incontrôlable. La présence d’impuretés de métaux lourds, en particulier de cuivre, d’alliages contenant du cuivre et de sels de cuivre, favorise la décomposition.
La décomposition du sulfate d’hydroxylammonium produit du dioxyde de soufre, du monoxyde de diazote (oxyde nitreux), de l’eau et du sulfate d’ammonium. D’autre part, le chlorure d’hydroxylammonium se décompose en chlorure d’hydrogène, azote, eau et chlorure d’ammonium.
Lorsque les sels d’hydroxylammonium réagissent avec un alcali, ils produisent de l’hydroxylamine, qui se décompose facilement. La réaction avec les nitrites entraîne une décomposition en monoxyde de diazote.
Les solutions aqueuses de sels d’hydroxylammonium présentent une acidité. Une exposition prolongée à 80 °C entraîne une décomposition lente. L’hydroxylamine et ses sels agissent comme des pièges à radicaux en solution, entraînant la formation d’ammoniac et d’azote.
L’oxydation de l’hydroxylamine, en fonction de l’oxydant et des conditions de réaction, produit des composés azotés dans divers états d’oxydation.
Les agents réducteurs puissants tels que le zinc ou la poudre de fer produisent de l’ammoniac. De nombreux ions métalliques forment des complexes avec l’hydroxylamine.
Les sels d’hydroxylammonium peuvent être transformés en acide hydroxylamine-O-sulfonique lorsqu’ils sont mis à réagir avec de l’oléum ou de l’acide chlorosulfonique. Cet acide sert de réactif approprié pour des processus tels que l’amination, la désamination réductrice, l’hydroxyméthylation et la formation d’hétérocycles.
L’hydroxylamine peut réagir à la fois sur les atomes d’azote et d’oxygène. Lorsque l’on vise à préparer des hydroxylamines O-substituées, la protection de l’atome d’azote est nécessaire pour éviter la N-alkylation.
Les composés d’hydroxylammonium réagissent avec les aldéhydes et les cétones pour former des oximes. Les β-dicétones et les β-dialdéhydes donnent des isoxazoles d’hydroxylamine.
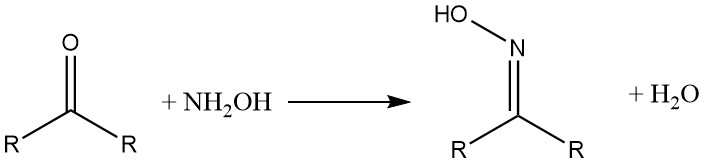
Avec les acides carboxyliques et leurs dérivés, l’hydroxylamine forme les acides hydroxamiques correspondants.

La réaction avec les isocyanates et les nitriles conduit à la formation de N-hydroxyurées et d’amidoximes, respectivement.

L’hydroxylamine réagit également avec les doubles liaisons oléfiniques :
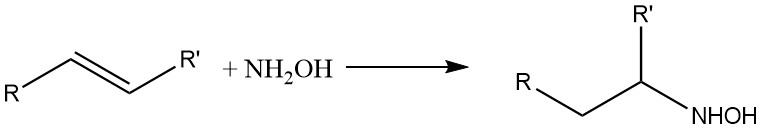
3. Production d’hydroxylamine
La production industrielle d’hydroxylamine implique la réduction des états d’oxydation supérieurs de l’azote. Par exemple, l’oxyde nitrique ou l’acide nitrique peut subir une hydrogénation catalytique pour donner de l’hydroxylamine.
La réduction de l’acide nitreux en hydroxylamine implique l’utilisation d’acide sulfureux. Dans tous ces procédés, le produit résultant est une solution aqueuse d’un sel, NH2OH·HX (où HX représente un acide, tel que l’acide sulfurique ou phosphorique), ou (NH3OH)X, plutôt que de l’hydroxylamine libre.
L’hydrolyse acide des nitroalcanes primaires, qui produit simultanément l’acide carboxylique correspondant, joue un rôle mineur dans la production globale d’hydroxylamine.
3.1. Hydrogénation catalytique de l’oxyde nitrique
Pour obtenir de l’oxyde nitrique de haute pureté, un procédé en deux étapes est utilisé. Initialement, l’ammoniac et l’oxygène sont mis à réagir sur un catalyseur platine-rhodium à des températures dépassant 900 °C.
Pour garantir la sécurité, le gaz de réaction est dilué avec suffisamment d’eau ou de vapeur d’eau, amenant le mélange en dessous de la limite inférieure d’explosivité. Cette réaction donne de l’oxyde nitrique avec du dioxyde d’azote et un excès d’oxygène comme sous-produits.
La deuxième étape implique l’hydrogénation du dioxyde d’azote et de l’excès d’oxygène sur un catalyseur à l’argent. Le dioxyde d’azote est converti en monoxyde d’azote, tandis que l’excès d’oxygène est transformé en eau.
Après condensation et récupération simultanée de la vapeur d’eau, le monoxyde d’azote est purifié à l’aide d’un laveur.
Il est ensuite converti en hydroxylamine en le faisant réagir avec de l’hydrogène en dessous de 50 ° C sur une suspension de catalyseur au platine partiellement empoisonné dans de l’acide sulfurique. En tant que sous-produits, de petites quantités de sulfate d’ammonium et de monoxyde de diazote sont produites.
Le processus industriel suit une approche continue en plusieurs étapes, avec une recirculation importante des gaz d’échappement.
Le gaz résiduel, contenant de l’hydrogène, de l’azote, du monoxyde d’azote et du monoxyde de diazote, peut être brûlé pour récupérer de la vapeur. En sélectionnant soigneusement la composition du gaz, les mélanges gazeux explosifs peuvent être évités lors de la synthèse de l’hydroxylamine.
De plus, un procédé modifié implique l’hydrogénation catalytique du monoxyde d’azote, conduisant à la production à la fois d’oxime de cyclohexanone et d’hydroxylamine. Cette méthode est connue sous le nom d’oximation acide.
3.2. Hydrogénation catalytique des nitrates
L’hydroxylamine est couramment produite par le procédé hydroxylamine-phosphate-oxime (HPO). Ce procédé implique l’hydrogénation d’une solution de nitrate d’ammonium en présence d’acide phosphorique.
Le processus HPO est généralement réalisé parallèlement à la synthèse de l’oxime de cyclohexanone, qui est utilisée dans la production de caprolactame.
3.3. Le processus Raschig
Le procédé Raschig, souvent modifié, reste une voie importante pour la production industrielle d’hydroxylamine.
Dans le procédé Raschig, l’eau, l’ammoniac et le dioxyde de carbone subissent une réaction dans une colonne d’absorption. Cette réaction conduit à la formation d’une solution de carbonate d’ammonium qui, à basse température, réagit avec les oxydes d’azote pour produire une solution alcaline de nitrite d’ammonium :
NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + NO + NO2 → 2 NH4NO2 + CO2
Dans l’étape suivante, le nitrite d’ammonium est converti en disulfonate d’hydroxylamine d’ammonium en le faisant réagir avec du dioxyde de soufre :
NH4NO2 + 2 SO2 + NH3 + H2O → HO–N(SO3NH4)2
Dans ce procédé, tout excès de disulfonate d’hydroxylamine d’ammonium est recyclé. La solution contenant le disulfonate d’hydroxylamine d’ammonium est soutirée et le sel est hydrolysé et neutralisé, ce qui entraîne la production de sulfate d’hydroxylammonium et de sulfate d’ammonium comme produits finaux.
HO–N(SO3NH4)2 + H2O → (NH3OH)2SO4 + (NH4)2SO4
3.4. Clivage acide des nitroalcanes
Le clivage de mélanges contenant du nitropropane et du nitrométhane peut être réalisé en les traitant avec de l’acide sulfurique à des températures élevées. Cette réaction donne du sulfate d’hydroxylammonium et l’acide carboxylique correspondant :
Nitropropane + Nitrométhane + Acide sulfurique → Sulfate d’hydroxylammonium + Acide carboxylique
Cependant, ce procédé a été utilisé dans une mesure limitée en raison de son coût élevé et de la disponibilité limitée des matières premières nécessaires.
4. Utilisations de l’hydroxylamine
Plus de 95% de la production d’hydroxylamine est dédiée à la fabrication de cyclohexanone oxime ou caprolactame.
Différents producteurs utilisent soit l’hydrogénation, soit le procédé Raschig, avec des variations principalement observées dans la quantité de sulfate d’ammonium générée lors de l’oximation.
Les sels d’hydroxylammonium servent de forme stable d’hydroxylamine et trouvent des applications dans divers secteurs de l’industrie chimique. Certaines utilisations notables incluent:
1. Industrie chimique : Agit comme réactif pour produire des oximes comme intermédiaires, ainsi que comme agent oxydant ou réducteur selon le pH.
2. Peintures et revêtements : Utilisés dans la production d’oximes spécialisés utilisés comme agents anticrémants.
3. Produits pharmaceutiques : employés dans la production d’antibiotiques, de stéroïdes, de tranquillisants, de spasmolytiques et de médicaments antituberculeux.
4. Photographie : utilisé comme stabilisant pour les révélateurs et comme additif dans les émulsions de couleur.
5. Industrie du caoutchouc : Agit comme un régulateur dans la polymérisation du caoutchouc synthétique, un antioxydant pour le caoutchouc naturel et un accélérateur dans la vulcanisation du caoutchouc synthétique.
6. Savon : Sert d’agent auxiliaire dans le raffinage des graisses pour la production de savon.
7. Plastiques : Agit comme régulateur et inhibiteur dans divers processus de polymérisation.
8. Métallurgie : utilisé comme additif pour le traitement de surface de l’acier, agent auxiliaire pour l’extraction des métaux de la liqueur résiduelle d’électrolyse et pour la récupération des décharges. Sert également d’agent de flottation pour les minerais de cuivre.
9. Industrie nucléaire : Agit comme agent auxiliaire pour la séparation de l’uranium et du plutonium.
10. Textiles : Agit comme agent auxiliaire dans des procédés de teinture spécifiques, comme fixateur pour les colorants textiles et comme matière première pour les colorants textiles à base d’isatine et d’isoxazole.
11. Protection des cultures : Sert de matière première pour la production d’insecticides, d’herbicides et de régulateurs de croissance des plantes.
12. Nourriture : Fonctionne comme intermédiaire dans la production d’édulcorants.
Ces applications mettent en évidence la polyvalence et l’importance des sels d’hydroxylammonium dans un large éventail d’industries.
5. Toxicologie et santé au travail
Les composés d’hydroxylammonium sont considérés comme nocifs pour la santé et peuvent provoquer des irritations. La DL50 (voie orale, rat) pour les composés d’hydroxylammonium est d’environ 600 à 640 mg/kg. En termes de toxicité aquatique, la CL50 (golden orfe, 48 heures) du sulfate d’hydroxylammonium varie de 1 à 10 mg/L.
En contact avec la peau, l’hydroxylamine peut provoquer une irritation légère à modérée et une sensibilisation est possible. Il a également un effet irritant modéré à fort sur les muqueuses, comme les yeux.
L’hydroxylamine peut être absorbée par la peau et peut former de la méthémoglobine.
Des études examinant les effets tératogènes de l’hydroxylamine (chez le rat) n’ont montré aucun effet nocif sur la progéniture. Bien que l’hydroxylamine et ses sels ne soient pas considérés comme cancérigènes sur la base des données actuelles, ils se sont avérés mutagènes pour les organismes inférieurs.
Il est important d’éviter tout contact avec les sels d’hydroxylammonium en raison de leurs effets irritants et de la possibilité que la poussière affecte la peau, les yeux et la gorge. En cas de contact avec la peau ou les yeux, les zones touchées doivent être abondamment rincées à l’eau.
L’ingestion de sels d’hydroxylammonium doit être strictement évitée et, si nécessaire, un médecin doit être consulté. Les sels d’hydroxylammonium doivent être étiquetés comme matières dangereuses.
Référence
- Hydroxylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a13_527
FAQ: Hydroxylamine
L’hydroxylamine peut agir à la fois comme acide et comme base, selon la réaction et l’environnement dans lequel elle se trouve.
L’acide conjugué de l’hydroxylamine est l’ion hydroxylammonium (NH3OH+)
L’hydroxylamine est utilisée dans diverses applications, notamment la production d’oximes comme intermédiaires dans l’industrie chimique, comme antioxydant et régulateur dans l’industrie du caoutchouc, dans la synthèse de produits pharmaceutiques, de colorants et d’agents phytosanitaires, et comme matière première pour la production de caprolactame.
L’hydroxylamine peut être nocive et irritante pour la peau, les yeux et les muqueuses. Il doit être manipulé avec prudence et mesures de sécurité appropriées. Le contact avec les sels d’hydroxylamine doit être évité et l’exposition doit être minimisée.
L’hydroxylamine elle-même n’est pas couramment utilisée comme médicament. Cependant, il peut être utilisé comme intermédiaire dans la synthèse de certains produits pharmaceutiques.
L’azote dans l’hydroxylamine a une charge formelle de 0 (neutre).
Lorsque l’hydroxylamine agit comme une base, l’atome d’azote de l’hydroxylamine accepte un proton.
La cétone réagit avec l’hydroxylamine pour produire une oxime.
L’hydroxylamine peut être produite par diverses méthodes, telles que l’hydrogénation de l’oxyde nitrique ou de l’acide nitrique, le procédé Raschig ou l’hydrolyse et la neutralisation du nitrite d’ammonium. La méthode spécifique dépend de l’application souhaitée et de la technologie disponible.