Qu’est-ce que l’éthylamine ?
L’éthylamine, également connue sous le nom d’éthanamine, est une amine aliphatique primaire dont la formule chimique est C2H5NH2. C’est un gaz inflammable à température ambiante avec une odeur d’ammoniac.
L’éthylamine se trouve naturellement dans les fruits et légumes, les céréales, le café, les fromages et les fruits de mer. C’est également un composant de la fumée de tabac.
Table des matières
1. Propriétés physiques de l’éthylamine
L’éthylamine est un liquide ou un gaz incolore et inflammable, selon la température ambiante. C’est une base faible qui a une odeur d’ammoniac avec un seuil de perception olfactive compris entre 0,027 ppm et 3,5 ppm. Elle est miscible avec l’eau, l’éthanol et l’éther.
La combustion de l’éthylamine produit des oxydes d’azote toxiques. Dans le commerce, l’éthylamine est vendue sous forme de solution aqueuse à 70 % ou de gaz comprimé.
Les propriétés physiques de l’éthylamine sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [75-04-7] |
| Formule chimique | C2H5NH2 |
| Masse moléculaire | 45,09 g/mol |
| Point de fusion | -80,6 °C |
| Point d'ébullition point | 16,6 °C |
| Densité à 20 °C | 0,6829 g/cm3 |
| pKb à 25 °C | 3,25 |
| Indice de réfraction | 1,3663 |
| Densité de vapeur | 1,56 |
| Pression de vapeur, à 20 °C | 121 kPa |
| Point d'éclair | -52 °C |
| Température d'auto-inflammation | 385 °C |
| Chaleur de combustion à 25 °C (liquide) | -1 713,3 kJ/mol |
| Chaleur de vaporisation | 6 845,1 g cal/g.mol |
| Tension superficielle à 25 °C | 19,20 mN/m |
2. Réactions de l’éthylamine
L’éthylamine est une amine primaire faible qui se dissout dans l’eau pour former une solution basique. C’est une base plus forte que l’ammoniac qui réagit avec les acides organiques ou inorganiques pour former des sels très solubles dans l’eau mais insolubles dans les solvants organiques.
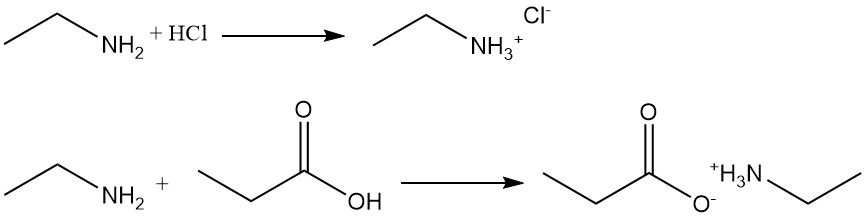
Par exemple, la réaction de l’éthylamine avec l’acide chlorhydrique produit du chlorure d’éthylammonium et avec l’acide propanoïque forme du propionate d’éthylammonium.
L’éthylamine réagit avec les acides carboxyliques et leurs esters, chlorures et anhydrides pour donner les amides correspondants. La réaction avec les chlorures d’acide carboxylique est une réaction hautement exothermique qui donne de très bons rendements. La réaction avec les acides carboxyliques forme souvent du sel d’ammonium, qui doit être chauffé pour produire les amides.
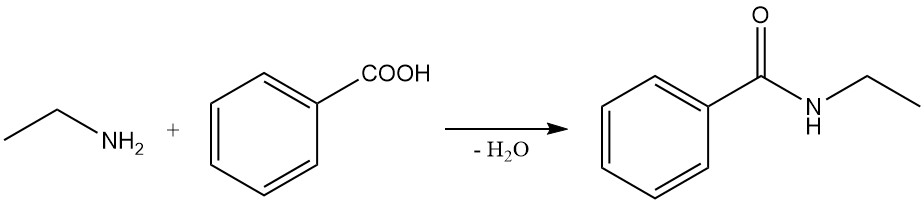
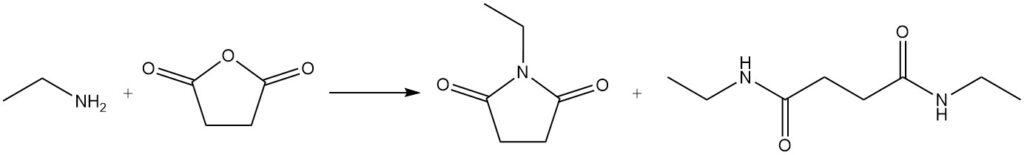
Parmi ces réactions, on peut citer la réaction de l’acide benzoïque et de l’éthylamine pour former du N-éthylbenzamide et la réaction de l’éthylamine avec l’anhydride succinique pour produire du 1-éthylpyrrolidine-2,5-dione et du N1,N4-diéthylsuccinamide.
Lorsque l’éthylamine réagit avec une lactone, un lactame se forme ; par exemple, la 1-éthyl-2-pyrrolidone est préparée à partir d’éthylamine et de γ-butyrolactone.
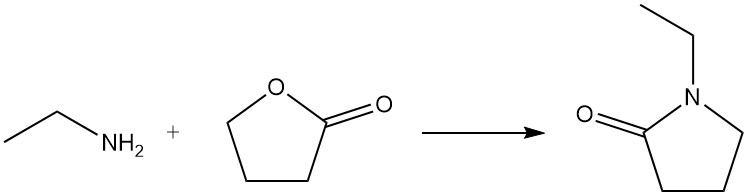
La réaction de l’éthylamine avec le chlorure de benzènesulfonyle (test de Hinsberg) forme le N-éthylbenzènesulfonamide soluble dans les alcalis.
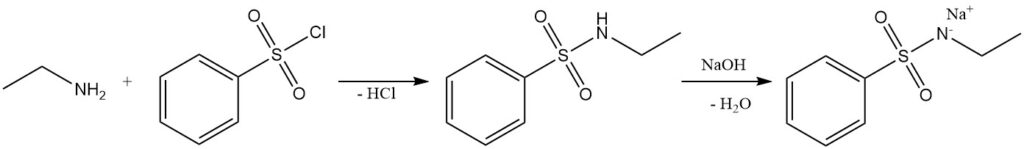
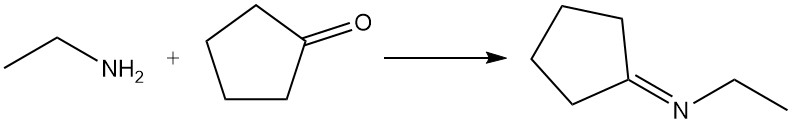
Selon les conditions de réaction, les aldéhydes et les cétones réagissent avec l’éthylamine pour former des imines (bases de Schiff) ou des énamines ; ces produits peuvent être hydrogénés pour donner des amines plus fortement alkylées. Les aldéhydes réagissent généralement plus rapidement que les cétones. Un exemple courant est la réaction de l’éthylamine et de la cyclopentanone pour produire de la N-éthylcyclopentanimine.
L’éthylcyclohexylamine, une amine importante utilisée dans de nombreuses industries, est produite par la réaction de l’éthylamine avec la cyclohexanone suivie d’une hydrogénation.
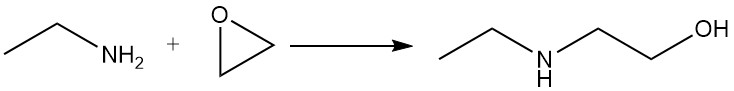
L’éthylamine réagit avec les époxydes pour donner un mélange de dérivés mono- et dioxyéthylés.
La réaction de l’éthylamine avec des halogénures d’alkyle et des sulfates de dialkyle produit un mélange d’amines secondaires et tertiaires et de composés d’ammonium quaternaire. Un exemple est la réaction de l’éthylamine et de l’iodure de méthyle pour former un mélange de N-méthyléthanamine, de N,N-diméthyléthanamine et d’iodure de N,N,N-triméthyléthylammonium.
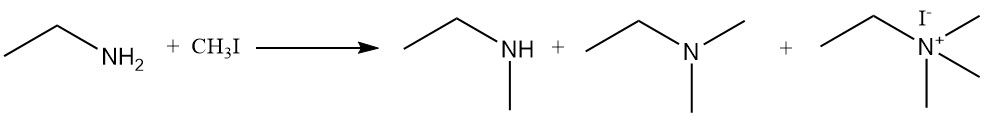
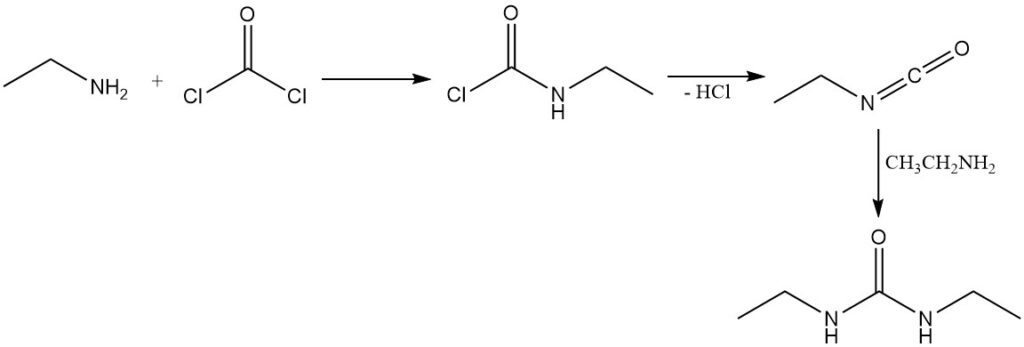
La réaction du phosgène avec l’éthylamine conduit d’abord à la formation de chlorure d’éthylcarbamique ; l’élimination ultérieure du chlorure d’hydrogène donne de l’isocyanatoéthane. L’excès d’éthylamine réagit ensuite avec l’isocyanatoéthane pour produire de la 1,3-diéthylurée.
L’éthylamine réagit avec le chloroforme dans des conditions basiques (hydroxyde de potassium ou hydroxyde de sodium) pour former de l’éthylisonitrile.

L’addition d’éthylamine à l’acrylonitrile forme du 3-(éthylamino)propanenitrile, qui peut être facilement hydrogéné en N-éthyl-1,3-propanediamine correspondante.

L’oxydation de l’éthylamine avec du peroxyde d’hydrogène en utilisant des zéolites dopées au tungstène comme catalyseurs produit de l’acétaldéhyde oxime.
La déshydrogénation de l’éthylamine produit de l’acétonitrile.
3. Production d’éthylamine
3.1. Production d’éthylamine à partir d’ammoniac et d’éthanol
La réaction catalytique de l’éthanol avec l’ammoniac est la méthode prédominante pour la synthèse de l’éthylamine. Ce processus génère simultanément de la diéthylamine et de la triéthylamine comme sous-produits en raison de la réactivité de l’éthylamine avec l’éthanol.
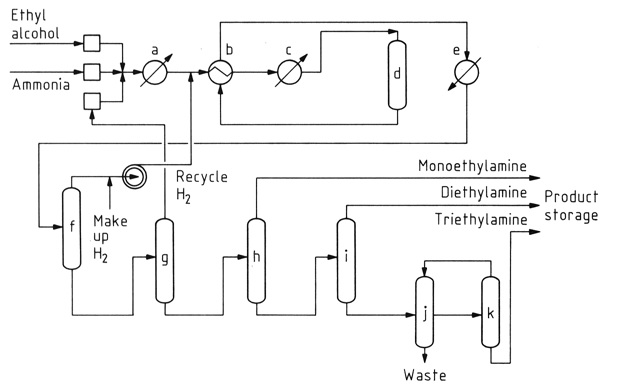
a) Vaporisateur ; b) Échangeur de chaleur ; c) Surchauffeur ; d) Convertisseur catalytique ; e) Refroidisseur de produit ; f) Séparateur de gaz ; g) Colonne d'ammoniac ; h) Colonne de monoéthylamine ; i) Colonne de diéthylamine ; j) Décanteur ; k) Colonne de triéthylamine
Alors que la conversion initiale de l’éthanol en éthylamine est presque neutre sur le plan énergétique, la formation d’amines secondaires et tertiaires est exothermique, ce qui favorise leur production thermodynamique. Les conditions de réaction, notamment la température, l’excès d’ammoniac et le temps de séjour, influencent la distribution du produit.
Historiquement, des catalyseurs de déshydratation (par exemple, l’alumine, la silice) étaient utilisés, mais récemment, les catalyseurs à base de métal sont devenus prédominants. Les catalyseurs au nickel, au cobalt, au cuivre et au fer sont couramment utilisés, le platine et le palladium étant moins sélectifs en raison du clivage potentiel des liaisons C-C ou C-N pendant la réaction.
Les promoteurs tels que l’argent, le zinc, l’indium, le manganèse, le molybdène et les métaux alcalins améliorent les performances du catalyseur. Ces composants actifs sont généralement supportés sur de l’alumine, de la silice ou de la zircone, les zéolites présentant une sélectivité plus élevée pour l’amine primaire.
Cette réaction se produit dans un réacteur à lit fixe à 0,5–25 MPa et 100–250 °C, selon le type de catalyseur et la phase (liquide ou gazeuse).
Le mécanisme implique la déshydrogénation de l’éthanol en acétaldéhyde comme étape déterminante de la vitesse. L’ajout ultérieur d’ammoniac, l’élimination de l’eau et la formation d’imine ou d’énamine sont suivis d’une hydrogénation en éthylamine.
Les réactions secondaires comprennent la dismutation d’amine (en particulier à des températures plus élevées), la condensation aldolique d’aldéhydes intermédiaires, la formation de bases de Schiff et la formation de nitrile dans des conditions spécifiques.
Un excès d’ammoniac de deux à huit fois déplace l’équilibre vers la formation d’éthylamine.
3.2. Production d’éthylamine à partir d’acétaldéhyde
L’acétaldéhyde, facilement accessible par synthèse oxo, est un précurseur préféré de l’éthylamine par rapport à l’éthanol en raison de ses avantages économiques. Ce processus implique une réaction en deux étapes : formation initiale d’une imine (base de Schiff) à partir d’acétaldéhyde et d’ammoniac, suivie d’une hydrogénation en éthylamine.

Ce procédé utilise un catalyseur à lit fixe et un mélange réactionnel contenant de l’acétaldéhyde, de l’ammoniac et de l’hydrogène. Alternativement, un procédé en deux étapes peut être bénéfique, séparant la formation d’imine et l’hydrogénation ultérieure.
Le fonctionnement en phase vapeur à 100–160 °C et à pression atmosphérique ou légèrement élevée est courant. Des conditions de haute pression peuvent être utilisées avec des systèmes efficaces d’élimination de la chaleur, tels que des taux de recyclage élevés ou des réacteurs multitubulaires. Des températures de réaction plus basses par rapport à l’amination d’alcool pourraient potentiellement permettre d’obtenir une sélectivité plus élevée.
Les catalyseurs sont généralement similaires à ceux utilisés dans l’amination d’alcool. L’éthylamine brute est purifiée par distillation.
Bien qu’il existe d’autres réactifs réducteurs, l’hydrogène reste le premier choix industriel en raison de considérations de manipulation et de coût.
3.3. Autres procédés
L’éthylamine peut être produite par l’ajout d’ammoniac à l’éthylène à l’aide de catalyseurs zéolitiques acides tels que la H-mordénite. Bien que la conversion pour l’amination directe de l’éthylène soit faible, limitée par des facteurs cinétiques et l’équilibre thermodynamique, la sélectivité pour la monoéthylamine est excellente.
L’éthylamine peut également être préparée de manière sélective par électroréduction de l’acétonitrile à température et pression ambiantes en utilisant des nanoparticules de Cu comme électrocatalyseur. Cependant, cette méthode n’est pas importante sur le plan industriel.
4. Utilisations de l’éthylamine
L’éthylamine est principalement utilisée comme précurseur des herbicides à base de triazine par réaction avec le chlorure cyanurique. L’atrazine, l’herbicide à base de triazine prédominant, est utilisée pour lutter contre les mauvaises herbes à feuilles larges et graminées, principalement dans la culture du maïs et du sorgho à grains. La simazine, une autre triazine dérivée de l’éthylamine, est utilisée dans la culture des agrumes et de la canne à sucre.
Au-delà des herbicides, l’éthylamine est utilisée dans la synthèse de divers produits chimiques. Elle réagit avec le chlorure de méthallyle pour former l’éthylméthallylamine, un intermédiaire clé dans la production d’éthalfluraline, un herbicide à base de dinitroaniline. De plus, l’éthylamine sert de précurseur à l’éthylcyclohexylamine, qui est ensuite convertie en cycloate, un herbicide thiocarbamate.
Elle est également utilisée dans l’industrie des résines, le raffinage du pétrole et la production de produits pharmaceutiques, d’inhibiteurs de corrosion, de catalyseurs de polyuréthane et d’agents textiles.
De plus, l’éthylamine est utilisée comme agent d’extraction par solvant, intermédiaire de colorant, stabilisateur de latex de caoutchouc et réactif de laboratoire. C’est un intermédiaire dans la préparation de détergents, de colorants photographiques, d’émulsifiants et de décapants pour peinture. L’éthylamine a été identifiée comme un métabolite humain.
La demande d’atrazine est en baisse en raison de préoccupations environnementales, qui ont conduit à des interdictions dans certaines régions.
5. Toxicologie de l’éthylamine
L’éthylamine est un composé alcalin volatil facilement absorbé par les voies cutanées et respiratoires. Malgré son excrétion urinaire efficace après un métabolisme partiel, l’exposition peut induire des effets néfastes sur la santé. Son action toxique principale est attribuée à ses propriétés corrosives.
Toxicité aiguë et à court terme
L’éthylamine est un irritant grave pour la peau, les yeux et les voies respiratoires. Un contact prolongé entraîne des lésions tissulaires corrosives.
La DL50 orale aiguë chez le rat est de 400 mg/kg, tandis que la DL50 cutanée chez le lapin est de 270 mg/kg. La CL50 par inhalation chez le rat est de 5 540 ppm (exposition d’une heure). L’application cutanée d’une solution aqueuse à 70 % sur des cobayes a provoqué de graves brûlures cutanées et une nécrose.
L’instillation oculaire d’une solution à 1 % chez le lapin a provoqué une irritation grave. L’inhalation à court terme de 50 ppm a provoqué une irritation cornéenne chez le lapin.
Les expositions industrielles ont entraîné une irritation oculaire et un œdème cornéen chez l’homme. Des cas de troubles visuels transitoires (glaucopsie) similaires à ceux causés par l’exposition à la triéthylamine existent, bien que le lien de cause à effet avec l’éthylamine ne soit pas clair.
Toxicité chronique
Les lapins exposés à 50 ppm d’éthylamine présentent des lésions pulmonaires et cornéennes. Une concentration plus élevée de 100 ppm a provoqué des lésions rénales. Les rats sont moins sensibles, avec seulement une irritation mineure à 100 ppm. Une irritation et des lésions nasales sont survenues à 500 ppm après 24 semaines d’exposition.
Il n’existe pas d’études à long terme évaluant le potentiel cancérigène. Les études sur le développement fœtal ne sont pas non plus disponibles.
Il n’existe aucune donnée sur l’exposition chronique à l’éthylamine chez l’homme.
Génotoxicité
Des résultats positifs ont été observés dans des essais de génotoxicité sur culture cellulaire in vitro. L’éthylamine n’a pas modifié la synthèse de l’ADN chez les rongeurs.
Écotoxicité
L’éthylamine présente une toxicité aiguë modérée à faible pour les organismes aquatiques, avec des valeurs de CL50 allant de 40 à 1000 ppm pour les poissons rouges et des valeurs de CE50 de 100 à 200 ppm pour Daphnia magna.
Autres dangers
L’éthylamine est hautement inflammable et peut former des mélanges de vapeurs explosifs. C’est un irritant grave pour les yeux, le nez et les voies respiratoires.
Références
- Amines, Aliphatic. Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a02_001.pub2
- Ethylamine. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005042
- https://www.sciencedirect.com/science/article/abs/pii/B9780128243152001949
- https://patents.google.com/patent/US20070112218A1/en
- https://www.nature.com/articles/s41467-021-22291-0
- https://products.basf.com/global/en/ci/ethylamine-solution-70




