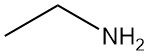
Wat is Ethylamine?
Ethylamine, ook bekend als ethanamine, is een primaire alifatische amine met de chemische formule C2H5NH2. Het is een ontvlambaar gas bij kamertemperatuur met een ammoniakachtige geur.
Ethylamine is van nature te vinden in fruit en groenten, granen, koffie, kaas en zeevruchten. Het is ook een bestanddeel van tabaksrook.
Inhoudsopgave
1. Fysieke eigenschappen van ethylamine
Ethylamine is een kleurloze, ontvlambare vloeistof of gas, afhankelijk van de omgevingstemperatuur. Het is een zwakke base met een ammoniakachtige geur met een gerapporteerde geurwaarnemingsdrempel in een bereik tussen 0,027 ppm en 3,5 ppm. Het is mengbaar met water, ethanol en ether.
De verbranding van ethylamine produceert giftige stikstofoxiden. Commercieel wordt ethylamine verkocht als een 70% waterige oplossing of als een samengeperst gas.
De fysieke eigenschappen van ethylamine worden in de volgende tabel vermeld:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [75-04-7] |
| Chemische formule | C2H5NH2 |
| Moleculaire massa | 45,09 g/mol |
| Smeltpunt | -80,6 °C |
| Kookpunt punt | 16,6 °C |
| Dichtheid bij 20 °C | 0,6829 g/cm3 |
| pKb bij 25 °C | 3,25 |
| Breukindex | 1,3663 |
| Dampdichtheid | 1,56 |
| Dampdruk, bij 20 °C | 121 kPa |
| Vlampunt | -52 °C |
| Zelfontbrandingstemperatuur | 385 °C |
| Verbrandingswarmte bij 25 °C (vloeistof) | -1713,3 kJ/mol |
| Verdampingswarmte | 6.845,1 g cal/g.mol |
| Oppervlaktespanning bij 25 °C | 19,20 mN/m |
2. Reacties van ethylamine
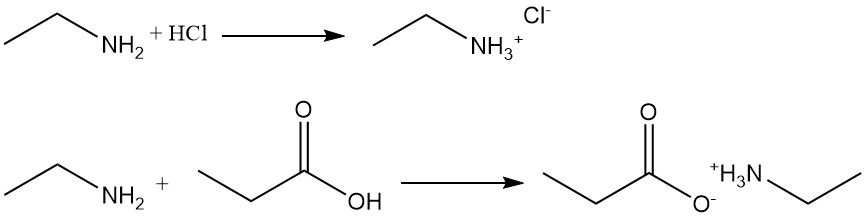
Ethylamine is een zwak primair amine dat oplost in water om een basische oplossing te vormen. Het is een sterkere base dan ammoniak die reageert met organische of anorganische zuren om zouten te vormen die zeer oplosbaar zijn in water, maar onoplosbaar in organische oplosmiddelen.
Bijvoorbeeld, de reactie van ethylamine met zoutzuur produceert ethylammoniumchloride, en met propaanzuur vormt het ethylammoniumpropionaat.
Ethylamine reageert met carbonzuren en hun esters, chloriden en anhydriden om de overeenkomstige amiden te geven. De reactie met carbonzuurchloriden is een zeer exotherme reactie die zeer goede opbrengsten oplevert. De reactie met carbonzuren vormt vaak ammoniumzout, dat verhit moet worden om de amiden te produceren.
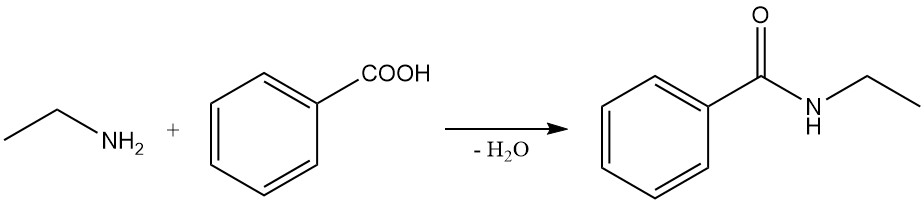
Voorbeelden van deze reacties zijn de reactie van benzoëzuur en ethylamine om N-ethylbenzamide te vormen en de reactie van ethylamine met barnsteenzuuranhydride om 1-ethylpyrrolidine-2,5-dion en N1,N4-diethylsuccinamide te produceren.
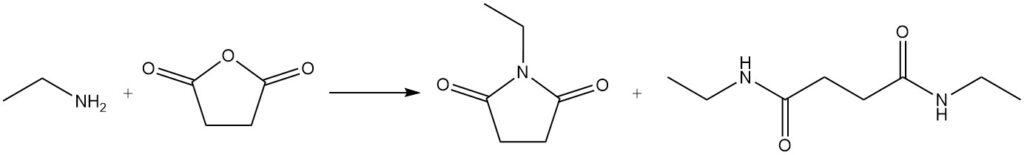
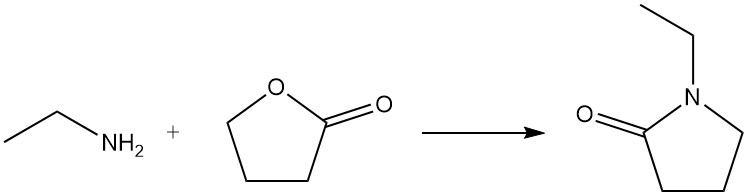
Wanneer ethylamine reageert met een lacton, ontstaat een lactam; bijvoorbeeld 1-ethyl-2-pyrrolidon wordt bereid uit ethylamine en γ-butyrolacton.
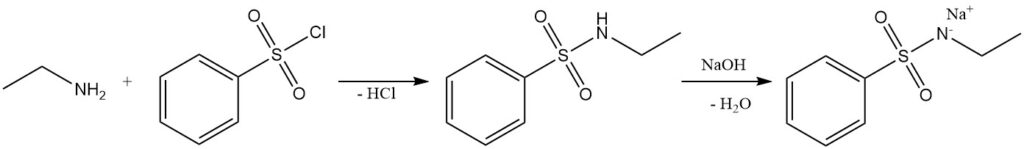
De reactie van ethylamine met benzeensulfonylchloride (Hinsberg-test) vormt het in alkali oplosbare N-ethylbenzeensulfonamide.
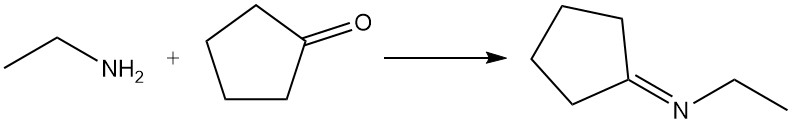
Afhankelijk van de reactieomstandigheden reageren aldehyden en ketonen met ethylamine om imines (Schiff-basen) of enamines te vormen; deze producten kunnen worden gehydrogeneerd om sterker gealkyleerde aminen te geven. Aldehyden reageren over het algemeen sneller dan ketonen. Een veelvoorkomend voorbeeld is de reactie van ethylamine en cyclopentanon om N-ethylcyclopentanimine te produceren.
Ethylcyclohexylamine, een belangrijk amine dat in veel industrieën wordt gebruikt, wordt geproduceerd door de reactie van ethylamine met cyclohexanon, gevolgd door hydrogenering.
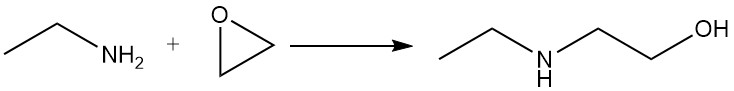
Ethylamine reageert met epoxiden om een mengsel van mono- en dioxyethylderivaten te geven.
De reactie van ethylamine met alkylhaliden en dialkylsulfaten produceert een mengsel van secundaire en tertiaire aminen en quaternaire ammoniumverbindingen. Een voorbeeld is de reactie van ethylamine en methyljodide om een mengsel te vormen van N-methylethanamine, N,N-dimethylethanamine en N,N,N-trimethylethylammoniumjodide.
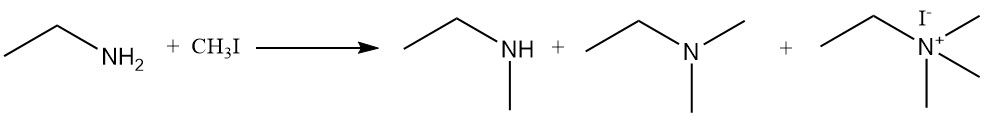
De reactie van fosgeen met ethylamine leidt eerst tot de vorming van ethylcarbaminechloride; daaropvolgende eliminatie van het waterstofchloride geeft isocyanatoethaan. Overtollig ethylamine reageert vervolgens met isocyanatoethaan om 1,3-diethylureum te produceren.
Ethylamine reageert met chloroform onder basische omstandigheden (kalium- of natriumhydroxide) om ethylisonitril te vormen.

Door toevoeging van ethylamine aan acrylonitril ontstaat 3-(ethylamino)propaannitril, dat eenvoudig kan worden gehydrogeneerd tot het overeenkomstige N-ethyl-1,3-propaandiamine.

De oxidatie van ethylamine met waterstofperoxide met behulp van wolfraamgedoteerde zeolieten als katalysatoren produceert aceetaldehydeoxime.
De dehydrogenering van ethylamine produceert acetonitril.
3. Productie van ethylamine
3.1. Productie van ethylamine uit ammoniak en ethanol
De katalytische reactie van ethanol met ammoniak is de overheersende methode voor ethylaminesynthese. Dit proces genereert gelijktijdig diethylamine en triethylamine als bijproducten vanwege de reactiviteit van ethylamine met ethanol.
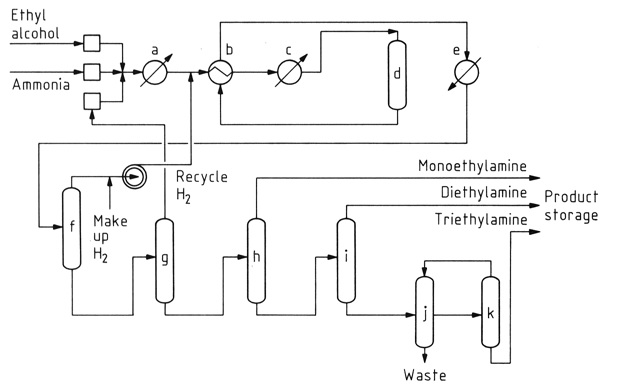
a) Verdamper; b) Warmtewisselaar; c) Oververhitter; d) Katalysator; e) Productkoeler; f) Gasscheider; g) Ammoniakkolom; h) Monoethylaminekolom; i) Diethylaminekolom; j) Decanter; k) Triethylaminekolom
Terwijl de initiële omzetting van ethanol in ethylamine vrijwel energieneutraal is, is de vorming van secundaire en tertiaire aminen exotherm, wat hun thermodynamische productie bevordert. Reactieomstandigheden, waaronder temperatuur, ammoniakoverschot en verblijftijd, beïnvloeden de productdistributie.
Historisch gezien werden dehydratatiekatalysatoren (bijv. alumina, silica) gebruikt, maar recentelijk zijn op metaal gebaseerde katalysatoren dominant geworden. Nikkel-, kobalt-, koper- en ijzerkatalysatoren worden vaak gebruikt, waarbij platina en palladium minder selectief zijn vanwege mogelijke C-C- of C-N-bindingssplitsing tijdens de reactie.
Promotoren zoals zilver, zink, indium, mangaan, molybdeen en alkalimetalen verbeteren de katalysatorprestaties. Deze actieve componenten worden doorgaans ondersteund op alumina, silica of zirkonia, waarbij zeolieten een hogere selectiviteit voor primaire amine vertonen.
Deze reactie vindt plaats in een vastbedreactor bij 0,5–25 MPa en 100–250 °C, afhankelijk van het type katalysator en de fase (vloeistof of gas).
Het mechanisme omvat ethanoldehydrogenering tot aceetaldehyde als de snelheidsbepalende stap. Daaropvolgende toevoeging van ammoniak, watereliminatie en imine- of enaminevorming worden gevolgd door hydrogenering tot ethylamine.
Nevenreacties omvatten aminedisproportionering (vooral bij hogere temperaturen), aldolcondensatie van intermediaire aldehyden, Schiff-basevorming en nitrilvorming onder specifieke omstandigheden.
Een twee- tot achtvoudige ammoniakovermaat verschuift het evenwicht richting ethylaminevorming.
3.2. Productie van ethylamine uit aceetaldehyde
Aceetaldehyde, gemakkelijk toegankelijk via oxosynthese, is een geprefereerde precursor voor ethylamine vergeleken met ethanol vanwege economische voordelen. Dit proces omvat een reactie in twee stappen: initiële vorming van een imine (Schiff-base) uit aceetaldehyde en ammoniak, gevolgd door hydrogenering tot ethylamine.

Dit proces maakt gebruik van een vaste-bedkatalysator en een reactiemengsel dat aceetaldehyde, ammoniak en waterstof bevat. Als alternatief kan een proces in twee fasen voordelig zijn, waarbij de vorming van imine en de daaropvolgende hydrogenering worden gescheiden.
Dampfasebewerking bij 100–160 °C en atmosferische of licht verhoogde druk is gebruikelijk. Hoge drukomstandigheden kunnen worden gebruikt met effectieve warmteafvoersystemen, zoals hoge recyclesnelheden of multitubulaire reactoren. Lagere reactietemperaturen vergeleken met alcoholaminering kunnen potentieel een hogere selectiviteit bereiken.
Katalysatoren zijn over het algemeen vergelijkbaar met die welke worden gebruikt bij alcoholaminering. De ruwe ethylamine wordt gezuiverd door destillatie.
Hoewel er alternatieve reductiemiddelen bestaan, blijft waterstof de primaire industriële keuze vanwege verwerkings- en kostenoverwegingen.
3.3. Andere processen
Ethylamine kan worden geproduceerd door de toevoeging van ammoniak aan ethyleen met behulp van zure zeolietkatalysatoren zoals H-mordeniet. Hoewel de conversie voor de directe aminering van ethyleen laag is, beperkt door kinetische factoren en het thermodynamische evenwicht, is de selectiviteit voor monoethylamine uitstekend.
Ethylamine kan ook selectief worden bereid door elektroreductie van acetonitril bij omgevingstemperatuur en -druk met behulp van Cu-nanodeeltjes als elektrokatalysator. Deze methode is echter niet industrieel belangrijk.
4. Toepassingen van ethylamine
Ethylamine wordt voornamelijk gebruikt als een voorloper voor triazineherbiciden door reactie met cyanuurchloride. Atrazine, het overheersende triazineherbicide, wordt gebruikt voor de bestrijding van breedbladige en grasachtige onkruiden, voornamelijk in de teelt van maïs en graansorghum. Simazine, een ander van ethylamine afgeleid triazine, wordt gebruikt in de citrus- en suikerrietteelt.
Naast herbiciden wordt ethylamine gebruikt bij de synthese van verschillende chemicaliën. Het reageert met methallylchloride om ethylmethallylamine te vormen, een belangrijk tussenproduct bij de productie van dinitroanilineherbicide ethalfluralin. Bovendien dient ethylamine als voorloper van ethylcyclohexylamine, dat vervolgens wordt omgezet in het thiocarbamaatherbicidecycloaat.
Het wordt ook gebruikt in de harsindustrie, petroleumraffinage en de productie van farmaceutische producten, corrosieremmers, polyurethaankatalysatoren en textielmiddelen.
Bovendien wordt ethylamine gebruikt als oplosmiddelextractiemiddel, kleurstoftussenproduct, rubberlatexstabilisator en laboratoriumreagens. Het is een tussenproduct bij de bereiding van detergenten, fotografische kleurstoffen, emulgatoren en verfverwijderaars. Ethylamine is geïdentificeerd als een menselijke metaboliet.
De vraag naar atrazine neemt af vanwege zorgen over het milieu, die hebben geleid tot verboden in bepaalde regio’s.
5. Toxicologie van ethylamine
Ethylamine is een vluchtige, alkalische verbinding die gemakkelijk via de huid en de luchtwegen wordt opgenomen. Ondanks de efficiënte uitscheiding via de urine na gedeeltelijk metabolisme, kan blootstelling schadelijke gezondheidseffecten veroorzaken. De primaire toxische werking wordt toegeschreven aan de corrosieve eigenschappen.
Acute en kortetermijntoxiciteit
Ethylamine is een ernstige irriterende stof voor de huid, ogen en luchtwegen. Langdurig contact resulteert in corrosieve weefselschade.
Acute orale LD50 bij ratten is 400 mg/kg, terwijl de dermale LD50 bij konijnen 270 mg/kg is. Inhalatie-LC50 bij ratten is 5540 ppm (blootstelling van 1 uur). Dermale toepassing van een 70% waterige oplossing bij cavia’s veroorzaakte ernstige brandwonden en necrose.
Oculaire instillatie van een 1% oplossing bij konijnen veroorzaakte ernstige irritatie. Kortdurende inhalatie van 50 ppm veroorzaakte irritatie van het hoornvlies bij konijnen.
Industriële blootstelling heeft geleid tot oogirritatie en hoornvliesoedeem bij mensen. Er zijn meldingen van voorbijgaande visuele stoornissen (glaucopsie) die vergelijkbaar zijn met die veroorzaakt door blootstelling aan triethylamine, hoewel het causale verband met ethylamine onduidelijk is.
Chronische toxiciteit
Konijnen die worden blootgesteld aan 50 ppm ethylamine vertonen longschade en hoornvliesletsel. Een hogere concentratie van 100 ppm veroorzaakte nierschade. Ratten zijn minder gevoelig, met slechts lichte irritatie bij 100 ppm. Neusirritatie en -schade traden op bij 500 ppm na 24 weken blootstelling.
Langetermijnstudies die het carcinogene potentieel evalueren, ontbreken. Studies naar de ontwikkeling van de foetus zijn ook niet beschikbaar.
Er zijn geen gegevens over chronische blootstelling aan ethylamine bij mensen.
Genotoxiciteit
Positieve resultaten werden waargenomen in in vitro celkweekgenotoxiciteitstests. Ethylamine veranderde de DNA-synthese bij knaagdieren niet.
Ecotoxiciteit
Ethylamine vertoont matige tot lage acute toxiciteit voor waterorganismen, met LC50-waarden variërend van 40 tot 1000 ppm voor goudvissen en EC50-waarden van 100 tot 200 ppm voor Daphnia magna.
Andere gevaren
Ethylamine is zeer ontvlambaar en kan explosieve dampmengsels vormen. Het is een ernstige irriterende stof voor de ogen, neus en luchtwegen.
Referenties
- Amines, Aliphatic. Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a02_001.pub2
- Ethylamine. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005042
- https://www.sciencedirect.com/science/article/abs/pii/B9780128243152001949
- https://patents.google.com/patent/US20070112218A1/en
- https://www.nature.com/articles/s41467-021-22291-0
- https://products.basf.com/global/en/ci/ethylamine-solution-70




