γ-Butyrolactone (CAS 96-48-0), ook bekend als γ-hydroxyboterzuurlacton, is een eenvoudige organische verbinding met de formule C4H6O2. Het is een hygroscopische en kleurloze vloeistof met een zwakke geur, die op het eerste gezicht misschien onopvallend lijkt.
De industriële productie ervan begon in de jaren 40 als resultaat van het werk van Reppe en collega’s bij BASF. Het Reppe-proces blijft de dominante methode voor grootschalige γ-butyrolactonesynthese.
Inhoudsopgave
1. Fysieke eigenschappen van γ-butyrolacton
γ-butyrolacton bestaat als een kleurloze, licht hygroscopische vloeistof met een zwakke geur. Het is mengbaar met water, alcoholen, esters, ethers, ketonen en aromatische koolwaterstoffen. Hoewel het een beperkte mengbaarheid heeft met lineaire en cyclische alifatische koolwaterstoffen, wordt het gebruikt als oplosmiddel voor talrijke polymeren en lagere koolwaterstoffen.
Enkele fysieke eigenschappen van γ-butyrolacton staan in de onderstaande tabel:
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 86,09 g/mol |
| Smeltpunt | - 43,5°C |
| Kookpunt | 204-206°C (bij 101,3 kPa) |
| Dichtheid (0°C) | 1,15 g/cm³ |
| Dichtheid (20°C) | 1,13 g/cm³ |
| Dichtheid (40°C) | 1,11 g/cm³ |
| Kritische temperatuur | 436,5°C |
| Kritische druk | 3,35 MPa |
| Dampspanning (20°C) | 0,04 kPa |
| Dampspanning (50°C) | 0,3 kPa |
| Dampdruk (100°C) | 3,6 kPa |
| Dampdruk (150°C) | 22,5 kPa |
| Dampdruk (205°C) | 101,3 kPa |
| Verdampingswarmte (206°C) | 535 kJ/kg |
| Oplossingswarmte in water | 2500 J/mol |
| Specifieke warmtecapaciteit (cp) - Vloeistof (25°C) | 1680 J kg⁻¹ K⁻¹ |
| Specifieke warmtecapaciteit (cp) - Vloeistof (100°C) | 1850 J kg⁻¹ K⁻¹ |
| Specifieke warmtecapaciteit (cp) - Vloeistof (200°C) | 2200 J kg⁻¹ K⁻¹ |
| Specifieke warmtecapaciteit (cp) - Gas (100°C) | 1275 J kg⁻¹ K⁻¹ |
| Specifieke warmtecapaciteit (cp) - Gas (200°C) | 1575 J kg⁻¹ K⁻¹ |
| Specifieke warmtecapaciteit (cp) - Gas (300°C) | 1820 J kg⁻¹ K⁻¹ |
| Vlampunt | 100-101°C |
| Ontstekingstemperatuur | 455°C |
| Verbrandingswarmte | 234 kJ/g |
| Explosiegrenzen - Onder | 2,7 vol% |
| Explosiegrenzen - Boven | 15,6 vol% |
| Breukindex (20°C) | 1,4352 |
| Viscositeit (20°C) | 1,90 mPa·s |
| Viscositeit (50°C) | 1,25 mPa·s |
| Viscositeit (80°C) | 0,86 mPa s |
| Viscositeit (110°C) | 0,63 mPa s |
| Viscositeit (140°C) | 0,49 mPa s |
| Viscositeit (170°C) | 0,40 mPa s |
| Oppervlaktespanning (20°C) | 44,6 x 10-5 N/cm |
| Diëlektrische constante (20°C) | 39,1 |
| Thermische geleidbaarheid (25-65°C) | 0,276 J m⁻¹ s⁻¹ K⁻¹ |
| Geleidbaarheid | 0,7 μS/cm |
2. Chemische eigenschappen van γ-butyrolacton
In een waterige oplossing is de isomerisatie tussen de lactonvorm en de vrije hydroxyboterzuurvorm een temperatuurafhankelijk evenwicht. Bij 0 °C overheerst de lactonvorm volledig, terwijl bij 100 °C ongeveer 80% bestaat als lacton.
Sterk alkalische omstandigheden (één molair equivalent alkali) verschuiven het evenwicht volledig naar de hydroxyboterzuurvorm. Deze eigenschap maakt de titrimetrische bepaling van butyrolacton mogelijk. Bij een neutrale pH (7) is butyrolacton zeer stabiel.
Butyrolacton ondergaat ringsplitsingsreacties met verschillende reagentia, wat derivaten van γ-hydroxyboterzuur oplevert. Voorbeelden zijn reacties met basen, waterstofhalogeniden en alcoholen (onder zure omstandigheden).
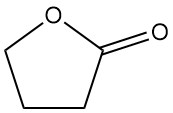
Het ondergaat ook reacties in de α-positie zonder ringsplitsing. Deze omvatten reacties met ammoniak, aminen, carbonylverbindingen en halogenering. Door condensatie met ethylacetaat ontstaat bijvoorbeeld α-acetobutyrolacton, een belangrijk tussenproduct in de synthese van vitamine B1.
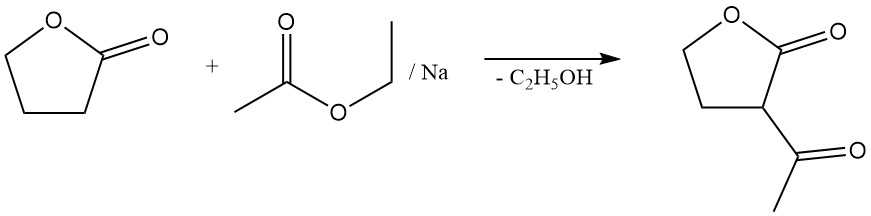
De lactonringsplitsingsreactie maakt de bereiding van waardevolle γ-gesubstitueerde boterzuurderivaten mogelijk. De reactie met natriumsulfide levert bijvoorbeeld het rubberadditief thiodiboterzuur op,
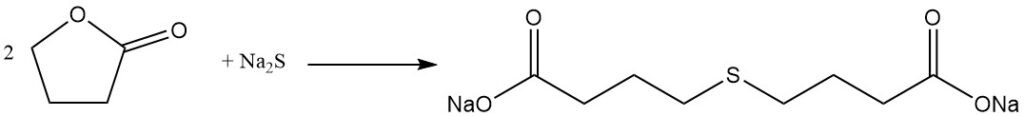
terwijl de reactie met fenol fenoxyboterzuur produceert.
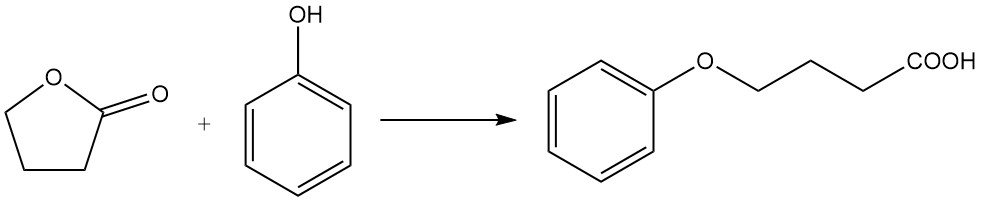
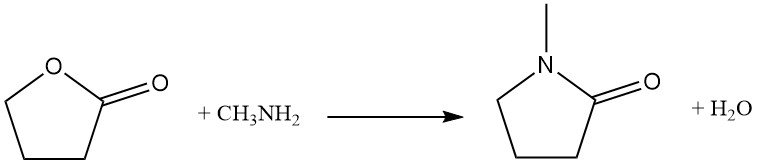
Het vervangen van het ringzuurstofatoom door stikstof is een industriële reactie die wordt gebruikt voor de synthese van pyrrolidonderivaten. Butyrolacton reageert bijvoorbeeld met methylamine om N-methylpyrrolidon (NMP) te produceren, een belangrijk industrieel oplosmiddel.
Directe homopolymerisatie van butyrolacton vereist hoge druk (2000 MPa), maar alternatieve routes, zoals fermentatie van suikers, kunnen een soortgelijk product opleveren.
3. Productie van butyrolacton
3.1. Productie van butyrolacton door dehydrogenering van 1,4-butaandiol
Het Reppe-proces is de overheersende industriële route voor butyrolactonsynthese, bereikt door de endotherme dehydrogenering van 1,4-butaandiol in de gasfase. Deze meerstapsreactie verloopt via γ-hydroxybutyraldehyde en 2-hydroxytetrahydrofuran-tussenproducten.

Belangrijke fabrikanten die dit proces gebruiken zijn BASF, Ashland en Lyondell.
Voorverwarmde 1,4-butaandioldamp wordt gecombineerd met een hete circulerende waterstofstroom en over een koperen katalysatorbed geleid bij atmosferische druk en temperaturen variërend van 180 tot 300 °C (Figuur 1). Deze reactie levert een hoge opbrengst van ongeveer 95% butyrolacton.
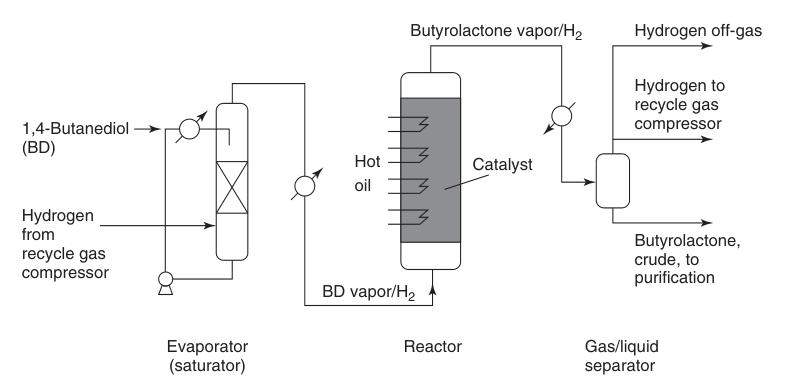
Het gegenereerde waterstofbijproduct vereist minimale zuivering voor potentieel hergebruik, meestal met behulp van katalytische methanisering om koolmonoxideverontreinigingen te verwijderen.
Ruwe butyrolacton die wordt gescheiden van de gerecyclede gasstroom bevat kleine onzuiverheden zoals niet-gereageerde 1,4-butaandiol, boterzuur en hoogkokende verbindingen. Deze worden verwijderd via destillatie om zuivere butyrolacton te verkrijgen.
Butyrolacton zelf is niet-corrosief en compatibel met koolstofstalen apparatuur. Componenten die worden blootgesteld aan het hete ruwe product dat boterzuur bevat, zoals delen van de synthese- of destillatievaten en leidingen, vereisen echter het gebruik van roestvrij staal voor verbeterde duurzaamheid.
3.2. Productie van butyrolacton door hydrogenering van maleïnezuuranhydride
Een alternatieve route naar butyrolacton omvat katalytische hydrogenering van maleïnezuuranhydride. Bij dit proces wordt voorverwarmd gesmolten maleïnezuuranhydride in een circulerende stroom waterstof onder druk (6-12 MPa) en temperatuur (160-280 °C) gebracht. Een op nikkel gebaseerde katalysator bevordert de reactie, die exotherm verloopt met een ΔH van -211 kJ/mol:
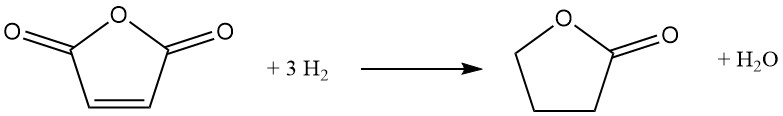
Het reactiepad omvat intermediair barnsteenzuuranhydride en kan, afhankelijk van de gekozen omstandigheden, verder worden gericht op de productie van tetrahydrofuran. Volledige hydrogenering van barnsteenzuuranhydride leidt echter onvermijdelijk tot co-vorming van tetrahydrofuran.
De overtollige waterstof wordt gerecycled na het wassen met water om onzuiverheden te verwijderen. Bijproducten die worden gevormd tijdens de synthese van butyrolacton, waaronder propanol, butanol, propionzuur en boterzuur, worden gescheiden van de circulerende gasstroom. Vervolgens zuivert de destillatie de butyrolactonstroom.
Vanwege de aanwezigheid van zure bijproducten vereisen zowel de synthese- als de destillatieapparatuur een roestvrijstalen constructie. Mitsubishi Chemical Corporation is een fabrikant die deze methode gebruikt.
3.3. Productie van butyrolacton door hydrogenering van maleïnezuuresters
Diverse processen die in de jaren 80 opkwamen en dimethylmaleïnezuur als tussenproduct gebruikten, bieden alternatieve routes voor 1,4-butaandiol en tetrahydrofuraan (THF). Deze methoden bieden ook de mogelijkheid om butyrolacton, een tussenproduct in de reactievolgorde, te isoleren.
Een opmerkelijk proces, ontwikkeld door Kvaerner Process Technology (nu Johnson Matthey Davy Technologies), gebruikt dimethylmaleïnezuur als het eerste product dat wordt verkregen uit maleïnezuuranhydride en methanol met behulp van een sterk zure ionenuitwisselingskatalysator.
Vervolgens gasfasehydrogenering over een kopergebaseerd katalysatorsysteem, onder druk van 2-8 MPa en temperaturen van 150-250 °C, levert een mengsel van gewenste producten op: 1,4-butaandiol, THF, butyrolacton, sporen van dimethylsuccinaat (tussenproduct) en n-butanol als een belangrijk bijproduct.
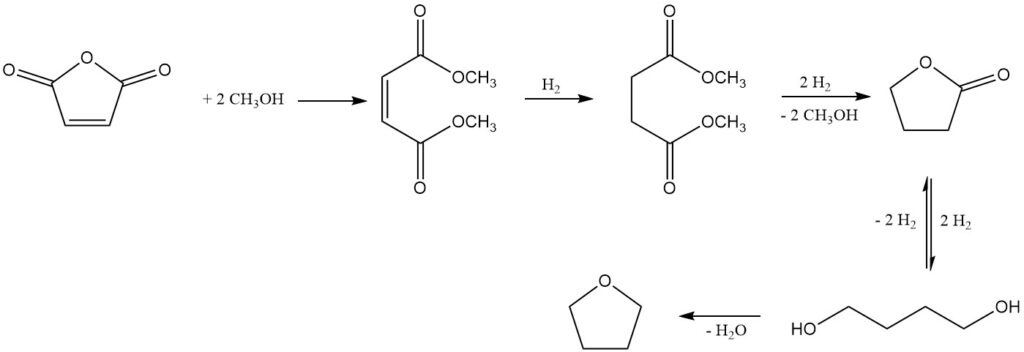
Butyrolacton en dimethylsuccinaat vormen een azeotropisch mengsel, waardoor ze kunnen worden teruggewonnen en gerecycled naar de hydrogeneringsfase. Deze recyclingstrategie bevordert volledige conversie naar 1,4-butaandiol en THF. Als alternatief kan de azeotroop worden geraffineerd door destillatie om zuiver butyrolacton te isoleren.
De butyrolactonopbrengst wordt direct beïnvloed door de werkdruk en temperatuur tijdens de hydrogenering, die het evenwicht tussen 1,4-butaandiol en butyrolacton bepalen. Onder de gerapporteerde omstandigheden kunnen de opbrengsten variëren van 5% tot 50%.
Dit innovatieve proces heeft aanzienlijke commerciële interesse gewekt, waarbij KPT en JM Davy licenties hebben verkregen voor de bouw van meerdere butaandiol-butyrolacton-THF-fabrieken in Saoedi-Arabië, Maleisië, Korea en China.
3.4. Productie van butyrolacton door biobased proces
Metabolix (nu Yield10 Bioscience, Inc.) ontwikkelde een fermentatieproces om poly(4-hydroxybutyraat) (polybutyrolacton) te produceren uit suikers. Dit polymeer kan worden gedepolymeriseerd tot butyrolacton bij temperaturen boven de 200 °C, waarbij calciumhydroxide optimale resultaten oplevert. De resterende biomassa wordt omgezet in vaste brandstof. Vanaf 2019 bestaat er geen commerciële fabriek die deze methode gebruikt.
BioAmber stelde een biobased route voor waarbij suikers worden gefermenteerd tot barnsteenzuurdiammoniumzout. Vervolgens levert ammoniakverwijdering barnsteenzuur op, dat kan worden gehydrogeneerd in aanwezigheid van een edelmetaalkatalysator om butyrolacton te produceren, naast 1,4-butaandiol en tetrahydrofuraan. Dit proces heeft nog geen commerciële toepassing bereikt.
Hoewel het niet commercieel significant is, heeft onderzoek verschillende alternatieve routes voor butyrolactonsynthese onderzocht uit tetrahydrofuraan, dihydrofuraan, acetyleen, butyndiol, olefinen, butadieen of door carbonylering.
4. Toepassingen van butyrolacton
De veelzijdigheid van butyrolacton reikt veel verder dan zijn rol als een eenvoudig chemisch tussenproduct. De toepassingen ervan bestrijken uiteenlopende gebieden, van farmaceutische formuleringen tot polymeerwetenschap en zelfs opkomende technologieën in elektronica.
Butyrolacton dient als een cruciale bouwsteen voor verschillende chemicaliën, waaronder N-methylpyrrolidon en pyrrolidon, beide met hun eigen belangrijke toepassingen. Het wordt ook gebruikt bij de synthese van fenoxyherbiciden zoals MCPB (γ-2-methyl-4-chloorfenoxyboterzuur) en groeiregulatoren.
Het is een tussenproduct bij de productie van α-acetobutyrolacton, een essentiële stap in de synthese van vitamine B1. Butyrolacton wordt ook gebruikt voor de productie van thiodiboterzuur, een waardevol additief in de rubberproductie.
Het is een oplosmiddel dat verschillende polymeren kan oplossen, wat hun verwerking en manipulatie vergemakkelijkt. Bovendien is het een waardevolle katalysator voor specifieke polymerisatiereacties.
Butyrolacton draagt bij aan de formulering van haargolfcomposities, zonnebrandcrèmes, andere persoonlijke verzorgingsproducten en in farmaceutische producten.
Andere toepassingen van butyrolacton zijn: als oplosmiddel in inkjetprintinkt, als extractant in de petroleumindustrie, als stabilisator voor chloorkoolwaterstoffen en op fosfor gebaseerde pesticiden en als nematocide.
De unieke eigenschappen maken het een veelbelovend co-solvent voor condensatorelektrolyten in de elektronica-industrie en heeft een potentieel gebruik in fotoresists.
5. Toxicologie en arbeidsgezondheid
Absorptie en metabolisme:
- Butyrolacton wordt gemakkelijk opgenomen via de darmen en de huid. De orale halfwaardetijd bij ratten is ongeveer 20 minuten.
- Metabolisme en uitscheiding verlopen snel, waarbij voornamelijk γ-hydroxyboterzuur als belangrijkste metaboliet wordt geproduceerd.
- Bij mensen rapporteren studies (S)-3,4-dihydroxybutyraat, glycolzuur en andere metabolieten in de urine na inname.
Acute toxiciteit:
- Butyrolacton vertoont een lage acute toxiciteit, met LD50-waarden tussen 800 en 1800 mg/kg bij knaagdieren en 500-1700 mg/kg bij cavia’s.
- Dermale LD50 bij cavia’s is 5600 mg/kg.
- De inhalatieve LC50 (rat, 4 uur) overschrijdt de hoogste geteste niet-dodelijke concentratie (>5,1 mg/L).
- Inhalatie bij kamertemperatuurverzadiging vertoont geen nadelige effecten bij ratten [BASF, (1960) ongepubliceerde resultaten].
Neurologische effecten:
- De depressie van het centrale zenuwstelsel (CZS) van butyrolactone treedt op via zijn metaboliet, γ-hydroxyboterzuur, met extra verdovende effecten op het perifere zenuwstelsel.
- Doses van 2500 mg bij volwassen mensen veroorzaakten tijdelijke slaap.
- Doses van 66 mg/kg bij kinderen voor anesthesie resulteerden in diepe slaap met af en toe ademhalingsdepressie.
- Hogere accidentele orale doses bij volwassenen en zuigelingen veroorzaakten CZS-depressie-geïnduceerde bewusteloosheid, af en toe coma, bradycardie en ademhalingsdepressie. Patiënten herstelden volledig binnen 24 uur met ondersteunende zorg.
Lokale en huideffecten:
- Butyrolacton is niet irriterend voor de huid, maar matig irriterend voor de ogen bij konijnen [BASF, (1960) ongepubliceerde resultaten].
- Geen huidsensibilisatie waargenomen bij cavia’s.
- Patchtesten bij 200 vrijwilligers vonden geen huidreacties.
- Lotions die butyrolacton bevatten worden goed verdragen voor plaatselijke toepassing.
- Het heeft gediend als een succesvol plaatselijk analgeticum voor musculoskeletale pijn, hoofdpijn en migraine.
Chronische en carcinogeniciteitsstudies:
- Langdurige orale toediening van 3 g/kg per dag gedurende vier weken leidde tot CNS-depressie bij ratten, maar geen verdere significante effecten.
- Herhaalde-dosisstudies toonden een iets hogere toxiciteit vergeleken met sondevoeding met mogelijke boluseffecten.
- Talrijke mutageniteits- en genotoxiciteitsstudies geven geen genotoxisch potentieel aan.
- Langdurige carcinogeniteitsstudies bij ratten en muizen bij hoge doses leverden geen bewijs op van tumorvormend potentieel.
- Vroege dermale en orale studies lieten ook geen carcinogene effecten zien.
- Over het algemeen suggereert het bewijs geen significant carcinogeen risico in verband met butyrolacton.
Prenatale blootstelling bij ratten en konijnen via orale en inhalatieroutes vertoonde geen aan de stof gerelateerde ontwikkelingseffecten (BASF AG, (1993) ongepubliceerde resultaten).
Specifieke beroepsmatige blootstellingslimieten voor butyrolacton zijn niet vastgesteld in Europa of de VS.
Acute toxiciteitsgegevens en snelle biologische afbreekbaarheid suggereren een minimaal milieurisico.
Referentie
- Butyrolactone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_495.pub2




