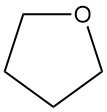
Tetrahydrofuraan (THF), ook bekend als oxolane, is een cyclische ether met de chemische formule C4H8O. Het heeft een brede toepassing in de chemische industrie.
Inhoudsopgave
1. Fysieke eigenschappen van tetrahydrofuraan
Tetrahydrofuraan (THF) is een kleurloze, vluchtige, polaire vloeistof die commercieel verkrijgbaar is met een minimale zuiverheid van 99,9 gew.% (bij destillatie). Het heeft een karakteristieke acetonachtige geur. THF is volledig mengbaar met water, alcoholen, ethers en andere gangbare oplosmiddelen.
Tabel 1 presenteert enkele fysieke eigenschappen van THF.
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 72,1 g/mol |
| Kookpunt | 66 °C |
| Smeltpunt | -108,5 °C |
| Kritische temperatuur | 267 °C |
| Kritische druk | 5,19 MPa |
| Kritische dichtheid | 0,322 g/cm3 |
| Dichtheid bij 20 °C | 0,886 |
| Breukindex bij 20 °C | 1,4073 |
| Soortelijke warmtecapaciteit | 1,765 J g-1 K-1 |
| Verdampingswarmte (66 °C, 101,3 kPa) | 435 J/kg |
| Verbrandingswarmte | -35.141 kJ/kg |
| Explosiegrenzen in lucht (25 °C) | 1,5 vol% (onder), 12,0 vol% (boven) |
| Vlampunt (Abel-Pensky) | -22 °C |
| Dipoolmoment | 5,84 × 10-30 C.m |
| Diëlektrische constante (20 °C) | 7,6 |
2. Chemische reacties van tetrahydrofuraan
Tetrahydrofuraan is een waardevol uitgangsmateriaal voor belangrijke reacties. Deze omvatten kationische polymerisatie met gelijktijdige ringopening van THF om hoogmoleculaire bifunctionele glycolethers met verschillende ketenlengtes te produceren.
Deze producten zijn van economisch belang bij de productie van essentiële kunststoffen. Bovendien vormen ringsplitsingsreacties van tetrahydrofuraan de basis voor dehydratie tot butadieen, oxidatie tot barnsteenzuur en carboxylering tot adipinezuur of γ-valerolacton.
THF is het voorkeursreactiemedium voor het uitvoeren van Grignard-reacties of reducties met behulp van reagentia zoals LiAlH4. Het wordt ook gebruikt als ligand in coördinatiecomplexen, zoals die af en toe worden gebruikt in stereospecifieke polymerisaties.
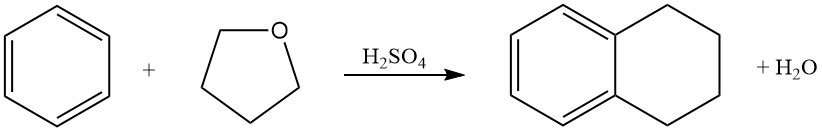
Benzeen reageert met tetrahydrofuraan in zwavelzuur om tetraline (1,2,3,4-tetrahydronaftaleen) te produceren.
THF reageert echter gemakkelijk met zuurstof (bijv. bij contact met lucht), waarbij een onstabiel hydroperoxide als primair product wordt gevormd. De toevoeging van hydrochinon of 2,6-di-tert-butyl-p-cresol (BHT) (bijv. 250 mg/kg) kan de vorming van peroxide remmen. Destillatie van tetrahydrofuraan dat peroxiden bevat, concentreert de peroxiden, wat leidt tot een hoog explosierisico, zelfs op laboratoriumschaal.
3. Productie van tetrahydrofuraan
3.1. Productie van tetrahydrofuraan uit acetyleen en formaldehyde
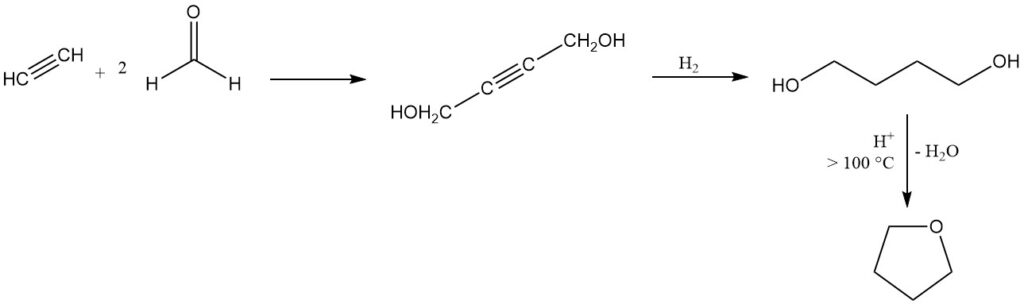
Tetrahydrofuraan wordt geproduceerd door het Reppe-proces, ontwikkeld in de jaren 30, dat nog steeds een dominante industriële methode is in Europa en de Verenigde Staten.
In dit proces reageert acetyleen met formaldehyde om 2-butyn-1,4-diol te produceren, gevolgd door hydrogenering tot 1,4-butaandiol dat vervolgens zuurgekatalyseerde cyclisatie ondergaat met de eliminatie van water boven 100 °C om THF te verkrijgen.
Verschillende katalysatoren zijn geschikt voor deze cyclisatie, waaronder anorganische zuren, zure aluminosilicaten en aard- of zeldzame aardmetaaloxiden. Een bijna kwantitatieve conversie en een opbrengst van bijna 100% kunnen worden bereikt in een continu atmosferisch drukproces met aluminiumoxide als katalysator.
Dit vereist continue destillatie van het gevormde tetrahydrofuraan uit het reactiemengsel terwijl tegelijkertijd zuivere 1,4-butaandiol wordt toegevoerd met een bijpassende consumptiesnelheid. Deze methode heeft een hoge katalysatorefficiëntie, wat zorgt voor een aanzienlijke THF-productie per eenheid katalysator.
BASF had een medium-drukproces ontwikkeld voor selectieve omzetting van ruwe butaandiol in THF met minimale extra energie.
Het THF-stoommengsel dat wordt verkregen uit de cyclisatie wordt eerst gerectificeerd om de overeenkomstige azeotroop (5,3 gew.% water, kookpunt 62,3 °C) te isoleren, die wordt behandeld met alkalihydroxide, gevolgd door destillatie om watervrij THF te verkrijgen.
Industriële processen kunnen de vorming van azeotroopmengsels overwinnen door destillatie onder druk.
3.2. Productie van tetrahydrofuraan door butadieenacetoxylering
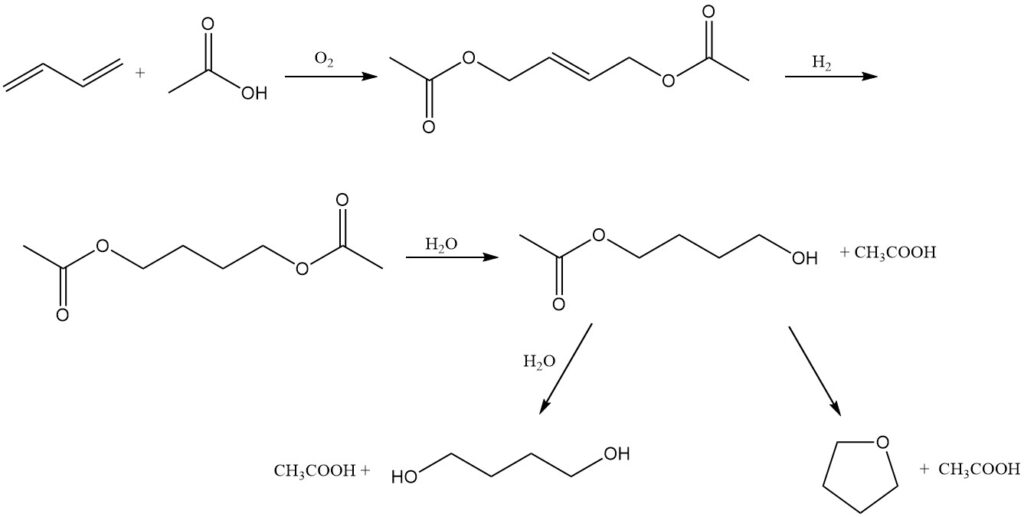
Mitsubishi-Kasei Corporation in Japan biedt een alternatieve route voor de coproductie van 1,4-butaandiol en tetrahydrofuraan, waarbij butadieen als uitgangsmateriaal wordt gebruikt. Dit proces kan worden verklaard door de volgende reacties:
Oxidatie: Butadieen ondergaat oxidatie bij 3 MPa en 80 °C in aanwezigheid van een palladium-telluriumkatalysator, azijnzuur en een stikstof-zuurstofmengsel. Deze reactie levert 1,4-diacetoxy-2-buteen op.
Hydrogenering: Het verkregen 1,4-diacetoxy-2-buteen wordt vervolgens gehydrogeneerd om 1,4-diacetoxybutaan te vormen.
Hydrolyse: Ten slotte wordt 1,4-diacetoxybutaan gehydrolyseerd tot 1,4-butaandiol of THF.
3.3. Productie van tetrahydrofuraan door middel van propyleenoxideproces
Arco produceert 1,4-butaandiol via een proces dat de volgende stappen omvat:
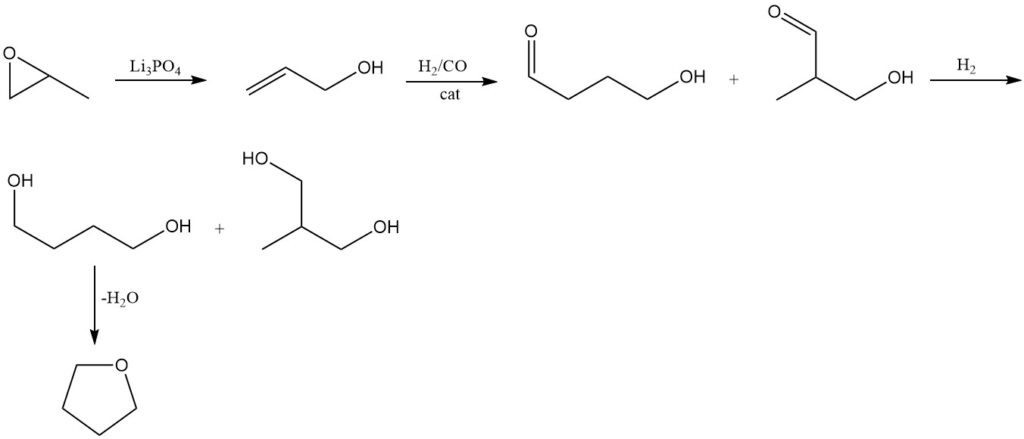
Propyleenoxide wordt geïsomeriseerd tot allylalcohol met behulp van conventionele methoden bij 250–300 °C en 1 MPa druk over een trilithiumorthofosfaat (Li3PO4) katalysator.
De resulterende allylalcohol ondergaat hydroformylering met behulp van het Kuraray-proces. Deze reactie produceert 4-hydroxybutyraldehyde als het primaire product samen met 3-hydroxy-2-methylpropionaldehyde als een bijproduct.
Vervolgens vormt hydrogenering van de verkregen aldehyden 1,4-butaandiol als het hoofdproduct, vergezeld door de vorming van 2-methyl-1,3-propaandiol.
Net als bij de vorige methoden wordt tetrahydrofuraan geproduceerd door 1,4-butaandiol te dehydrateren met behulp van een zure katalysator.
3.4. Productie van tetrahydrofuraan door hydrogenering van maleïnezuuranhydride
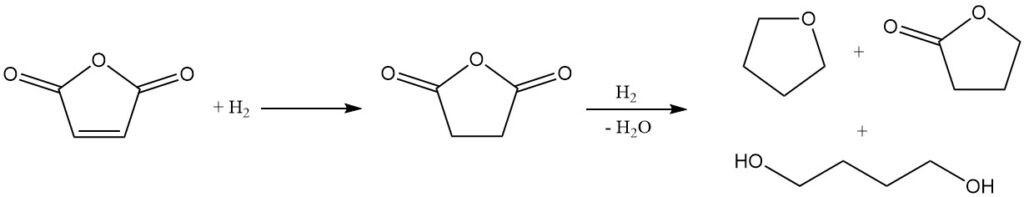
Vanwege de chemische structuur is maleïnezuuranhydride een veelbelovend startmateriaal voor de synthese van butaandiol, THF en γ-butyrolacton. Mitsubishi-Kasei ontwikkelde en implementeerde oorspronkelijk een proces op industriële schaal met maleïnezuuranhydride. Sindsdien hebben ze deze methode echter verlaten ten gunste van hun nieuwere butadieenacetoxyleringsproces.
Verschillende bedrijven, waaronder Davy-McKee Ltd., BP, Sohio en Shinwha Petrochemical, hebben vergelijkbare processen aangenomen voor de productie van butaandiol en tetrahydrofuraan. Shinwha Petrochemical in Zuid-Korea exploiteert bijvoorbeeld een fabriek op basis van het McKee-proces, met een capaciteit van 20.000 ton butaandiol per jaar.
De eerste stap in dit proces is de hydrogenering van ethylmaleïnezuur in de dampfase. De reactieomstandigheden kunnen worden gemanipuleerd om de verhouding van THF tot butaandiol in het eindproductmengsel te regelen.
Er is een groeiende interesse in het gebruik van maleïnezuuranhydride als grondstof voor de productie van tetrahydrofuraan, en het lijkt aan populariteit te winnen als mogelijke vervanger voor het Reppe-proces.
3.5. Productie van tetrahydrofuraan door n-butaan-maleïnezuuranhydrideproces
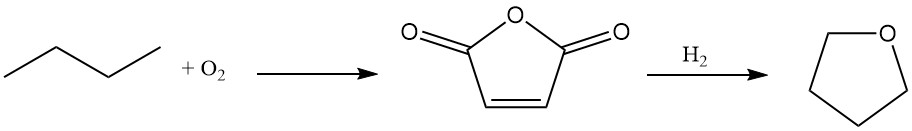
Du Pont biedt een nieuw twee-fasen proces voor tetrahydrofuraansynthese met n-butaan als uitgangsmateriaal.
n-butaan wordt geoxideerd tot maleïnezuuranhydride met een hoge opbrengst (70–75%) met behulp van een unieke, transporteerbare en slijtvaste oxidatiekatalysator.
De resulterende waterige maleïnezuuroplossing ondergaat hydrogenering over een gespecialiseerde rhenium-gedoteerde palladiumkatalysator. Deze stap biedt flexibiliteit, waardoor de selectieve productie van butaandiol of THF mogelijk is op basis van procesvereisten.
Het proces is succesvol getest en geïmplementeerd in de Spaanse provincie Asturië, met een jaarlijkse productiecapaciteit van 45.000 ton.
3.6. Productie van tetrahydrofuraan door pentosan/furfuralprocessen
De interesse in de productie van tetrahydrofuraan uit furfural is toegenomen door het gebruik van hernieuwbare bronnen. Pentosanen, die veel voorkomen in landbouwafvalproducten, zijn de uitgangsmaterialen.
Het proces voor de productie van THF uit furfural omvat twee katalytische stappen:
- Furfural ondergaat katalytische decarbonylering om furaan te vormen.
- De furaan wordt vervolgens gehydrogeneerd om THF te produceren.
4. Toepassingen van tetrahydrofuraan
Tetrahydrofuraan wordt in verschillende sectoren gebruikt, waarbij het grootste volume als monomeer voor poly(tetramethyleenoxide) (PTMO), ook bekend als poly(tetramethyleenetherglycol) (PTMEG) of polytetrahydrofuraan (PTHF), wordt gebruikt. PTMO is een belangrijk onderdeel in de productie van:
- Thermoplastische polyurethanen
- Elastische vezels
- Gegoten elastomeren
- Copolyesters
- Copolyamiden
- Polyurethaancoatings
Commercieel PTMO is verkrijgbaar onder verschillende handelsnamen, waaronder Terathane (DuPont), Polytetrahydrofuraan (BASF) en Polymeg (Quaker Oats).
Een kleiner deel van THF wordt gebruikt als oplosmiddel voor toepassingen zoals coatings, kleefstoffen en speciale lakken op basis van materialen zoals poly(vinylchloride) (PVC) of polyurethanen en als cosolvent in drukinkten, als extractiemiddel en als reactiemedium, met name voor organometaalsyntheses in de organische chemie.
Het is ook een veelgebruikt laboratoriumreagens en een tussenproduct in de chemische syntheses van consumenten- en industriële producten zoals voeding, farmaceutica en insecticiden.
5. Toxicologie van tetrahydrofuraan
Uitgebreid onderzoek door het Industrial Hygiene and Pharmacology Institute van BASF suggereert dat THF minimale toxiciteit vertoont, vergelijkbaar met aceton, wat in contrast staat met eerdere rapporten die waarschijnlijk gebaseerd zijn op onzuivere monsters.
Dierstudies met chronische blootstelling (1 jaar aan 1000 ppm, 2 jaar aan 3000 ppm) aan THF lieten geen significante vergiftigingsverschijnselen zien bij ratten, katten of konijnen. Deze concentraties (1000-3000 ppm) zouden echter ernstige irritatie van de slijmvliezen bij mensen veroorzaken.
Net als ethanol wordt THF snel door het lichaam gemetaboliseerd.
Vanwege de sterke oplosmiddeleigenschappen lost tetrahydrofuraan de buitenste keratinelagen van de huid en slijmvliezen op, waardoor het snel diepere weefsels binnendringt. Deze eigenschap leidt tot ernstige irritatie, maar veroorzaakt geen sensibilisatie (allergische reactie).
Peroxidevorming tijdens opslag kan huidirritatie verergeren en contact met wonden of onder vingernagels kan aanzienlijke pijn veroorzaken.
THF wordt gemakkelijk door de huid opgenomen, net als methanol. Langdurig huidcontact moet worden vermeden en geschikte handbescherming wordt aanbevolen.
De vastgestelde blootstellingslimiet voor tetrahydrofuraan op de werkplek is 200 ppm (mL/m³). Deze waarde is ingesteld om lokale irritatie van de slijmvliezen aan te pakken die wordt veroorzaakt door THF-dampen, niet de narcotische effecten ervan, waarvoor veel hogere concentraties nodig zijn.
Referenties
- Tetrahydrofuran, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_221.pub3
- Polyethers, Tetrahydrofuran and Oxetane Polymers; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.2005201816182103.a01
- Tetrahydrofuran; Hamilton & Hardy’s Industrial Toxicology. – https://onlinelibrary.wiley.com/doi/10.1002/9781118834015.ch70




