Wat is propionzuur?
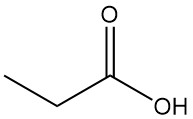
Propionzuur is een natuurlijk voorkomend kortketencarbonzuur met de formule CH3CH2COOH. Het is een kleurloze vloeistof met een scherpe geur, vaak beschreven als lijkend op zweet of kaas.
Propionzuur werd voor het eerst beschreven door J. Gottlieb in 1844 en geclassificeerd als een vetzuur door J.J. Dumas in 1848. De naam is afkomstig van de Griekse woorden “protos” (eerste) en “pion” (vet), wat de positie weerspiegelt als het eerste vetzuur dat isoleerbaar is uit een waterige oplossing door uitzouten.
Propionzuur bestaat van nature, voornamelijk als esters in essentiële oliën. Het kan ook worden gevormd als een vrij zuur door verschillende enzymatische en fermentatieprocessen. Het is een product van anaërobe koolhydraatfermentatie in de maag van herkauwers. Propionzuurderivaten worden gebruikt als tussenproducten in verschillende fysiologische cycli.
Propionzuur wordt gebruikt bij de productie van cellulose-esters, plasticdispersies en herbiciden, en het vindt beperkt gebruik in farmaceutica, smaakstoffen en geuren.
Het wordt ook gebruikt als conserveermiddel voor levensmiddelen vanwege zijn fungicide en bacteriedodende eigenschappen, en het wordt steeds vaker gebruikt om schimmel- en bacteriebederf in graangewassen, diervoeders, bakkerijproducten en kaas te voorkomen.
Inhoudsopgave
1. Fysische eigenschappen van propionzuur
Propionzuur is een kleurloze vloeistof met een scherpe geur. Vast propionzuur kristalliseert in het monokliene systeem en zet uit met 12,2% volume bij het smelten. Net als zijn lagere homologen, azijnzuur en mierenzuur, dimeriseert een aanzienlijk deel van de propionzuurmoleculen in zowel de vloeibare als de gasfase.
Propionzuur is mengbaar met water en de meeste organische oplosmiddelen in alle verhoudingen. Het vormt azeotrope mengsels met verschillende vloeistoffen, waaronder water (82,3 gew.% water, kookpunt 99,98 °C bij 101,3 kPa).
Tabellen 1, 2 en 3 bevatten temperatuurafhankelijke gegevens voor propionzuur, waaronder respectievelijk dampspanning, dichtheid en dynamische viscositeit.
| Temperatuur (°C) | Druk (kPa) |
|---|---|
| 0,7 | 0,1 |
| 13,5 | 0,25 |
| 24,0 | 0,5 |
| 35,0 | 1,0 |
| 50,8 | 2,5 |
| 64,5 | 5,0 |
| 79,3 | 10,0 |
| 100,9 | 25 |
| 120,1 | 50 |
| 140,9 | 100 |
| 159,5 | 200 |
| 185,7 | 500 |
| 203,0 | 1000 |
| 219,7 | 2000 |
| Temperatuur (°C) | Dichtheid (g/cm³) |
|---|---|
| -20 | 1,038 |
| -10 | 1,027 |
| 0 | 1,016 |
| 10 | 1,005 |
| 20 | 0,9935 |
| 80 | 0,9286 |
| 90 | 0,9176 |
| 100 | 0,9066 |
| 110 | 0,8954 |
| 120 | 0,8841 |
| 130 | 0,8726 |
| 140 | 0,8609 |
| 150 | 0,849 |
| 160 | 0,8367 |
| 170 | 0,8241 |
| Temperatuur (°C) | Viscositeit (mPa·s) |
|---|---|
| 0 | 154,1 |
| 20 | 109,4 |
| 50 | 73,8 |
| 100 | 45,0 |
| 150 | 31,0 |
Andere fysische eigenschappen van propionzuur staan in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS | [79-09-4] |
| Formule | CH3CH2COOH |
| Moleculair gewicht | 74,08 g/mol |
| Smeltpunt | -20,8 °C |
| Kookpunt | 141,3 °C |
| Breukindex | 1,3865 |
| Oppervlaktespanning naar lucht bij | |
| 20 °C | 26,7 × 10-3 N/m |
| 90 °C | 19,7 × 10-3 N/m |
| Thermische geleidbaarheid bij | |
| 0 °C | 153 W m-1 K-1 |
| 20 °C | 150 W m-1 K-1 |
| 50 °C | 144 W m-1 K-1 |
| 100 °C | 136 W m-1 K-1 |
| Elektrische geleidbaarheid bij 2 °C | 10-4 μS/cm |
| Dynamische diëlektrische constante bij | |
| 10 °C | 3,30 |
| 40 °C | 3,44 |
| Elektrisch dipoolmoment, μ | 1,75 D ± 5% |
| Dissociatieconstante in H2O bij | |
| 0 °C | 1,274 × 10-5 mol/L |
| 20 °C | 1,338 × 10-5 mol/L |
| 40 °C | 1,284 × 10-5 mol/L |
| 60 °C | 1,160 × 10-5 mol/L |
| Ionisatiepotentiaal | 10,24 ± 0,03 eV |
| Smeltwarmte | 101,65 kJ/kg |
| Verdampingswarmte | 418,7 kJ/kg |
| Formatiewarmte | -164,5 kJ/mol |
| Verbrandingswarmte | -1528,3 kJ/mol |
| Soortelijke warmte (vloeistof), bij | |
| 0 °C | 2,077 kJ kg-1 K-1 |
| 50 °C | 2,299 kJ kg-1 K-1 |
| 100 °C | 2,516 kJ kg-1 K-1 |
| Soortelijke warmte (damp), bij | |
| 100 °C | 2,823 kJ kg-1 K-1 |
| 200 °C | 3,245 kJ kg-1 K-1 |
| 300 °C | 3,647 kJ kg-1 K-1 |
| Isentropische samendrukbaarheid bij 20 °C | 0,750 GPa |
| Kritische temperatuur | 338,9 °C |
| Kritische druk | 5,37 MPa |
| Kritisch volume | 0,322 kg/L |
| Vlampunt | 50 °C |
| Ontstekingstemperatuur | 485 °C |
| Explosiegrenzen in lucht bij 20 °C | 2,1–12,0 vol% |
2. Reacties van propionzuur
Propionzuur is het derde lid van de alifatische monocarbonzuurreeks, die de reactiviteitskenmerken van deze zuren heeft. Het vormt gemakkelijk zouten, amiden, zuurhalogeniden en anhydriden.
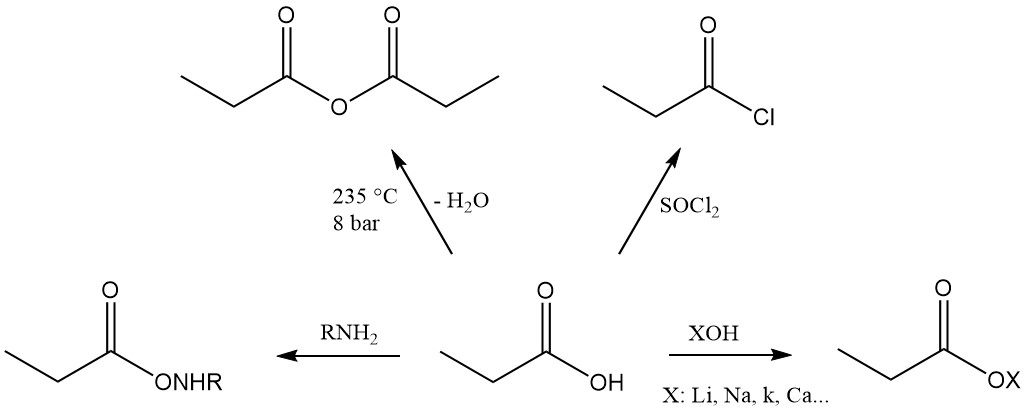
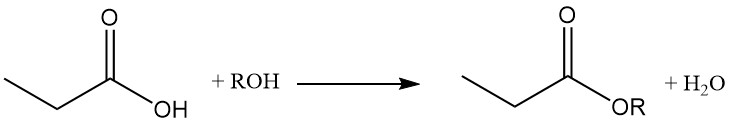
Propionzuuresters worden gevormd door een reactie met alcoholen en olefinen, terwijl de reactie met acetylenen de overeenkomstige vinylesters oplevert.
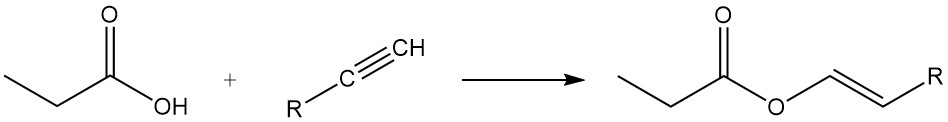
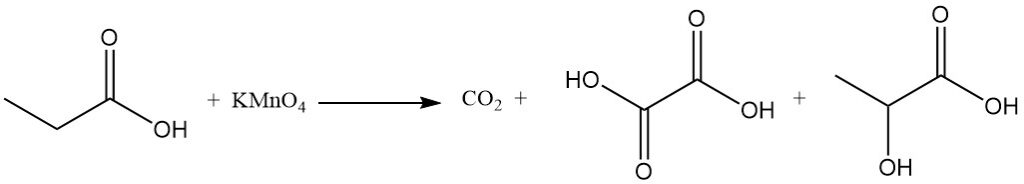
De reactiviteit van propionzuur verschilt van die van azijnzuur vanwege het inductieve effect van de methyleengroep. Dit maakt propionzuur gevoeliger voor aanvallen door alkalische permanganaatoplossingen vergeleken met azijnzuur. Het afbraakproces is niet-selectief, wat resulteert in een mengsel van koolstofdioxide, oxaalzuur en melkzuur.
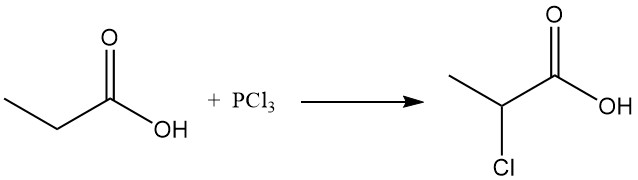
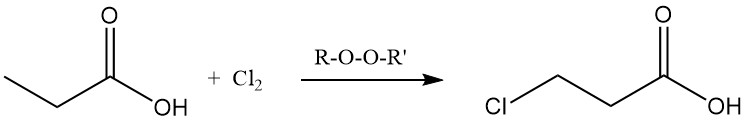
Ionische substitutiereacties vertonen ook een voorkeur voor de methyleengroep. Chlorering met behulp van halogeen-overdrachtsreagentia, zoals PCl3, leidt tot de vorming van α-chloorpropionzuur, terwijl radicale chlorering geïnduceerd door peroxiden of UV-straling β-chloorpropionzuur oplevert. Beide producten worden gebruikt als tussenproducten in de productie van herbiciden en farmaceutica.
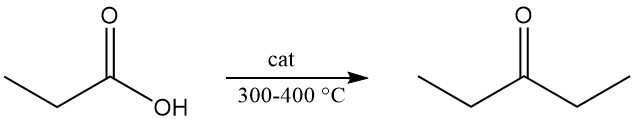
Door thermische ontleding van calciumpropionaat of propionzuurdamp die over metaaloxiden wordt geleid bij 300–400 °C ontstaat di-ethylketon, een veelgebruikt industrieel oplosmiddel.
3. Industriële productie van propionzuur
Propionzuur wordt industrieel geproduceerd door de carbonylering van ethyleen of de oxidatie van propanal.
Het kan ook worden geproduceerd als bijproducten van hydroxylaminezoutsynthese uit 1-nitropropaan, uit houtdestillatie, door salpeterzuuroxidatie van 1-propanol, door alkalismelting van n-propanol en isopropanolmengsels en door carbonylering van ethanol en azijnzuur. Al deze methoden zijn echter verouderd.
Andere potentiële, maar economisch niet-levensvatbare, bronnen van propionzuur zijn onder andere:
- Bijproductvorming: Propionzuur kan worden gevormd als bijproduct tijdens processen zoals methanol carbonylering en n-buteenoxidatie, maar de opbrengst is relatief laag.
- Directe ethyleenreactie: De directe reactie van ethyleen, koolmonoxide en water over specifieke katalysatoren heeft potentieel, maar is nog niet concurrerend.
- C1-processen: Tweestapsreacties met behulp van synthesegas en rhodiumkatalysatoren zijn beschreven voor de productie van propionzuur, maar de huidige beschikbaarheid van bronnen maakt ze minder aantrekkelijk.
Voor toepassingen waarvoor “natuurlijk” propionzuur nodig is, met name in smaken en geuren, zijn microbiologische en enzymatische processen ontwikkeld op basis van het fermenteren van zetmeel of suikers. De hoge productiekosten beperken het gebruik ervan echter tot gespecialiseerde toepassingen.
3.1. Productie van propionzuur door carbonylering van ethyleen (BASF-proces)
Het BASF-proces voor de productie van propionzuur maakt gebruik van de Reppe-synthese. Deze reactie omvat de reactie van ethyleen met koolmonoxide en water onder hoge druk, waarbij Ni(CO)4 als katalysator wordt gebruikt.
C2H4 + CO + H2O → CH3CH2COOH
Dit proces biedt verschillende voordelen, zoals lage grondstofkosten, hoge conversie en opbrengst van propionzuur en een eenvoudige opwerkingsprocedure.
Een eenvoudige industriële procesbeschrijving wordt weergegeven in Figuur 1.
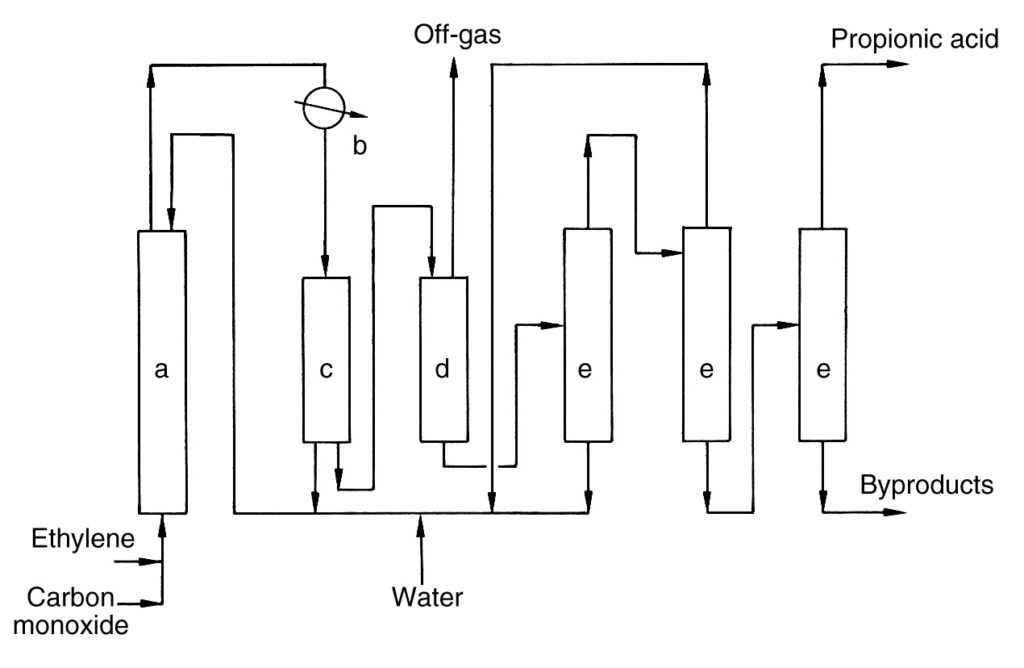
a) Hogedrukreactor; b) Warmtewisselaar; c) Separator; d) Expansievat; e) Destillatiekolom
Ethyleen en koolmonoxide worden samengeperst en continu samen met een recyclestroom in de hogedrukreactor (a) gevoerd. De reactie verloopt bij 100–300 bar en 250–320 °C. Ruw propionzuur wordt gevormd en uit de reactorkop gehaald.
Het ruwe product wordt gekoeld in een warmtewisselaar (b), waardoor stoom ontstaat. Een deel van het gekoelde product wordt gerecycled naar de reactor (c) voor temperatuurregeling, terwijl de hoofdstroom wordt gedecomprimeerd (d).
De gedecomprimeerde stroom splitst zich in een afgasstroom en een ruwe zuurstroom. Nikkelkatalysator wordt uit het afgas gewonnen en terug naar de reactor gerecycled. Het afgas wordt verbrand met warmteterugwinning.
Het ruwe zuur wordt gedehydrateerd en verder gezuiverd via meerdere destillatiekolommen (e). Nikkelzouten die tijdens het proces worden gevormd, worden gerecycled. De laatste destillatie levert zuiver propionzuur op en het productresidu wordt uit het proces verwijderd.
Boorzuur zou de reactiesnelheid verbeteren en katalysatorzoutneerslag voorkomen.
3.2. Productie van propionzuur door oxidatie van propanal
Propionzuur wordt commercieel geproduceerd door propanaloxidatie. Dit proces omvat twee stappen: propanalproductie en gekatalyseerde carbonylering.
Propanal wordt gevormd als tussenproduct tijdens de productie van n-propanol via ethyleenhydroformylering. In tegenstelling tot hogere aldehyden worden er geen n/iso-isomeermengsels gevormd. Het wordt industrieel geproduceerd door hogedrukkobaltgekatalyseerde carbonylering of door lagedrukrodium/iridiumgekatalyseerde carbonylering.
Het gemakkelijk verkregen propanal wordt vervolgens selectief geoxideerd tot propionzuur onder milde omstandigheden (40–50 °C).
Deze tweestapsmethode zorgt ervoor dat bestaande installaties worden gebruikt voor zowel propanalproductie als daaropvolgende oxidatie. Bedrijven als Dow (voorheen Union Carbide) en Eastman in de Verenigde Staten gebruiken deze methode voor de productie van propionzuur.
3.3. Productie van propionzuur door directe oxidatie van koolwaterstoffen
Historisch gezien werd een aanzienlijk deel van propionzuur geproduceerd via de directe oxidatie van koolwaterstoffen, voornamelijk nafta. Dit proces, voornamelijk gebruikt voor de productie van azijnzuur, genereerde ook mierenzuur, propionzuur, een mengsel van boterzuur-isomeren en methylethylketon als bijproducten.
Hoewel deze methode voordelen bood in termen van grondstofkosten, bracht het proces aanzienlijke uitdagingen met zich mee:
- Complex productmengsel: Het oxidatieproces leverde een complex mengsel van verschillende organische zuren op, waarvoor een geavanceerd en duur scheidingsproces nodig was.
- Beperkte productcontrole: De reactieomstandigheden boden minimale controle over de specifieke verhoudingen van gevormde producten, waardoor het moeilijk was om aan te passen aan fluctuerende marktvraag.
- Hoog energieverbruik: Het scheidingsproces dat met deze technologie gepaard gaat, resulteert in een hoog energieverbruik.
Deze nadelen leidde uiteindelijk tot het volledig verlaten van deze technologie. In 2009 waren alle operationele fabrieken die dit proces gebruikten gesloten, met als laatste de Celanese-fabriek in Pampa, Texas.
Een beschrijving van het BP Chemicals-proces (Figuur 2), een historisch voorbeeld van directe koolwaterstofoxidatie, wordt gegeven ter referentie.
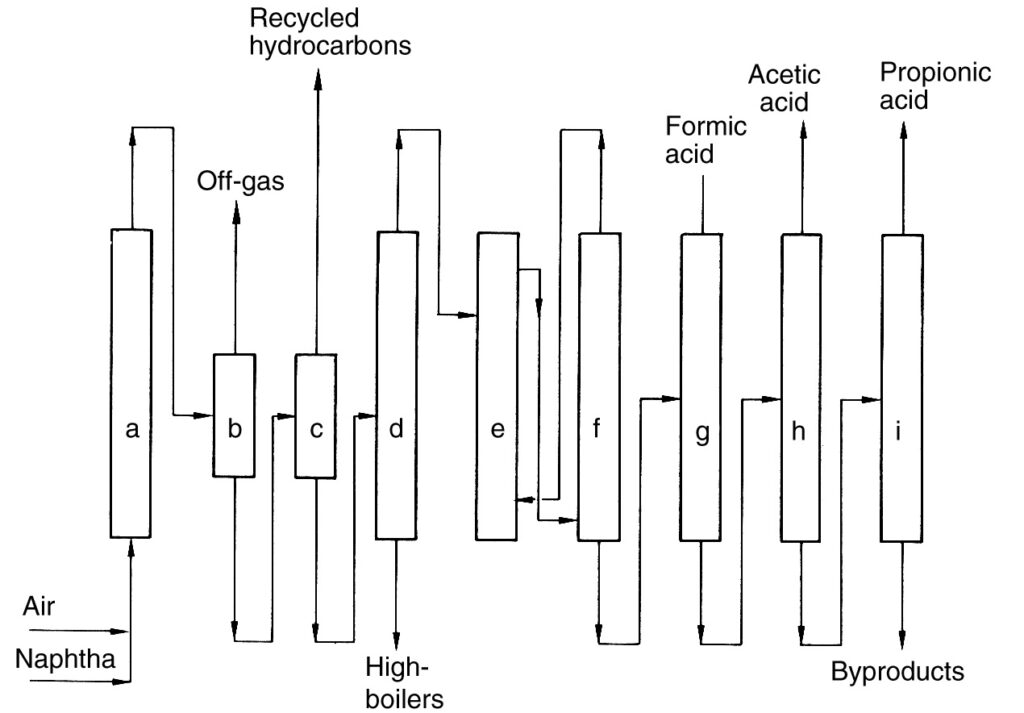
a) Reactor; b) Gas-vloeistofscheider; c) Vloeistof-vloeistofscheider; d) Destillatiekolom; e) Extractie; f) Scheiding van het extractiemiddel; g) Destillatie van mierenzuur; h) Destillatie van azijnzuur; i) Destillatie van propionzuur
In dit proces werd nafta voorverwarmd en vervolgens geoxideerd met lucht bij verhoogde druk (40–45 bar) in een reeks reactoren (a). De reactie genereerde warmte, die werd gebruikt voor stoomproductie.
Het gekoelde reactoreffluent werd gescheiden van het reactiegas in een separator (b). De teruggewonnen vloeistof werd teruggevoerd naar de reactoren, terwijl het afgas werd verbrand. Het resterende vloeibare product werd vervolgens gescheiden in een organische fase (niet-gereageerde koolwaterstoffen) en een waterige fase die het productmengsel bevatte (c). Niet-gereageerde koolwaterstoffen werden gerecycled.
De waterige fase onderging scheiding van laag- en hoogkokende componenten, gevolgd door extractiedehydratie (e) om het ruwe zuur te verkrijgen. Ten slotte werden fractionele destillatiestappen (g)–(i) gebruikt om C1- tot C4-carbonzuren te isoleren.
3.4. Productie van propionzuur door fermentatie
Terwijl petrochemische processen de industriële productie van propionzuur domineren, biedt fermentatie met behulp van Propionibacterium-soorten een biobased alternatief. Deze grampositieve, niet-beweeglijke, staafvormige bacteriën worden over het algemeen erkend als veilig (GRAS), waardoor het resulterende propionzuur geschikt is voor toepassingen zoals voedsel, veevoer, farmaceutica en cosmetica.
Propionibacteriën gebruiken het dicarbonzuurpad om glucose (of andere koolstofbronnen) om te zetten in propionzuur. Dit pad omvat pyruvaat als een belangrijk tussenproduct. Pyruvaat kan ofwel worden gecarboxyleerd tot oxaalacetaat, wat leidt tot propionzuurbiosynthese, of worden gedecarboxyleerd tot acetyl-CoA, wat leidt tot azijnzuurbiosynthese.
De coproductie van propionzuur en azijnzuur handhaaft de redoxbalans.
Theoretisch gezien kan 1,5 mol glucose 2 mol propionaat, 1 mol acetaat en 1 mol CO2 opleveren via het Embden-Meyerhof-Parnas (EMP) pad. Dit vertaalt zich naar een maximale opbrengst aan propionzuur van 0,548 g/g glucose en een propionzuur-tot-azijnzuurverhouding van 2.
Het pentosefosfaatpad (HMP) kan leiden tot hogere opbrengsten aan propionzuur (tot 0,68 g/g) met minder geproduceerd azijnzuur. Barnsteenzuur is een veelvoorkomend bijproduct in dit proces.
De werkelijke opbrengst aan propionzuur hangt sterk af van het gekozen substraat en de fermentatieomstandigheden.
Propionzuurfermentatie vindt doorgaans plaats onder anaërobe omstandigheden (gespoeld met stikstofgas) bij 30–32 °C en pH 6,0–7,0. Het fermentatiemedium vereist buffering (bijv. CaCO3) of toevoeging van base (bijv. ammoniumhydroxide) om de geproduceerde zuren te neutraliseren, aangezien de groei van propionibacteriën stopt onder pH 4,5.
Het medium omvat doorgaans een koolstofbron (bijv. glucose), stikstofbron (bijv. ammoniak), mineralen en vitaminen. Propionibacteriën kunnen verschillende koolstofbronnen gebruiken, waaronder suikers, lactaat, glycerol en sorbitol.
Industriële processen maken vaak gebruik van goedkope grondstoffen zoals weipermeaat, melasse of biodieselafvalglycerol, aangevuld met stikstofbronnen zoals gistextract.
Propionzuur zelf fungeert als een fermentatieremmer en vermindert de groei- en productiesnelheid bij concentraties van meer dan 10 g/l. Conventionele fermentatieprocessen duren meestal 3 dagen om ongeveer 20 g/l propionzuur te bereiken met een opbrengst van 0,4 g/g glucose of minder.
Uitgebreid onderzoek heeft zich gericht op het verbeteren van de opbrengst, concentratie en productiesnelheid door middel van stamontwikkeling en procesoptimalisatie.
4. Toepassingen van propionzuur
4.1. Toepassingen van propionzuur als conserveermiddel voor voedsel en veevoer
Propionzuur en zijn zouten (propionaten) worden veel gebruikt als conserveermiddelen vanwege hun vermogen om bacteriën, schimmels, insecten, virussen en mijten te remmen.
Het exacte werkingsmechanisme wordt nog onderzocht, maar men denkt dat de ongedissocieerde vorm van propionzuur (dominant bij zure pH) verantwoordelijk is voor het conserverende effect. Deze vorm dringt cellen binnen als een voedingsstof en verstoort essentiële enzymen voor koolhydraatmetabolisme.
Propionaten hebben hydrolyse nodig om de actieve zuurvorm vrij te geven, waardoor ze langzamer en minder effectief zijn dan propionzuur zelf.
Propionzuur vertoont een breed spectrum aan activiteit tegen verschillende micro-organismen, met een minimale remmende concentratie (MIC) van 0,05–0,50 gew.% tegen schimmels, 0,25–0,50 gew.% tegen bacteriën en 0,10–1,0 gew.% tegen gisten.
Het is effectief tegen bederfschimmels in voedsel en veevoer en effectiever tegen gramnegatieve bacteriën (bijv. E. coli, Salmonella). Het inactiveert ook virussen zoals het Vaccinia-virus bij concentraties boven 1,0 gew.% en doodt mijten en maïskevers in granen.
Propionzuur heeft een sterke geur, wat het gebruik ervan bij het conserveren van voedsel beperkt. Propionaten (calcium-, natrium- en ammoniumzouten) hebben de voorkeur in voedsel vanwege hun bijna neutrale smaak en geur.
Beide vormen worden gebruikt bij het conserveren van veevoer, waarbij dieren vaak de zure smaak van met propionzuur geconserveerd veevoer prefereren.
Propionzuur en zijn zouten worden over het algemeen erkend als veilig (GRAS) voor verschillende voedseltoepassingen in de VS en Europa. De FAO/WHO heeft geen specifieke beperkingen op hun dagelijkse inname.
4.2. Andere toepassingen
Propionzuur wordt gebruikt in andere industrieën zoals rubber, polymeren, oplosmiddelen, smaakstoffen, geuren, farmaceutica en herbiciden.
Zink-, cadmium-, lood- en kwikpropionaten kunnen worden gebruikt als vulkanisatieregelaars, die het proces van het versterken van rubber tijdens de productie beïnvloeden.
Propionzuur wordt gebruikt als tussenproduct, vaak in de anhydridevorm, voor de productie van waardevolle esters zoals celluloseacetaatpropionaat en vinylpropionaat.
Methyl-, ethyl-, propyl- en butylpropionaten worden gebruikt als oplosmiddelen voor harsen en verf, en verschillende propionaatesters bezitten karakteristieke fruitige aroma’s, waardoor ze waardevolle ingrediënten zijn in smaak- en geurformules.
Kleine hoeveelheden propionzuur worden omgezet in propionylchloride, een reactief molecuul dat wordt gebruikt om de “propionylgroep” te introduceren tijdens de synthese van bepaalde farmaceutische producten.
Tot eind jaren 80 werd een aanzienlijk deel van propionzuur gebruikt om gechloreerde herbiciden te produceren. De ontwikkeling van krachtigere en veelzijdigere herbiciden heeft echter geleid tot een afname van deze toepassing.
5. Toxicologie van propionzuur
Propionzuur vertoont een lage acute toxiciteit en wordt snel in het lichaam gemetaboliseerd. Het heeft echter irriterende/corrosieve effecten op de huid en ogen. Chronische blootstelling aan hoge concentraties kan lokale veranderingen in het voormaagepitheel van sommige diersoorten veroorzaken.
Propionzuur, of de geactiveerde vorm ervan, propionyl-CoA, is een natuurlijk tussenproduct in het menselijk metabolisme. Het wordt gemakkelijk opgenomen en gemetaboliseerd door de lever.
Propionzuur heeft een lage orale en inhalatietoxiciteit. Natrium- en calciumpropionaten zijn nog minder giftig. Huidcontact kan irritatie of corrosie veroorzaken.
Langdurige blootstelling aan hoge concentraties (>0,4%) bij ratten kan veranderingen in de voormaagwand veroorzaken. Beaglehonden, die geen voormaag hebben, vertoonden deze effecten echter niet.
Studies hebben geen bewijs geleverd dat propionzuur of propionaten genetische mutaties veroorzaken. Studies bij drachtige dieren hebben geen ontwikkelingsafwijkingen aan het licht gebracht die werden veroorzaakt door blootstelling aan propionzuur.
Beperkte menselijke studies suggereren dat propionzuur oraal goed wordt verdragen bij lage doses. Natriumpropionaatoplossingen zijn veilig gebruikt voor oogbehandeling.
Referentie
- Propionic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_223.pub4