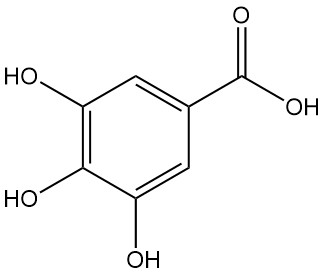
Wat is galluszuur?
Galluszuur, ook bekend als 3,4,5-trihydroxybenzoëzuur, is een hydroxyaromatisch zuur met de chemische formule C7H6O5. Het is een witte vaste stof, maar lijkt vaak bruin door oxidatie en is oplosbaar in alcohol en polaire oplosmiddelen. Het werd ontdekt door Carl Wilhelm Scheele in 1786.
Galluszuur wordt aangetroffen in de bladeren van berendruif, in granaatappelwortelschors, galnoten, toverhazelaar, sumak, theebladeren, eikenschors en veel andere planten, zowel in zijn vrije toestand als als onderdeel van het tanninemolecuul.
Inhoudsopgave
1. Fysieke eigenschappen van galluszuur
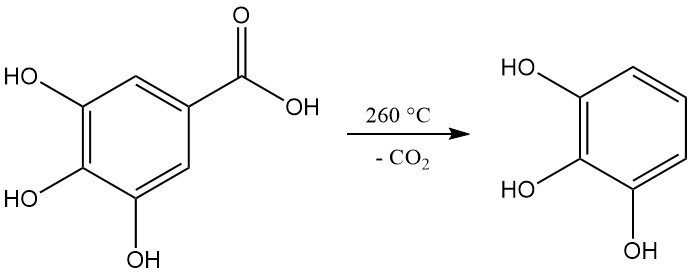
3,4,5-trihydroxybenzoëzuur, algemeen bekend als galluszuur, verschijnt als een wit tot lichtgeel kristallijn poeder. Kristallisatie uit waterige oplossingen geeft een monohydraatvorm in de vorm van zijdeachtige naalden, die bij verhitting tot 258–263 °C uiteenvalt in pyrogallol en koolstofdioxide.
Galluszuur is oplosbaar in warm water, ethanol, di-ethylether en aceton en onoplosbaar in benzeen en chloroform.
De fysieke eigenschappen van galluszuur staan in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [149-91-7] |
| Chemische formule | C7H6O5 |
| Moleculaire massa | 170,12 g/mol |
| Smeltpunt | 258–263 °C (ontleding) |
| Sublimatie Temperatuur | 210 °C |
| Dichtheid bij 25 °C | 1,694 g/cm3 |
| pKa1 bij 30 °C | 2,33 |
| pKa2 | 8,85 |
2. Chemische reacties van galluszuur
Het galluszuurmolecuul bevat twee functionele groepen: hydroxylgroepen (fenolisch) en een carbonzuurgroep. Omdat beide functionele groepen zure waterstofatomen hebben, kunnen ze reageren om talrijke esters, ethers en zouten te vormen, waaronder digallinezuur (1).

Galluszuuroplossingen, met name die met alkalimetaalzouten, zijn gevoelig voor oxidatie door atmosferische zuurstof, wat resulteert in een kleurverandering naar bruin zoals in pyrogallol.
Decarboxylering van galluszuur door verhitting tot een temperatuur boven 260 °C produceert pyrogallol.
Galluszuur is een krachtig reductiemiddel dat goud- of zilverzouten kan reduceren tot hun elementaire vormen.
De reactie van galluszuur met ijzer(III)zouten produceert een intens blauw complex, dat wordt gebruikt in de formulering van inktkleurstoffen. Gallusinkt, samengesteld uit galluszuur en ijzer(II)sulfaat, ondergaat oxidatie in de lucht om het blauwe ijzer(III)-galluszuurcomplex te genereren.
Het verwarmen van galluszuur met geconcentreerd zwavelzuur produceert hexahydroxyantrachinon (2; rufigallic acid) door condensatiereactie.

De reactie met p-nitrosodimethylanilinehydrochloride vormt oxazinederivaten.
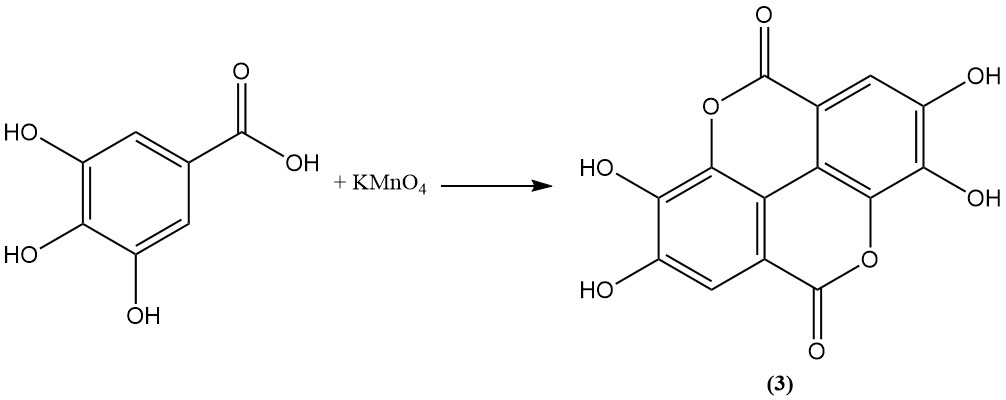
Oxidatie van galluszuur met behulp van arseenzuur, permanganaat, persulfaat of jodium leidt tot de vorming van ellaginezuur (3).
De carbonzuurgroep van galluszuur kan worden veresterd met alcoholen door azeotrope verestering of door de Fischer-methode met behulp van alcohol met zoutzuur.

Ether-esterderivaten van galluszuur kunnen worden bereid door alkylering met behulp van dialkylsulfaten of alkylhaliden in aanwezigheid van een base of door diazomethaan te gebruiken.
De hydroxylgroep op de 4-positie is reactiever vergeleken met de anderen. Gedeeltelijke hydrolyse van 3,4,5-trimethoxybenzoëzuur met behulp van sterke zuren produceert 4-hydroxy-3,5-dimethoxybenzoëzuur (4) (syringinezuur).

3. Productie van galluszuur
Galluszuur is een bestanddeel van talrijke looistoffen en bestaat in vrije vorm of is gebonden aan tannines in natuurlijke bronnen zoals divi-divi, eikenschors, galnoten, granaatappelwortels, sumak en thee.
Galluszuur wordt geproduceerd uit tanninerijke waterige galnootextracten door zure hydrolyse met zwavelzuur bij 110–120 °C of door alkalische behandeling.

Het kan ook worden bereid door enzymatische splitsing van tannine door tannase of door fermentatie met behulp van schimmels zoals Penicillium glaucum en Aspergillus niger.
Vaste-toestand of ondergedompelde fermentatieprocessen met behulp van vrije of geïmmobiliseerde draadvormige schimmels, zoals R. oryzae en Aspergillus foetidus, zijn ontwikkeld om looizuur te hydrolyseren uit goedkoop tarapoeder of andere goedkope tanninerijke grondstoffen.
Galluszuur wordt vervolgens uit de fermentatieoplossing geëxtraheerd door di-ethylether, wat resulteert in hoge opbrengsten van ongeveer 95%. Dit biosyntheseproces verbruikt minder energie in vergelijking met conventionele zuurhydrolyse.
4. Toepassingen van galluszuur
Galluszuur wordt gebruikt bij de productie van ijzergallnootinkt en verschillende kleurstoffen, waaronder anthragallol, gallocyanine, galloflavine en rufigallic zuur.
Gallaatesters, met name methylgallaat (gallicine) en propylgallaat, worden gebruikt als antioxidanten en conserveermiddelen voor vetten.
Galluszuur wordt gebruikt als reductiemiddel in farmaceutische producten (Dermatol, Airol en bismutzout van galluszuur) en als grondstof voor de productie van de hallucinogene alkaloïde mescaline en trimethoprim (breedspectrumantibioticum).
Galluszuur wordt gebruikt bij de productie van fotografische ontwikkelaars, net als pyrogallol, dat wordt gebruikt bij zuurstofabsorptie en azokleurstofsynthese.
Het wordt ook gebruikt bij het looien van leer vanwege zijn adstringerende eigenschappen en als antioxidant en conserveermiddel in voedingsproducten.
Veel onderzoeken onderzoeken de mogelijke gezondheidsvoordelen van galluszuur als antioxidant, antimicrobieel, ontstekingsremmend en antikankermiddel.
5. Toxicologie van galluszuur
Toxiciteitsonderzoeken naar galluszuur wijzen op een lage acute en subacute toxiciteit. De verbinding veroorzaakte echter hemorragische effecten bij kippenembryo’s, wat de noodzaak van dosisbeperkingen benadrukt.
Gerapporteerde LD50-waarden zijn 320 mg/kg (muis, intraveneus), 5000 mg/kg (konijn, oraal) en 4300 mg/kg (muis, intraperitoneaal). LDL0-waarden zijn 800 mg/kg (muis, intraperitoneaal) en 5 mg/kg (muis, subcutaan, 1 dag drachtig)
Menselijke blootstelling aan galluszuur vindt voornamelijk plaats op het werk en via de voeding.
Het wordt geclassificeerd als een mutageen en een teratogeen.
Referenties
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Organic and Fatty Acid Production, Microbial. – https://www.sciencedirect.com/science/article/abs/pii/B9780123739445001565
- Toxicity of natural products. – https://www.sciencedirect.com/science/article/abs/pii/B9780128243152011891
- https://pubchem.ncbi.nlm.nih.gov/compound/Gallic-Acid