Was ist Propionsäure?
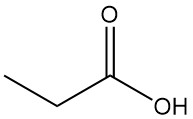
Propionsäure ist eine natürlich vorkommende kurzkettige Carbonsäure mit der Formel CH3CH2COOH. Sie ist eine farblose Flüssigkeit mit einem stechenden Geruch, der oft als schweiß- oder käseähnlich beschrieben wird.
Propionsäure wurde erstmals 1844 von J. Gottlieb beschrieben und 1848 von J.J. Dumas als Fettsäure klassifiziert. Ihr Name stammt von den griechischen Wörtern „protos“ (erste) und „pion“ (Fett), was ihre Position als erste Fettsäure widerspiegelt, die durch Aussalzen aus einer wässrigen Lösung isoliert werden kann.
Propionsäure kommt in der Natur vor, hauptsächlich als Ester in ätherischen Ölen. Sie kann auch durch verschiedene enzymatische und Fermentationsprozesse als freie Säure entstehen. Sie ist ein Produkt der anaeroben Kohlenhydratfermentation im Magen von Wiederkäuern. Propionsäurederivate werden als Zwischenprodukte in mehreren physiologischen Zyklen verwendet.
Propionsäure wird bei der Herstellung von Celluloseestern, Kunststoffdispersionen und Herbiziden verwendet und findet in begrenztem Umfang Anwendung in Arzneimitteln, Aromen und Duftstoffen.
Aufgrund ihrer fungiziden und bakteriziden Eigenschaften wird sie auch als Lebensmittelkonservierungsmittel verwendet und wird zunehmend eingesetzt, um Schimmel und Bakterienverderb in Futtergetreide, Tierfutter, Backwaren und Käse zu verhindern.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Propionsäure
Propionsäure ist eine farblose Flüssigkeit mit stechendem Geruch. Feste Propionsäure kristallisiert im monoklinen System und dehnt sich beim Schmelzen um 12,2 % ihres Volumens aus. Ähnlich wie ihre niederen Homologen, Essigsäure und Ameisensäure, dimerisiert ein erheblicher Teil der Propionsäuremoleküle sowohl in der Flüssig- als auch in der Gasphase.
Propionsäure ist in allen Verhältnissen mit Wasser und den meisten organischen Lösungsmitteln mischbar. Sie bildet azeotrope Gemische mit verschiedenen Flüssigkeiten, einschließlich Wasser (82,3 Gew.-% Wasser, Siedepunkt 99,98 °C bei 101,3 kPa).
Die Tabellen 1, 2 und 3 enthalten temperaturabhängige Daten für Propionsäure, einschließlich Dampfdruck, Dichte und dynamischer Viskosität.
| Temperatur (°C) | Druck (kPa) |
|---|---|
| 0,7 | 0,1 |
| 13,5 | 0,25 |
| 24,0 | 0,5 |
| 35,0 | 1,0 |
| 50,8 | 2,5 |
| 64,5 | 5,0 |
| 79,3 | 10,0 |
| 100,9 | 25 |
| 120,1 | 50 |
| 140,9 | 100 |
| 159,5 | 200 |
| 185,7 | 500 |
| 203,0 | 1000 |
| 219,7 | 2000 |
| Temperatur (°C) | Dichte (g/cm³) |
|---|---|
| -20 | 1,038 |
| -10 | 1,027 |
| 0 | 1,016 |
| 10 | 1,005 |
| 20 | 0,9935 |
| 30 | 0,9827 |
| 40 | 0,9719 |
| 50 | 0,9611 |
| 60 | 0,9503 |
| 70 | 0,9395 |
| 80 | 0,9286 |
| 90 | 0,9176 |
| 100 | 0,9066 |
| 110 | 0,8954 |
| 120 | 0,8841 |
| 130 | 0,8726 |
| 140 | 0,8609 |
| 150 | 0,849 |
| 160 | 0,8367 |
| 170 | 0,8241 |
| Temperatur (°C) | Viskosität (mPa·s) |
|---|---|
| 0 | 154,1 |
| 20 | 109,4 |
| 50 | 73,8 |
| 100 | 45,0 |
| 150 | 31,0 |
Weitere physikalische Eigenschaften der Propionsäure sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS | [79-09-4] |
| Formel | CH3CH2COOH |
| Molekulargewicht | 74,08 g/mol |
| Schmelzpunkt | -20,8 °C |
| Siedepunkt Punkt | 141,3 °C |
| Brechungsindex | 1,3865 |
| Oberflächenspannung gegenüber Luft bei | |
| 20 °C | 26,7 × 10-3 N/m |
| 90 °C | 19,7 × 10-3 N/m |
| Wärmeleitfähigkeit bei | |
| 0 °C | 153 W m-1 K-1 |
| 20 °C | 150 W m-1 K-1 |
| 50 °C | 144 W m-1 K-1 |
| 100 °C | 136 W m-1 K-1 |
| Elektrische Leitfähigkeit bei 2 °C | 10-4 μS/cm |
| Dynamische Dielektrizitätskonstante bei | |
| 10 °C | 3,30 |
| 40 °C | 3,44 |
| Elektrisches Dipolmoment, μ | 1,75 D ± 5 % |
| Dissoziationskonstante in H2O bei | |
| 0 °C | 1,274 × 10-5 mol/L |
| 20 °C | 1,338 × 10-5 mol/L |
| 40 °C | 1,284 × 10-5 mol/L |
| 60 °C | 1,160 × 10-5 mol/L |
| Ionisierungspotential | 10,24 ± 0,03 eV |
| Schmelzwärme | 101,65 kJ/kg |
| Verdampfungswärme | 418,7 kJ/kg |
| Bildungswärme | -164,5 kJ/mol |
| Verbrennungswärme | -1528,3 kJ/mol |
| Spezifische Wärmekapazität (Flüssigkeit), bei | |
| 0 °C | 2,077 kJ kg-1 K-1 |
| 50 °C | 2,299 kJ kg-1 K-1 |
| 100 °C | 2,516 kJ kg-1 K-1 |
| Spezifische Wärmekapazität (Dampf), bei | |
| 100 °C | 2,823 kJ kg-1 K-1 |
| 200 °C | 3,245 kJ kg-1 K-1 |
| 300 °C | 3,647 kJ kg-1 K-1 |
| Isentropische Kompressibilität bei 20 °C | 0,750 GPa |
| Kritische Temperatur | 338,9 °C |
| Kritischer Druck | 5,37 MPa |
| Kritisches Volumen | 0,322 kg/L |
| Flammpunkt | 50 °C |
| Zündtemperatur | 485 °C |
| Explosionsgrenzen in Luft bei 20 °C | 2,1–12,0 Vol.-% |
2. Reactions of Propionic Acid
Propionic acid is the third member of the aliphatic monocarboxylic acid series, which has the reactivity characteristic of these acids. It readily forms salts, amides, acid halides, and anhydrides.
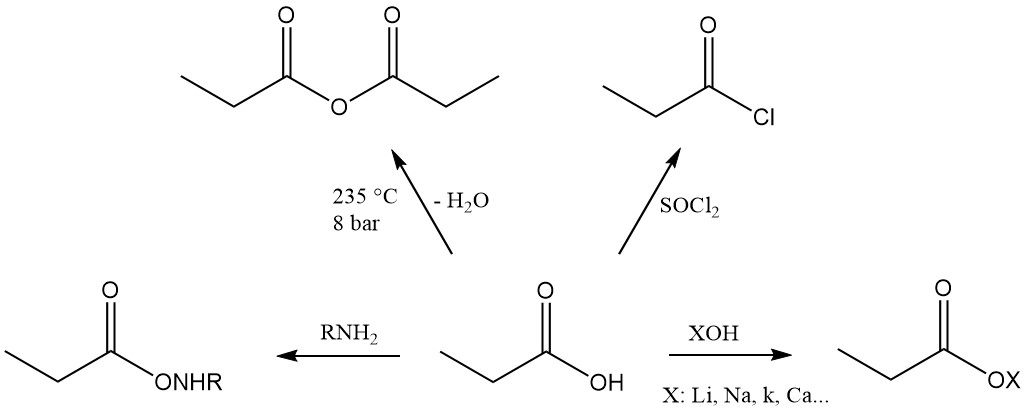
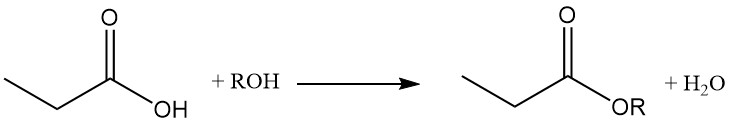
Propionic acid esters are formed by reaction with alcohols and olefins, while the reaction with acetylenes yields corresponding vinyl esters.
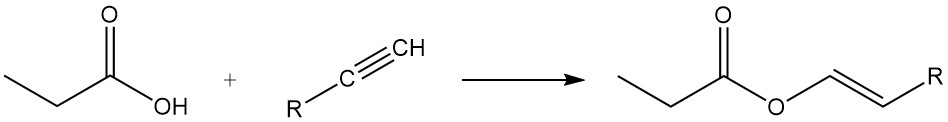
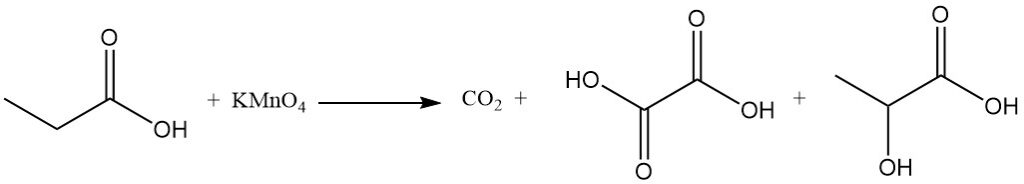
Die Reaktivität von Propionsäure unterscheidet sich von der von Essigsäure aufgrund der induktiven Wirkung der Methylengruppe. Dies macht Propionsäure im Vergleich zu Essigsäure anfälliger für Angriffe durch alkalische Permanganatlösungen. Der Abbauprozess ist nicht selektiv und führt zu einer Mischung aus Kohlendioxid, Oxalsäure und Milchsäure.
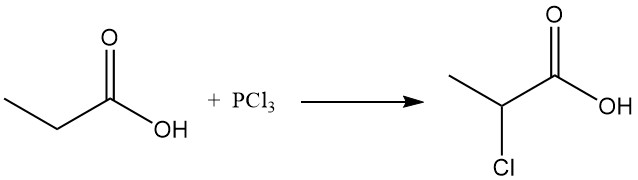
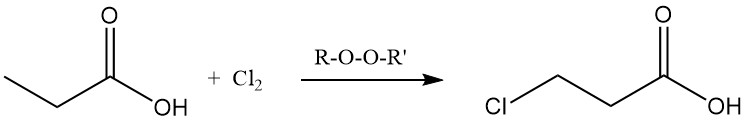
Auch ionische Substitutionsreaktionen zeigen eine Präferenz für die Methylengruppe. Chlorierung mit Halogentransferreagenzien wie PCl3 führt zur Bildung von α-Chlorpropionsäure, während radikalische Chlorierung durch Peroxide oder UV-Strahlung β-Chlorpropionsäure ergibt. Beide Produkte werden als Zwischenprodukte bei der Herstellung von Herbiziden und Pharmazeutika verwendet.
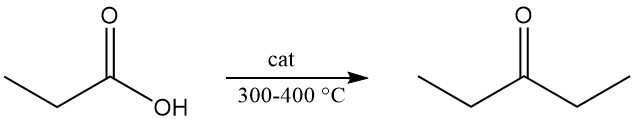
Durch die thermische Zersetzung von Calciumpropionat oder Propionsäuredampf, der bei 300–400 °C über Metalloxide geleitet wird, entsteht Diethylketon, ein weit verbreitetes industrielles Lösungsmittel.
3. Industrielle Produktion von Propionsäure
Propionsäure wird industriell durch die Carbonylierung von Ethylen oder die Oxidation von Propanal hergestellt.
Sie kann auch als Nebenprodukt bei der Synthese von Hydroxylaminsalzen aus 1-Nitropropan, bei der Holzdestillation, durch Salpetersäureoxidation von 1-Propanol, durch alkalisches Schmelzen von n-Propanol- und Isopropanol-Gemischen und durch Carbonylierung von Ethanol und Essigsäure hergestellt werden. Alle diese Methoden sind jedoch veraltet.
Andere potenzielle, aber wirtschaftlich nicht rentable Quellen für Propionsäure sind:
- Nebenproduktbildung: Propionsäure kann als Nebenprodukt bei Prozessen wie der Methanol-Carbonylierung und der n-Buten-Oxidation entstehen, die Ausbeute ist jedoch relativ gering.
- Direkte Ethylenreaktion: Die direkte Reaktion von Ethylen, Kohlenmonoxid und Wasser an bestimmten Katalysatoren hat Potenzial, ist jedoch noch nicht wettbewerbsfähig.
- C1-Prozesse: Für die Produktion von Propionsäure wurden zweistufige Reaktionen unter Verwendung von Synthesegas und Rhodiumkatalysatoren beschrieben, die derzeitige Ressourcenverfügbarkeit macht sie jedoch weniger attraktiv.
Für Anwendungen, die „natürliche“ Propionsäure erfordern, insbesondere in Aromen und Duftstoffen, wurden mikrobiologische und enzymatische Prozesse auf Basis der Fermentierung von Stärke oder Zucker entwickelt. Die hohen Produktionskosten beschränken ihre Verwendung jedoch auf spezielle Anwendungen.
3.1. Herstellung von Propionsäure durch Carbonylierung von Ethylen (BASF-Verfahren)
Das BASF-Verfahren zur Herstellung von Propionsäure verwendet die Reppe-Synthese. Bei dieser Reaktion wird Ethylen mit Kohlenmonoxid und Wasser unter hohem Druck umgesetzt, wobei Ni(CO)4 als Katalysator verwendet wird.
C2H4 + CO + H2O → CH3CH2COOH
Dieses Verfahren bietet mehrere Vorteile, wie niedrige Rohstoffkosten, hohe Umwandlung und Ausbeute an Propionsäure sowie ein einfaches Aufarbeitungsverfahren.
Eine einfache industrielle Prozessbeschreibung ist in Abbildung 1 dargestellt.
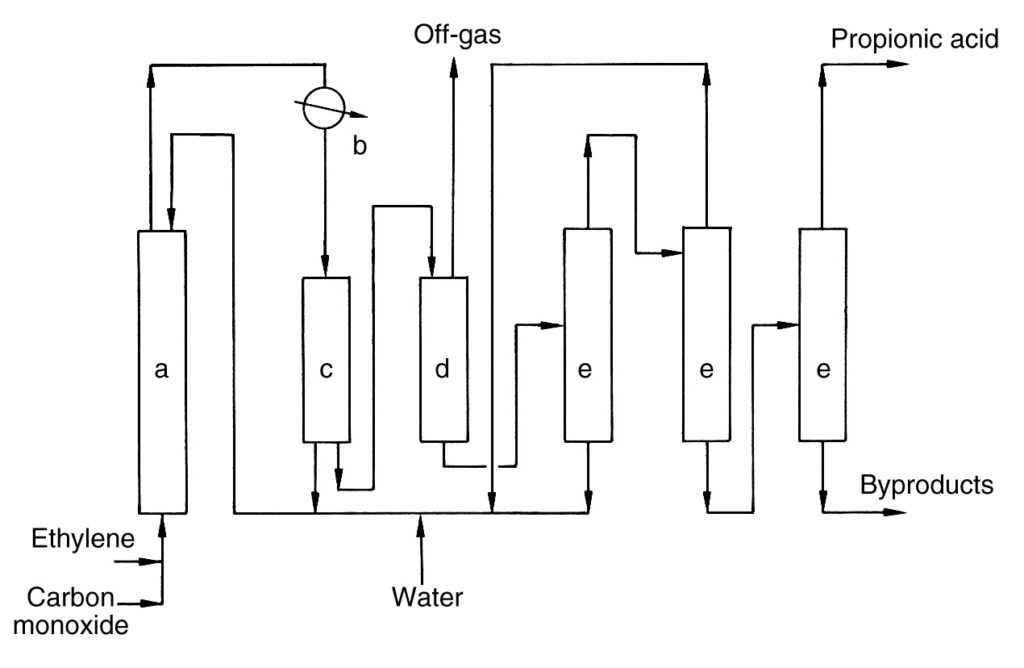
a) Hochdruckreaktor; b) Wärmetauscher; c) Abscheider; d) Ausdehnungsgefäß; e) Destillationskolonne
Ethylen und Kohlenmonoxid werden komprimiert und zusammen mit einem Rücklaufstrom kontinuierlich in den Hochdruckreaktor (a) eingespeist. Die Reaktion läuft bei 100–300 bar und 250–320 °C ab. Es entsteht rohe Propionsäure, die aus dem Reaktorkopf abgezogen wird.
Das Rohprodukt wird in einem Wärmetauscher (b) gekühlt, wodurch Dampf entsteht. Ein Teil des gekühlten Produkts wird zur Temperaturregelung in den Reaktor (c) zurückgeführt, während der Hauptstrom entspannt wird (d).
Der entspannte Strom wird in einen Abgasstrom und einen Rohsäurestrom getrennt. Aus dem Abgas wird Nickelkatalysator gewonnen und in den Reaktor zurückgeführt. Das Abgas wird mit Wärmerückgewinnung verbrannt.
Die Rohsäure wird dehydriert und über mehrere Destillationskolonnen weiter gereinigt (e). Während des Prozesses gebildete Nickelsalze werden recycelt. Die abschließende Destillation ergibt reine Propionsäure, und der Produktrückstand wird aus dem Prozess entfernt.
Borsäure soll die Reaktionsgeschwindigkeit erhöhen und die Ausfällung von Katalysatorsalzen verhindern.
3.2. Herstellung von Propionsäure durch Oxidation von Propanal
Propionsäure wird kommerziell durch Propanaloxidation hergestellt. Dieser Prozess umfasst zwei Schritte: Propanalherstellung und katalysierte Carbonylierung.
Propanal entsteht als Zwischenprodukt bei der n-Propanolherstellung durch Ethylenhydroformylierung. Im Gegensatz zu höheren Aldehyden entstehen keine n/Iso-Isomerengemische. Es wird industriell durch kobaltkatalysierte Hochdruck-Carbonylierung oder durch rhodium-/iridiumkatalysierte Niederdruck-Carbonylierung hergestellt.
Das leicht erhältliche Propanal wird dann unter milden Bedingungen (40–50 °C) selektiv zu Propionsäure oxidiert.
Dieses zweistufige Verfahren gewährleistet die Nutzung bestehender Anlagen sowohl für die Propanalherstellung als auch für die anschließende Oxidation. Unternehmen wie Dow (ehemals Union Carbide) und Eastman in den USA verwenden dieses Verfahren zur Herstellung von Propionsäure.
3.3. Herstellung von Propionsäure durch direkte Oxidation von Kohlenwasserstoffen
Historisch wurde ein erheblicher Anteil der Propionsäure durch die direkte Oxidation von Kohlenwasserstoffen, hauptsächlich Naphtha, hergestellt. Bei diesem Verfahren, das hauptsächlich zur Herstellung von Essigsäure verwendet wird, entstehen als Nebenprodukte auch Ameisensäure, Propionsäure, eine Mischung aus Buttersäureisomeren und Methylethylketon.
Obwohl diese Methode Vorteile hinsichtlich der Rohstoffkosten bot, brachte der Prozess erhebliche Herausforderungen mit sich:
- Komplexe Produktmischung: Der Oxidationsprozess ergab eine komplexe Mischung verschiedener organischer Säuren, die einen anspruchsvollen und teuren Trennungsprozess erforderte.
- Begrenzte Produktkontrolle: Die Reaktionsbedingungen boten nur minimale Kontrolle über die spezifischen Verhältnisse der gebildeten Produkte, was eine Anpassung an schwankende Marktanforderungen erschwerte.
- Hoher Energieverbrauch: Der mit dieser Technologie verbundene Trennungsprozess führt zu einem hohen Energieverbrauch.
Diese Nachteile führten letztendlich zur vollständigen Aufgabe dieser Technologie. Bis 2009 wurden alle in Betrieb befindlichen Anlagen, die dieses Verfahren verwenden, stillgelegt, zuletzt die Celanese-Anlage in Pampa, Texas.
Eine Beschreibung des BP Chemicals-Verfahrens (Abbildung 2), ein historisches Beispiel für die direkte Kohlenwasserstoffoxidation, wird zu Referenzzwecken bereitgestellt.
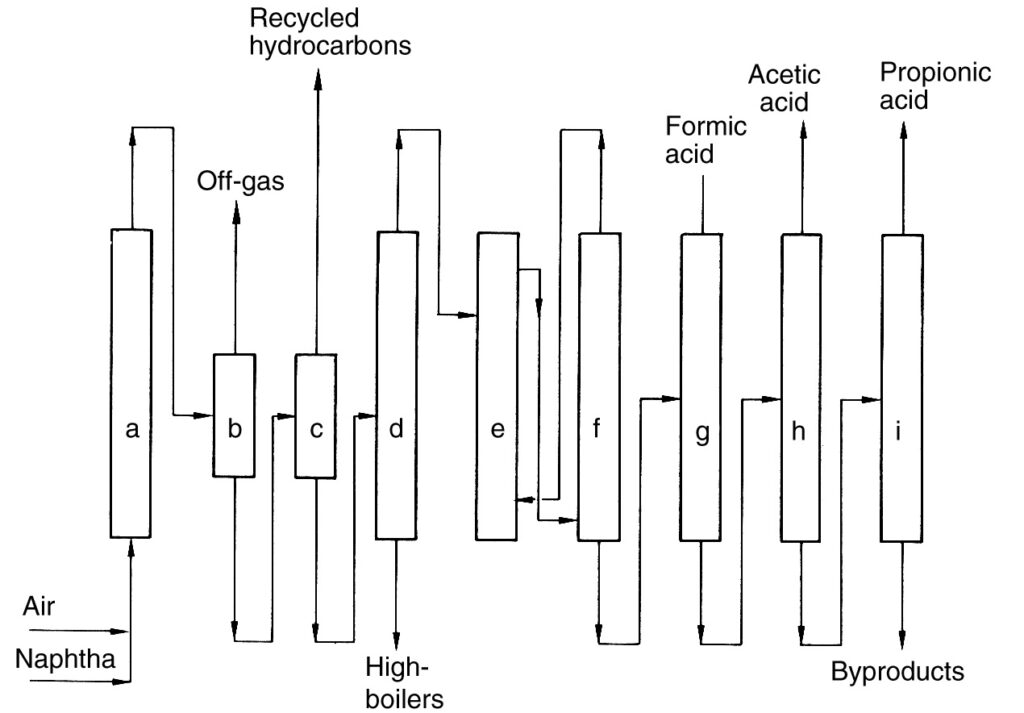
a) Reaktor; b) Gas-Flüssigkeits-Abscheider; c) Flüssig-Flüssigkeits-Abscheider; d) Destillationskolonne; e) Extraktion; f) Abtrennung des Extraktionsmittels; g) Destillation von Ameisensäure; h) Destillation von Essigsäure; i) Destillation von Propionsäure
Bei diesem Verfahren wurde Naphtha vorgewärmt und dann mit Luft bei erhöhtem Druck (40–45 bar) in einer Reihe von Reaktoren oxidiert (a). Die Reaktion erzeugte Wärme, die zur Dampferzeugung genutzt wurde.
Der gekühlte Reaktorausfluss wurde in einem Abscheider (b) vom Reaktionsabgas getrennt. Die zurückgewonnene Flüssigkeit wurde in die Reaktoren zurückgeführt, während das Abgas verbrannt wurde. Das verbleibende flüssige Produkt wurde dann in eine organische Phase (nicht umgesetzte Kohlenwasserstoffe) und eine wässrige Phase, die das Produktgemisch enthielt, getrennt (c). Nicht umgesetzte Kohlenwasserstoffe wurden zurückgeführt.
Die wässrige Phase wurde einer Trennung von niedrig- und hochsiedenden Komponenten unterzogen, gefolgt von einer Extraktionsentwässerung (e), um die Rohsäure zu erhalten. Schließlich wurden fraktionierte Destillationsschritte (g)–(i) verwendet, um C1- bis C4-Carbonsäuren zu isolieren.
3.4. Herstellung von Propionsäure durch Fermentation
Während petrochemische Prozesse die industrielle Propionsäureproduktion dominieren, bietet die Fermentation unter Verwendung von Propionibacterium-Arten eine biobasierte Alternative. Diese grampositiven, unbeweglichen, stäbchenförmigen Bakterien gelten allgemein als sicher (GRAS), wodurch die daraus entstehende Propionsäure für Anwendungen wie Lebensmittel, Futtermittel, Arzneimittel und Kosmetika geeignet ist.
Propionibakterien nutzen den Dicarbonsäureweg, um Glucose (oder andere Kohlenstoffquellen) in Propionsäure umzuwandeln. Dieser Weg beinhaltet Pyruvat als Schlüsselzwischenprodukt. Pyruvat kann entweder zu Oxalacetat carboxyliert werden, was zur Propionsäurebiosynthese führt, oder zu Acetyl-CoA decarboxyliert werden, was zur Essigsäurebiosynthese führt.
Die gemeinsame Produktion von Propion- und Essigsäure hält das Redoxgleichgewicht aufrecht.
Theoretisch können 1,5 Mol Glucose über den Embden-Meyerhof-Parnas-Weg (EMP) 2 Mol Propionat, 1 Mol Acetat und 1 Mol CO2 ergeben. Dies entspricht einer maximalen Propionsäureausbeute von 0,548 g/g Glucose und einem Verhältnis von Propionsäure zu Essigsäure von 2.
Der Pentosephosphatweg (HMP) kann zu höheren Propionsäureausbeuten (bis zu 0,68 g/g) bei geringerer Essigsäureproduktion führen. Bernsteinsäure ist ein häufiges Nebenprodukt in diesem Prozess.
Die tatsächliche Propionsäureausbeute hängt stark vom gewählten Substrat und den Fermentationsbedingungen ab.
Die Propionsäurefermentation erfolgt typischerweise unter anaeroben Bedingungen (mit Stickstoffgas gespült) bei 30–32 °C und einem pH-Wert von 6,0–7,0. Das Fermentationsmedium erfordert eine Pufferung (z. B. CaCO3) oder die Zugabe einer Base (z. B. Ammoniumhydroxid), um die produzierten Säuren zu neutralisieren, da das Wachstum der Propionibakterien unter einem pH-Wert von 4,5 aufhört.
Das Medium enthält typischerweise eine Kohlenstoffquelle (z. B. Glucose), eine Stickstoffquelle (z. B. Ammoniak), Mineralien und Vitamine. Propionibakterien können verschiedene Kohlenstoffquellen nutzen, darunter Zucker, Laktat, Glycerin und Sorbitol.
Industrielle Prozesse verwenden häufig kostengünstige Ausgangsstoffe wie Molkepermeat, Melasse oder Biodiesel-Abfallglycerin, ergänzt mit Stickstoffquellen wie Hefeextrakt.
Propionsäure selbst wirkt als Fermentationshemmer und reduziert Wachstum und Produktionsraten bei Konzentrationen über 10 g/l. Herkömmliche Fermentationsprozesse benötigen normalerweise 3 Tage, um etwa 20 g/l Propionsäure mit einer Ausbeute von 0,4 g/g Glucose oder weniger zu erreichen.
Umfangreiche Forschungen haben sich auf die Verbesserung von Ausbeute, Konzentration und Produktionsrate durch Stammentwicklung und Prozessoptimierung konzentriert.
4. Verwendung von Propionsäure
4.1. Verwendung von Propionsäure als Konservierungsmittel für Lebensmittel und Futtermittel
Propionsäure und ihre Salze (Propionate) werden aufgrund ihrer Fähigkeit, Bakterien, Pilze, Insekten, Viren und Milben zu hemmen, häufig als Konservierungsmittel verwendet.
Der genaue Wirkungsmechanismus wird noch untersucht, aber man geht davon aus, dass die undissoziierte Form der Propionsäure (dominant bei saurem pH-Wert) für die konservierende Wirkung verantwortlich ist. Diese Form dringt wie ein Nährstoff in die Zellen ein und stört wichtige Enzyme des Kohlenhydratstoffwechsels.
Propionate müssen hydrolysiert werden, um die aktive Säureform freizusetzen, wodurch sie langsamer und weniger wirksam sind als Propionsäure selbst.
Propionsäure zeigt ein breites Wirkungsspektrum gegen verschiedene Mikroorganismen mit einer minimalen Hemmkonzentration (MIC) von 0,05–0,50 Gew.-% gegen Pilze, 0,25–0,50 Gew.-% gegen Bakterien und 0,10–1,0 Gew.-% gegen Hefen.
Sie ist wirksam gegen Verderbnisschimmel in Lebensmitteln und Futtermitteln und noch wirksamer gegen gramnegative Bakterien (z. B. E. coli, Salmonellen). Sie inaktiviert auch Viren wie das Vacciniavirus bei Konzentrationen über 1,0 Gew.-% und tötet Milben und Maiskäfer in Getreide.
Propionsäure hat einen starken Geruch, was ihre Verwendung zur Lebensmittelkonservierung einschränkt. Propionate (Kalzium-, Natrium- und Ammoniumsalze) werden in Lebensmitteln bevorzugt, da sie nahezu neutral im Geschmack und Geruch sind.
Beide Formen werden zur Futterkonservierung verwendet, wobei Tiere oft den sauren Geschmack von mit Propionsäure konserviertem Futter bevorzugen.
Propionsäure und ihre Salze werden in den USA und Europa allgemein als sicher (GRAS) für verschiedene Lebensmittelanwendungen anerkannt. Die FAO/WHO hat keine spezifischen Beschränkungen für ihre tägliche Aufnahme.
4.2. Andere Verwendungen
Propionsäure wird in anderen Industriezweigen wie Gummi, Polymeren, Lösungsmitteln, Aromen, Duftstoffen, Pharmazeutika und Herbiziden verwendet.
Zink-, Cadmium-, Blei- und Quecksilberpropionate können als Vulkanisationsregulatoren verwendet werden und beeinflussen den Prozess der Gummiverfestigung während der Produktion.
Propionsäure wird als Zwischenprodukt, oft in ihrer Anhydridform, zur Herstellung wertvoller Ester wie Celluloseacetatpropionat und Vinylpropionat verwendet.
Methyl-, Ethyl-, Propyl- und Butylpropionate werden als Lösungsmittel für Harze und Farben verwendet, und verschiedene Propionatester besitzen charakteristische fruchtige Aromen, was sie zu wertvollen Zutaten in Geschmacks- und Duftformulierungen macht.
Kleine Mengen Propionsäure werden in Propionylchlorid umgewandelt, ein reaktives Molekül, das zur Einführung der „Propionylgruppe“ während der Synthese bestimmter Pharmazeutika verwendet wird.
Bis in die späten 1980er Jahre wurde ein erheblicher Anteil der Propionsäure zur Herstellung chlorierter Herbizide verwendet. Die Entwicklung wirksamerer und vielseitigerer Herbizide hat jedoch zu einem Rückgang dieser Anwendung geführt.
5. Toxikologie der Propionsäure
Propionsäure weist eine geringe akute Toxizität auf und wird im Körper rasch verstoffwechselt. Sie hat jedoch reizende/ätzende Wirkungen auf Haut und Augen. Chronische Exposition bei hohen Konzentrationen kann bei einigen Tierarten lokale Veränderungen im Vormagenepithel verursachen.
Propionsäure oder ihre aktivierte Form, Propionyl-CoA, ist ein natürliches Zwischenprodukt im menschlichen Stoffwechsel. Sie wird leicht von der Leber absorbiert und verstoffwechselt.
Propionsäure weist eine geringe orale und Inhalationstoxizität auf. Natrium- und Calciumpropionate sind sogar noch weniger toxisch. Hautkontakt kann Reizungen oder Verätzungen verursachen.
Langfristige Exposition bei Ratten gegenüber hohen Konzentrationen (>0,4 %) kann Veränderungen der Vormagenschleimhaut verursachen. Bei Beagles, die keinen Vormagen haben, traten diese Effekte jedoch nicht auf.
Studien haben keine Hinweise darauf ergeben, dass Propionsäure oder Propionate genetische Mutationen verursachen. Studien an trächtigen Tieren haben keine durch Propionsäureexposition verursachten Entwicklungsstörungen ergeben.
Begrenzte Studien am Menschen legen nahe, dass Propionsäure in niedrigen Dosen oral gut vertragen wird. Natriumpropionatlösungen wurden sicher zur Augenbehandlung eingesetzt.
Referenz
- Propionic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_223.pub4