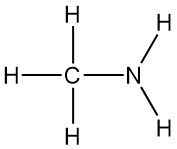
Wat is methylamine?
Methylamine is de eenvoudigste primaire amine, met de formule CH3NH2. Het is een kleurloos gas dat is afgeleid van ammoniak, waarbij één waterstofatoom is vervangen door een methylgroep. Het werd voor het eerst gesynthetiseerd in 1849 door Wurtz, samen met dimethylamine en trimethylamine.
De industriële synthese van methylamines uit methanol en ammoniak werd gerapporteerd in 1884 en het werd in de jaren 1920 gecommercialiseerd voor het looien van leer.
Inhoudsopgave
1. Fysieke eigenschappen van methylamine
Methylamine is een gas dat bij lage concentraties een karakteristieke visachtige geur heeft, maar bij hogere concentraties een ammoniakachtige geur. De waterige oplossingen vormen bij afkoeling kristallijne hydraten met de formule CH3NH2·3 H2O.
Methylamine is oplosbaar in verschillende organische oplosmiddelen, zoals methanol, ethanol, dimethylformamide en ethyleenglycol.
Tabel 1 presenteert de gedetailleerde fysieke eigenschappen van methylamine.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht (g/mol) | 31,06 |
| Kookpunt (101,33 kPa), °C | -6,3 |
| Smeltpunt, °C | -93,0 |
| Dichtheid (gas), g/cm3 bij 101,33 kPa | 0,0014 |
| Dichtheid (vloeistof), g/cm3 bij 25 °C | 0,6624 |
| pKa (bij 25 °C) | 10,62 |
| Oppervlaktespanning (25 °C), 10-3 N/m | 19,19 |
| Verdampingswarmte (25 °C), kJ/mol | 24,249 |
| Verdampingswarmte (kookpunt), kJ/mol | 26,0 |
| Smeltwarmte, kJ/mol | 6,054 |
| Standaardvormingswarmte (vloeistof, 25 °C), kJ/mol | -47,31 |
| Standaardvormingswarmte (gas, 25 °C), kJ/mol | -22,98 |
| Verbrandingswarmte (vloeistof, standaardtoestand, 25 °C), kJ/mol | -1061,35 |
| Warmtecapaciteit (ideaal gas, 25 °C), J K-1 mol-1 | 50,1 |
| Kritische temperatuur, °C | 156,9 |
| Kritische druk, MPa | 7,46 |
| Diëlektrische constante (vloeistof, 25 °C) | 9,4 |
| Dipoolmoment in benzeen (25 °C), D | 1,47 |
| Vlampunt (gesloten beker), °C | -62 |
| Ontstekingstemperatuur in lucht, °C | 430 |
| Onderste explosiegrens in lucht (vol %) | 4,9 |
| Bovenste explosiegrens in lucht (vol %) | 20,7 |
2. Chemische reacties van methylamine
Methylamine is een zwakke base die gemakkelijk zouten vormt met zuren (bijv. methylammoniumhaliden, ook bekend als methylaminehydrohaliden, met de overeenkomstige waterstofhalogeenzuren).
De reactie van methylamine met alkylhaliden leidt tot verdere alkylering, tot de vorming van quaternaire ammoniumzouten. Een voorbeeld is de reactie met ethylhalide om methylethylamine, methyldiethylamine en methyltriethylammoniumhalide te vormen.
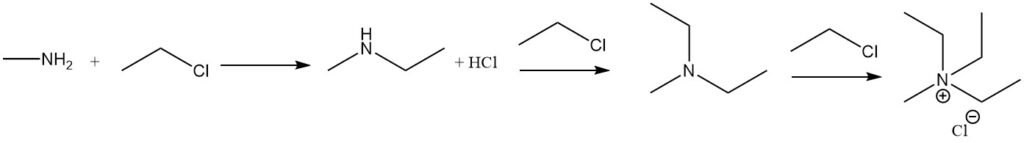
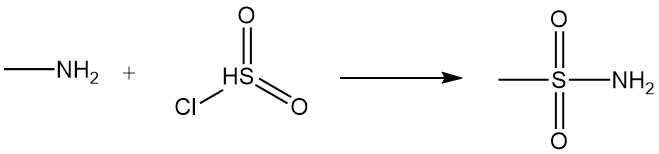
De reactie van methylamine met carbonzuren en hun derivaten resulteert in N-methylamiden, en de reactie met sulfonylchloride produceert gesubstitueerd methylsulfonamide.
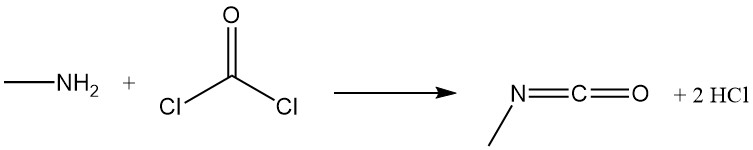
Methylamine reageert met fosgeen om methylisocyanaat te vormen, een tussenproduct bij de productie van carbamaatinsecticiden, en met koolstofdisulfide in de aanwezigheid van natriumhydroxide om natriummethyldithiocarbamaat te produceren.
Ureum reageert met methylamine via intermediair ammoniumcyanaat om N-methylureum te produceren.
Alkalische hypochlorieten leiden tot een mengsel van methylmono- en dichlooramines.
Methylamine wordt afgebroken tot methanol en stikstof door behandeling met salpeterigzuur en tot methylchloride en stikstof door de werking van nitrosylchloride.
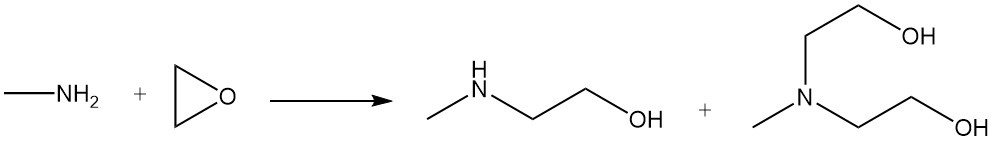
Methylethanolamine en methyldiethanolamine worden geproduceerd door de reactie van methylamine met ethyleenoxide.
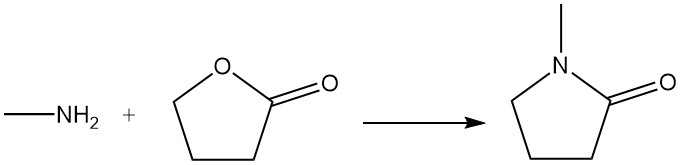
γ-Butyrolacton reageert met methylamine om N-methylpyrrolidon te produceren, dat als oplosmiddel wordt gebruikt.
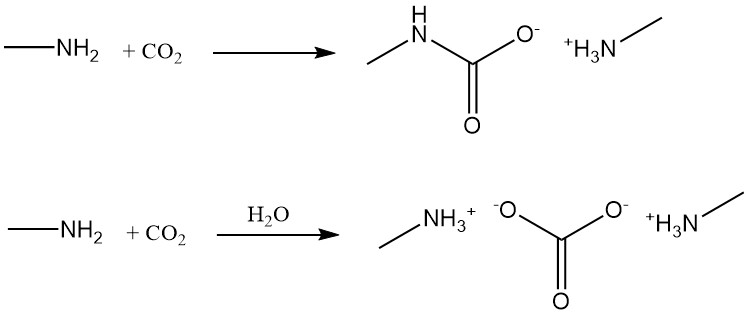
Methylamine reageert met koolstofdioxide tot methylaminecarbamaat onder watervrije omstandigheden en tot methylaminecarbonaat in aanwezigheid van water.
Methylamine is corrosief voor aluminium, koper, koperlegeringen, gegalvaniseerd metaal, magnesium, zink en hun legeringen. Staal vertoont echter goede prestaties als bouwmateriaal voor het verwerken van zowel watervrije methylamine als waterige oplossingen daarvan.
3. Productie van methylamine
Methylamine wordt geproduceerd via de exotherme reactie tussen methanol en ammoniak over een amorfe silica-alumina katalysator bij 350–450 °C. Deze reactie genereert een mengsel van de drie methylaminevarianten (mono-, di- en trimethylamine).
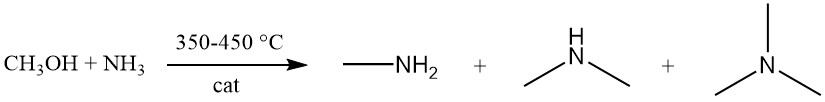
Terwijl het evenwicht de vorming van trimethylamine bevordert, geeft de marktvraag prioriteit aan mono- en vooral dimethylamine. Het aminesyntheseproces kan worden gemodelleerd door negen bimoleculaire evenwichtsreacties, waarvan er drie specifiek betrekking hebben op aminevorming:
- NH3 + CH3OH → CH3NH2 + H2O
- CH3NH2 + CH3OH → (CH3)2NH + H2O
- (CH3)2NH + CH3OH → (CH3)3N + H2O
Er worden momenteel twee primaire katalysatorsystemen gebruikt voor de dampfase methanol-ammoniakreactie: amorfe vaste zure katalysatoren en vormselectieve op zeoliet gebaseerde katalysatoren.
Het ruwe reactiemengsel dat methylamines, overtollige ammoniak, water en niet-omgezette methanol bevat, wordt gezuiverd met behulp van een reeks destillatiekolommen (meestal 4-5). Trimethylamine wordt uit het mengsel gescheiden met behulp van extractieve destillatie.
Dit zuiveringsproces bereikt hoge opbrengsten (>98%) van zuivere, watervrije mono-, di- en trimethylamine. De teruggewonnen methanol verbetert de procesefficiëntie en de levensduur van de katalysator.
4. Toepassingen van methylamine
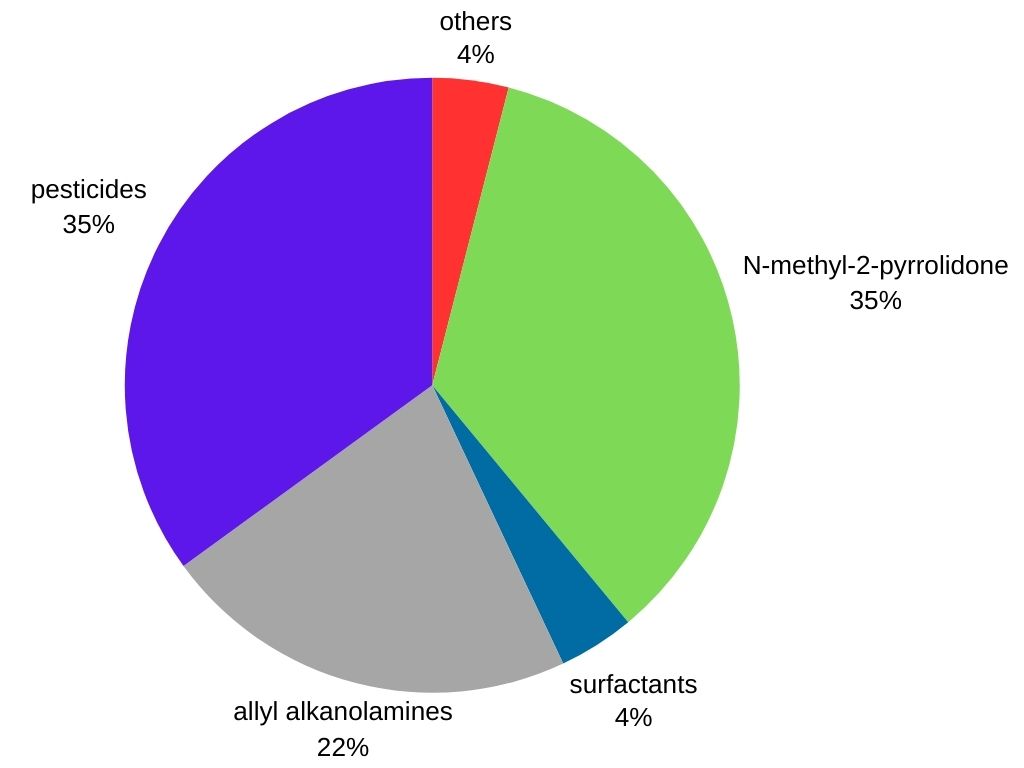
Methylamine wordt voornamelijk gebruikt als tussenproduct bij de productie van verschillende commerciële producten:
Landbouwchemicaliën: Methylamine is een belangrijk tussenproduct bij de productie van talloze herbiciden, pesticiden en insecticiden, en draagt bij aan gewasbescherming.
Farmaceutica: Het wordt gebruikt bij de synthese van bepaalde medicijnen, waaronder decongestiva en antihistaminica.
Rubberverwerkingschemicaliën: Methylamine vindt toepassing bij de productie van verschillende rubberproducten zoals banden en slangen.
Oppervlakteactieve stoffen: Het wordt gebruikt bij de productie van reinigings- en bevochtigingsmiddelen die aanwezig zijn in detergenten, shampoos en emulgatoren.
Andere toepassingen: Methylamine is ook een voorloper voor Tovex (watergel-explosief), het oplosmiddel N-methyl-2-pyrrolidon, methyldiethanolamine (een oplosmiddel dat wordt gebruikt bij de verwerking van koolwaterstoffen) en het bodemontsmettingsmiddel “Metam-natrium”.
5. Toxicologie van methylamine
Zowel methylamine als de oplossingen ervan zijn extreem ontvlambaar en vereisen een juiste behandeling om brand en explosie te voorkomen.
Methylamine en de waterige oplossingen ervan zijn corrosief en kunnen brandwonden en irritatie aan de ogen, huid en luchtwegen veroorzaken. Bij inademing tast het de bovenste luchtwegen aan bij lage concentraties (75 ppm) en hogere concentraties kunnen de lever beschadigen.
Blootstelling aan methylamine kan effecten veroorzaken die vergelijkbaar zijn met die van ammoniak, waaronder bronchitis, conjunctivitis, dermatitis en, in ernstige gevallen, irritatie, brandwonden, longschade en vertraagde orgaanlittekenvorming.
Herhaalde blootstelling aan methylamine bij dieren is in verband gebracht met levertoxiciteit, afwijkingen in de bloedchemie en longproblemen.
Studies naar genetische toxiciteit zijn niet doorslaggevend.
Bestaande studies suggereren dat de foetus niet bijzonder gevoelig is voor blootstelling, hoewel er meer onderzoek nodig is.
De American Conference of Governmental Industrial Hygienists (ACGIH) heeft een drempelwaarde (TLV) van 5 ppm (parts per million) vastgesteld als een tijdgewogen gemiddelde (TWA) en 15 ppm als een kortetermijnblootstellingslimiet (STEL) voor methylamine.
Referenties
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamine; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005182
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2




