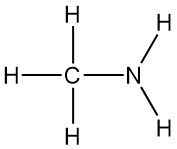
La méthylamine est l’amine primaire la plus simple, de formule CH3NH2. C’est un gaz incolore dérivé de l’ammoniac, avec un atome d’hydrogène remplacé par un groupe méthyle. Il a été synthétisé pour la première fois en 1849 par Wurtz aux côtés de la diméthylamine et de la triméthylamine.
La synthèse industrielle de méthylamines à partir de méthanol et d’ammoniac a été signalée en 1884 et commercialisée dans les années 1920 pour le tannage du cuir.
Table des matières
1. Propriétés physiques de la méthylamine
La méthylamine est un gaz qui a une odeur de poisson caractéristique à faibles concentrations mais, à des concentrations plus élevées, présente une odeur semblable à celle de l’ammoniac. Ses solutions aqueuses forment des hydrates cristallins lors du refroidissement avec la formule CH3NH2·3 H2O.
La méthylamine est soluble dans divers solvants organiques, tels que le méthanol, l’éthanol, le diméthylformamide et l’éthylène glycol.
Le Tableau 1 présente les propriétés physiques détaillées de la méthylamine.
| Propriété | Valeur |
|---|---|
| Poids moléculaire (g/mol) | 31.06 |
| Point d'ébullition (101,33 kPa), °C | -6.3 |
| Point de fusion, °C | -93.0 |
| Densité (gaz), g/cm3 à 101,33 kPa | 0,0014 |
| Densité (liquide), g/cm3 à 25 °C | 0,6624 |
| pKa (à 25 °C) | 10.62 |
| Tension superficielle (25 °C), 10-3 N/m | 19.19 |
| Chaleur de vaporisation (25 °C), kJ/mol | 24.249 |
| Chaleur de vaporisation (point d'ébullition), kJ/mol | 26.0 |
| Chaleur de fusion, kJ/mol | 6.054 |
| Chaleur de formation standard (liquide, 25 °C), kJ/mol | -47.31 |
| Chaleur de formation standard (gaz, 25 °C), kJ/mol | -22,98 |
| Chaleur de combustion (liquide, état standard, 25 °C), kJ/mol | -1061.35 |
| Capacité thermique (gaz parfait, 25 °C), J K-1 mol-1 | 50,1 |
| Température critique, °C | 156,9 |
| Pression critique, MPa | 7.46 |
| Constante diélectrique (liquide, 25 °C) | 9.4 |
| Moment dipolaire dans le benzène (25 °C), D | 1.47 |
| Point d'éclair (coupelle fermée), °C | -62 |
| Température d'inflammation dans l'air, °C | 430 |
| Limite inférieure d'explosivité dans l'air (% en volume | 4.9 |
| Limite supérieure d'explosivité dans l'air (% en volume | 20.7 |
2. Réactions chimiques de la méthylamine
La méthylamine est une base faible qui forme facilement des sels avec des acides (par exemple, les halogénures de méthylammonium, également appelés halogénures d’hydrogène de méthylamine, avec les acides halohydriques correspondants).
La réaction de la méthylamine avec les halogénures d’alkyle conduit à une alkylation ultérieure, jusqu’à la formation de sels d’ammonium quaternaire. Un exemple est la réaction avec l’halogénure d’éthyle pour former de la méthyléthylamine, de la méthyldiéthylamine et de l’halogénure de méthyltriéthylammonium.
La réaction de la méthylamine avec les acides carboxyliques et leurs dérivés donne des N-méthylamides, et la réaction avec le chlorure de sulfonyle produit du méthylsulfonamide substitué.
La méthylamine réagit avec le phosgène pour former de l’isocyanate de méthyle, un intermédiaire dans la production d’insecticides carbamates, et avec le disulfure de carbone en présence d’hydroxyde de sodium pour produire du méthyldithiocarbamate de sodium.
L’urée réagit avec la méthylamine via le cyanate d’ammonium intermédiaire pour donner de la N-méthylurée.
Hypochlorites alcalins Conduisent à un mélange de méthylmono- et dichloroamines.
La méthylamine est décomposée en méthanol et azote par traitement à l’acide nitreux et en chlorure de méthyle et azote par l’action du chlorure de nitrosyle.
La méthyléthanolamine et la méthyldiéthanolamine sont produites par la réaction de la méthylamine avec l’oxyde d’éthylène.
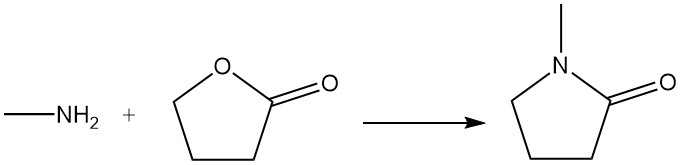
La γ-Butyrolactone réagit avec la méthylamine pour produire de la N-méthylpyrrolidone, qui est utilisée comme solvant.
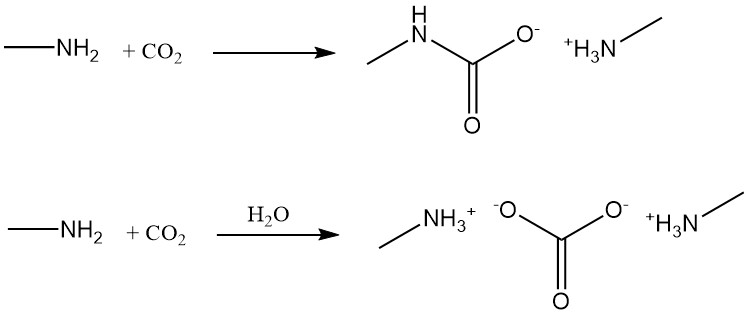
La méthylamine réagit avec le dioxyde de carbone pour former du carbamate de méthylamine dans des conditions anhydres et du carbonate de méthylamine en présence d’eau.
La méthylamine est corrosive pour l’aluminium, le cuivre, les alliages de cuivre, le métal galvanisé, le magnésium, le zinc et leurs alliages. Cependant, l’acier démontre de bonnes performances en tant que matériau de construction pour la manipulation à la fois de la méthylamine anhydre et de ses solutions aqueuses.
3. Production de méthylamine
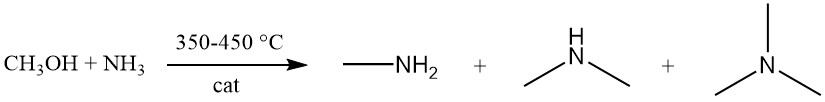
La méthylamine est produite par la réaction exothermique entre le méthanol et l’ammoniac sur un catalyseur silice-alumine amorphe à 350-450 °C. Cette réaction génère un mélange des trois variantes de méthylamine (mono-, di- et triméthylamine).
Alors que l’équilibre favorise la formation de triméthylamine, la demande du marché privilégie la mono- et surtout la diméthylamine. Le processus de synthèse des amines peut être modélisé par neuf réactions d’équilibre bimoléculaire, dont trois impliquent spécifiquement la formation d’amines :
- NH3 + CH3OH → CH3NH2 + H2O
- CH3NH2 + CH3OH → (CH3)2NH + H2O
- (CH3)2NH + CH3OH → (CH3)3N + H2O
Deux systèmes de catalyseurs principaux sont actuellement utilisés pour la réaction méthanol-ammoniac en phase vapeur : les catalyseurs acides solides amorphes et les catalyseurs à base de zéolite à sélectivité de forme.
Le mélange réactionnel brut contenant des méthylamines, de l’ammoniac en excès, de l’eau et du méthanol non converti est purifié à l’aide d’une série de colonnes de distillation (généralement 4 à 5). La triméthylamine est séparée du mélange par distillation extractive.
Ce processus de purification permet d’obtenir des rendements élevés (> 98 %) de mono-, di- et triméthylamine pures et anhydres. Le méthanol récupéré améliore l’efficacité du processus et la durée de vie du catalyseur.
4. Utilisations de la méthylamine
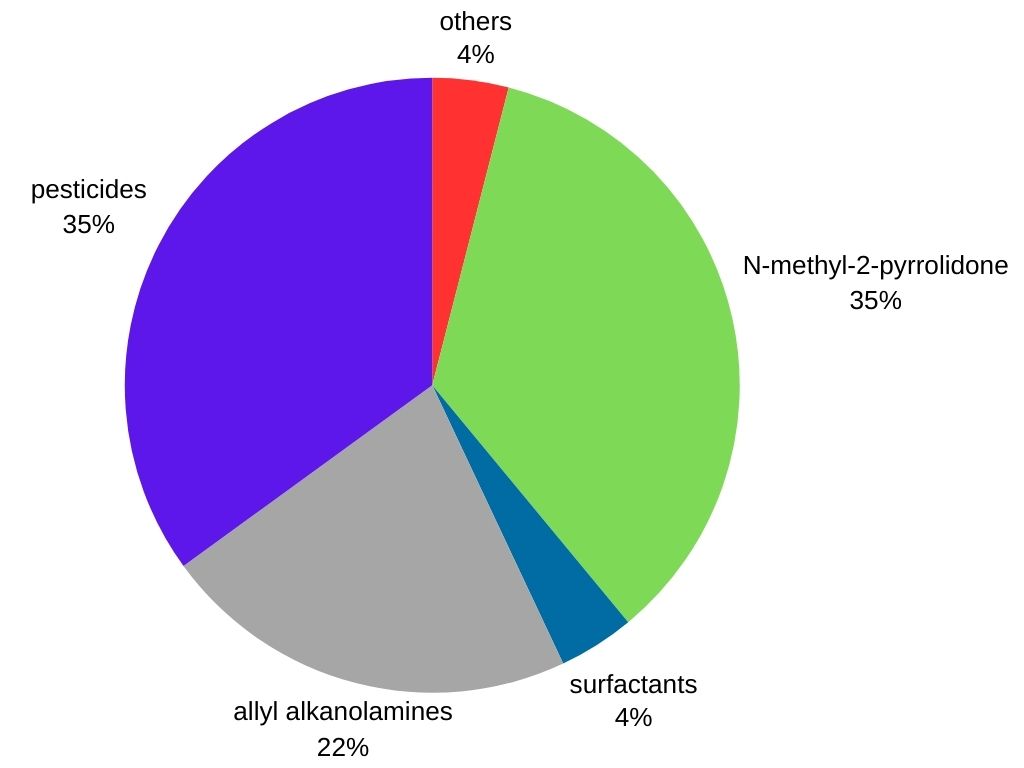
La méthylamine est principalement utilisée comme intermédiaire dans la fabrication de plusieurs produits commerciaux :
- Produits agrochimiques : la méthylamine est un intermédiaire important dans la production de nombreux herbicides, pesticides et insecticides, contribuant à la protection des cultures.
- Produits pharmaceutiques : Il est utilisé dans la synthèse de certains médicaments, notamment les décongestionnants et les antihistaminiques.
- Produits chimiques de traitement du caoutchouc : La méthylamine trouve des applications dans la fabrication de divers produits en caoutchouc comme les pneus et les tuyaux.
- Tensioactifs : Il est utilisé dans la production d’agents nettoyants et mouillants présents dans les détergents, les shampooings et les émulsifiants.
- Autres applications : La méthylamine est également un précurseur du Tovex (explosif gel aqueux), du solvant N-méthyl-2-pyrrolidone, de la méthyldiéthanolamine (un solvant utilisé dans le traitement des hydrocarbures) et du désinfectant du sol « Metam sodium ».
5. Toxicologie de la méthylamine
La méthylamine et ses solutions sont extrêmement inflammables et nécessitent une manipulation appropriée pour éviter les incendies et les explosions.
La méthylamine et ses solutions aqueuses sont corrosives et peuvent provoquer des brûlures et des irritations des yeux, de la peau et du système respiratoire. Lorsqu’il est inhalé, il affecte les voies respiratoires supérieures à de faibles concentrations (75 ppm) et des concentrations plus élevées peuvent endommager le foie.
L’exposition à la méthylamine peut provoquer des effets similaires à ceux de l’ammoniac, notamment une bronchite, une conjonctivite, une dermatite et, dans les cas graves, une irritation, des brûlures, des lésions pulmonaires et une cicatrisation retardée des organes.
L’exposition répétée à la méthylamine chez les animaux a été associée à une toxicité hépatique, à des anomalies de la chimie sanguine et à des problèmes pulmonaires.
Les études sur la toxicité génétique ne sont pas concluantes.
Les études existantes suggèrent que le fœtus n’est pas particulièrement sensible à l’exposition, même si des recherches supplémentaires sont nécessaires.
L’American Conference of Governmental Industrial Hygienists (ACGIH) a fixé une valeur limite de seuil (TLV) de 5 ppm (parties par million) comme moyenne pondérée dans le temps (TWA) et de 15 ppm comme limite d’exposition à court terme (STEL) pour méthylamine.
Références
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamine; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005182
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2