¿Qué es la etilamina?
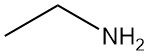
La etilamina, también conocida como etanamina, es una amina alifática primaria con la fórmula química C2H5NH2. Es un gas inflamable a temperatura ambiente con un olor similar al del amoníaco.
La etilamina se puede encontrar de forma natural en frutas y verduras, cereales, café, quesos y mariscos. También es un componente del humo del tabaco.
Tabla de contenido
1. Propiedades físicas de la etilamina
La etilamina es un líquido o gas incoloro e inflamable, según la temperatura ambiente. Es una base débil que tiene un olor parecido al del amoníaco y cuyo umbral de percepción del olor se encuentra en un rango de entre 0,027 ppm y 3,5 ppm. Es miscible con agua, etanol y éter.
La combustión de la etilamina produce óxidos de nitrógeno tóxicos. En el mercado, la etilamina se vende como una solución acuosa al 70 % o como un gas comprimido.
Las propiedades físicas de la etilamina se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [75-04-7] |
| Fórmula química | C2H5NH2 |
| Masa molecular | 45,09 g/mol |
| Punto de fusión | -80,6 °C |
| Punto de ebullición punto | 16,6 °C |
| Densidad a 20 °C | 0,6829 g/cm3 |
| pKb a 25 °C | 3,25 |
| Índice de refracción | 1,3663 |
| Densidad de vapor | 1,56 |
| Presión de vapor, a 20 °C | 121 kPa |
| Punto de inflamación | -52 °C |
| Temperatura de autoignición | 385 °C |
| Calor de combustión a 25 °C (líquido) | -1713,3 kJ/mol |
| Calor de vaporización | 6.845,1 g cal/g.mol |
| Tensión superficial a 25 °C | 19,20 mN/m |
2. Reacciones de la etilamina
La etilamina es una amina primaria débil que se disuelve en agua para formar una solución básica. Es una base más fuerte que el amoníaco y reacciona con ácidos orgánicos o inorgánicos para formar sales que son muy solubles en agua pero insolubles en solventes orgánicos.
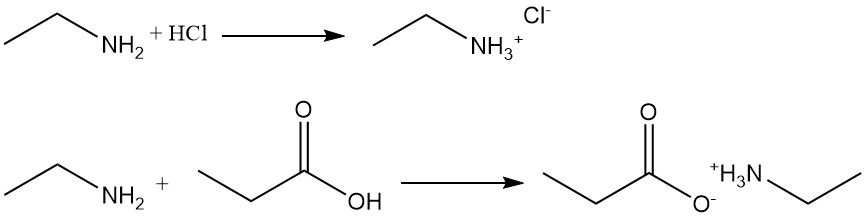
Por ejemplo, la reacción de la etilamina con ácido clorhídrico produce cloruro de etilamonio, y con ácido propanoico forma propionato de etilamonio.
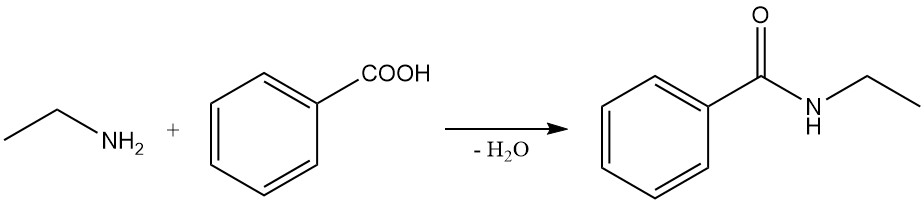
La etilamina reacciona con ácidos carboxílicos y sus ésteres, cloruros y anhídridos para dar las amidas correspondientes. La reacción con cloruros de ácidos carboxílicos es una reacción altamente exotérmica que da muy buenos rendimientos. La reacción con ácidos carboxílicos a menudo forma sal de amonio, que necesita calentamiento para producir las amidas.
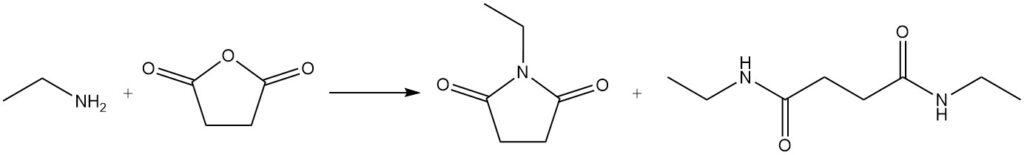
Algunos ejemplos de estas reacciones incluyen la reacción del ácido benzoico y la etilamina para formar N-etilbenzamida y la reacción de la etilamina con anhídrido succínico para producir 1-etilpirrolidina-2,5-diona y N1,N4-dietilsuccinamida.
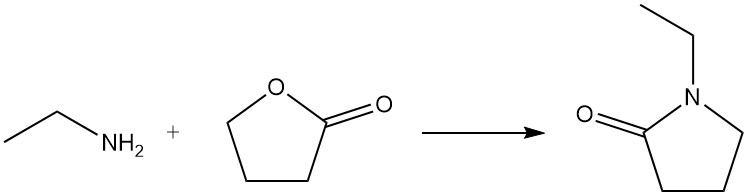
Cuando la etilamina reacciona con una lactona, se forma una lactama; por ejemplo, la 1-etil-2-pirrolidona se prepara a partir de etilamina y γ-butirolactona.
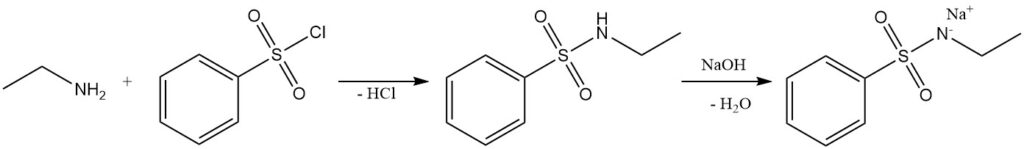
La reacción de etilamina con cloruro de bencenosulfonilo (prueba de Hinsberg) forma la N-etilbencenosulfonamida soluble en álcali.
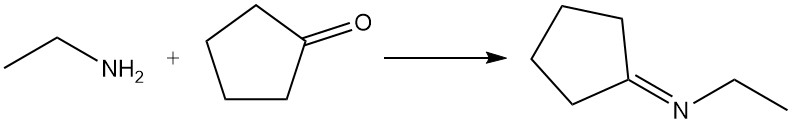
Dependiendo de las condiciones de reacción, los aldehídos y las cetonas reaccionan con la etilamina para formar iminas (bases de Schiff) o enaminas; estos productos pueden hidrogenarse para dar aminas más alquiladas. Los aldehídos generalmente reaccionan más rápido que las cetonas. Un ejemplo común es la reacción de la etilamina y la ciclopentanona para producir N-etilciclopentanimina.
La etilciclohexilamina, una amina importante que se utiliza en muchas industrias, se produce mediante la reacción de la etilamina con ciclohexanona seguida de hidrogenación.
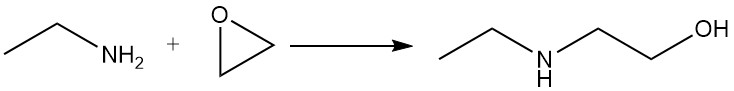
La etilamina reacciona con epóxidos para dar una mezcla de derivados mono y dioxietilados.
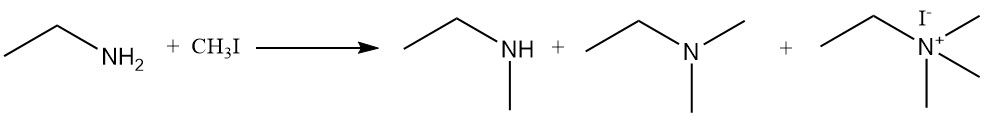
La reacción de la etilamina con haluros de alquilo y sulfatos de dialquilo produce una mezcla de aminas secundarias y terciarias y compuestos de amonio cuaternario. Un ejemplo es la reacción de la etilamina y el yoduro de metilo para formar una mezcla de N-metiletanamina, N,N-dimetiletanamina y yoduro de N,N,N-trimetiletilamonio.
La reacción del fosgeno con la etilamina conduce primero a la formación de cloruro de etilcarbamato; la eliminación posterior del cloruro de hidrógeno produce isocianatoetano. El exceso de etilamina reacciona luego con el isocianatoetano para producir 1,3-dietilurea.
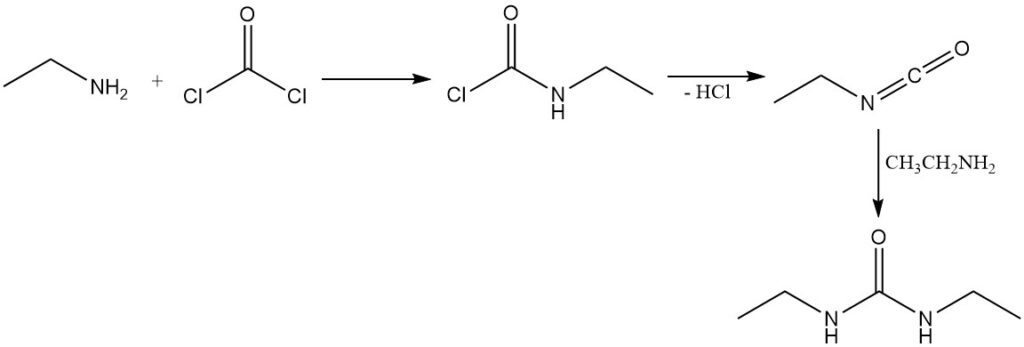
La etilamina reacciona con cloroformo en condiciones básicas (hidróxido de potasio o hidróxido de sodio) para formar etilisonitrilo.

La adición de etilamina al acrilonitrilo forma 3-(etilamino)propanonitrilo, que puede hidrogenarse fácilmente al correspondiente N-etil-1,3-propanodiamina.

La oxidación de la etilamina con peróxido de hidrógeno utilizando zeolitas dopadas con tungsteno como catalizadores produce acetaldehído oxima.
La deshidrogenación de la etilamina produce acetonitrilo.
3. Producción de etilamina
3.1. Producción de etilamina a partir de amoníaco y etanol
La reacción catalítica del etanol con amoníaco es el método predominante para la síntesis de etilamina. Este proceso genera simultáneamente dietilamina y trietilamina como subproductos debido a la reactividad de la etilamina con el etanol.
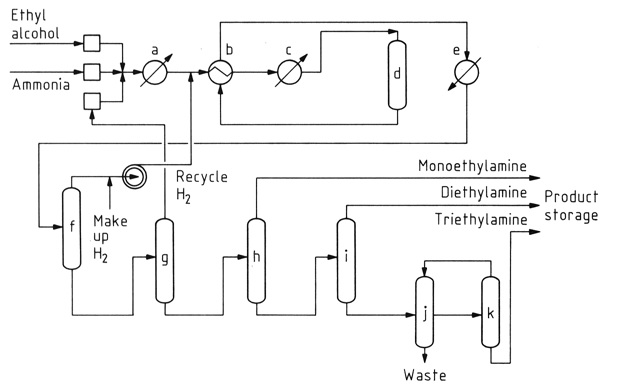
a) Vaporizador; b) Intercambiador de calor; c) Sobrecalentador; d) Convertidor catalítico; e) Enfriador de producto; f) Separador de gases; g) Columna de amoniaco; h) Columna de monoetilamina; i) Columna de dietilamina; j) Decantador; k) Columna de trietilamina
Si bien la conversión inicial de etanol en etilamina es casi neutral en términos de energía, la formación de aminas secundarias y terciarias es exotérmica, lo que favorece su producción termodinámica. Las condiciones de reacción, incluida la temperatura, el exceso de amoníaco y el tiempo de residencia, influyen en la distribución del producto.
Históricamente, se utilizaban catalizadores de deshidratación (por ejemplo, alúmina, sílice), pero recientemente, los catalizadores basados en metales se han vuelto predominantes. Los catalizadores de níquel, cobalto, cobre y hierro se emplean comúnmente, mientras que el platino y el paladio son menos selectivos debido a la posible ruptura del enlace C-C o C-N durante la reacción.
Los promotores como la plata, el zinc, el indio, el manganeso, el molibdeno y los metales alcalinos mejoran el rendimiento del catalizador. Estos componentes activos suelen estar soportados sobre alúmina, sílice o circonia, y las zeolitas muestran una mayor selectividad para la amina primaria.
Esta reacción ocurre en un reactor de lecho fijo a 0,5–25 MPa y 100–250 °C, dependiendo del tipo de catalizador y la fase (líquido o gas).
El mecanismo implica la deshidrogenación del etanol a acetaldehído como el paso determinante de la velocidad. La posterior adición de amoníaco, la eliminación de agua y la formación de imina o enamina son seguidas por la hidrogenación a etilamina.
Las reacciones secundarias incluyen la desproporción de amina (especialmente a temperaturas más altas), la condensación aldólica de aldehídos intermedios, la formación de base de Schiff y la formación de nitrilo en condiciones específicas.
Un exceso de amoníaco de dos a ocho veces desplaza el equilibrio hacia la formación de etilamina.
3.2. Producción de etilamina a partir de acetaldehído
El acetaldehído, fácilmente accesible a partir de la síntesis oxo, es un precursor preferido de la etilamina en comparación con el etanol debido a las ventajas económicas. Este proceso implica una reacción de dos pasos: la formación inicial de una imina (base de Schiff) a partir de acetaldehído y amoníaco, seguida de la hidrogenación a etilamina.

Este proceso emplea un catalizador de lecho fijo y una mezcla de reacción que contiene acetaldehído, amoníaco e hidrógeno. Alternativamente, puede resultar beneficioso un proceso de dos etapas, que separa la formación de imina y la posterior hidrogenación.
La operación en fase de vapor a 100–160 °C y presión atmosférica o ligeramente elevada es común. Se pueden utilizar condiciones de alta presión con sistemas eficaces de eliminación de calor, como altas tasas de reciclado o reactores multitubulares. Las temperaturas de reacción más bajas en comparación con la aminación de alcohol podrían lograr potencialmente una mayor selectividad.
Los catalizadores son generalmente similares a los utilizados en la aminación de alcohol. La etilamina cruda se purifica por destilación.
Si bien existen reactivos reductores alternativos, el hidrógeno sigue siendo la principal opción industrial debido a consideraciones de manipulación y costo.
3.3. Otros procesos
La etilamina se puede producir mediante la adición de amoníaco al etileno utilizando catalizadores de zeolita ácida como la H-mordenita. Aunque la conversión para la aminación directa del etileno es baja, al estar limitada por factores cinéticos y el equilibrio termodinámico, la selectividad para la monoetilamina es excelente.
La etilamina también se puede preparar selectivamente por electrorreducción de acetonitrilo a temperatura y presión ambiente utilizando nanopartículas de Cu como electrocatalizador. Sin embargo, este método no es importante a nivel industrial.
4. Usos de la etilamina
La etilamina se utiliza principalmente como precursor de herbicidas de triazina por reacción con cloruro cianúrico. La atrazina, el herbicida de triazina predominante, se emplea para el control de malezas de hoja ancha y gramíneas, principalmente en el cultivo de maíz y sorgo. La simazina, otra triazina derivada de la etilamina, se utiliza en la agricultura de cítricos y caña de azúcar.
Más allá de los herbicidas, la etilamina se utiliza en la síntesis de diversos productos químicos. Reacciona con cloruro de metalilo para formar etilmetalilamina, un intermediario clave en la producción del herbicida de dinitroanilina etalfluralina. Además, la etilamina actúa como precursor de la etilciclohexilamina, que posteriormente se convierte en el herbicida cicloato de tiocarbamato.
También se utiliza en la industria de las resinas, en la refinación del petróleo y en la producción de productos farmacéuticos, inhibidores de la corrosión, catalizadores de poliuretano y agentes textiles.
Además, la etilamina se emplea como agente de extracción de disolventes, intermediario de colorantes, estabilizador de látex de caucho y reactivo de laboratorio. Es un intermediario en la preparación de detergentes, tintes fotográficos, emulsionantes y decapantes. La etilamina ha sido identificada como un metabolito humano.
La demanda de atrazina está disminuyendo debido a preocupaciones medioambientales, que han dado lugar a prohibiciones en determinadas regiones.
5. Toxicología de la etilamina
La etilamina es un compuesto alcalino volátil que se absorbe fácilmente por vía dérmica y respiratoria. A pesar de su eficiente excreción urinaria tras un metabolismo parcial, la exposición puede inducir efectos adversos para la salud. Su acción tóxica primaria se atribuye a sus propiedades corrosivas.
Toxicidad aguda y de corto plazo
La etilamina es un irritante grave para la piel, los ojos y el tracto respiratorio. El contacto prolongado produce daño tisular corrosivo.
La LD50 oral aguda en ratas es de 400 mg/kg, mientras que la LD50 dérmica en conejos es de 270 mg/kg. La LC50 por inhalación en ratas es de 5540 ppm (exposición de 1 hora). La aplicación dérmica de una solución acuosa al 70 % a cobayas provocó quemaduras cutáneas graves y necrosis.
La instilación ocular de una solución al 1 % en conejos provocó una irritación grave. La inhalación a corto plazo de 50 ppm provocó irritación corneal en conejos.
Las exposiciones industriales han provocado irritación ocular y edema corneal en humanos. Existen informes de trastornos visuales transitorios (glaucopsia) similares a los causados por la exposición a la trietilamina, aunque el vínculo causal con la etilamina no está claro.
Toxicidad crónica
Los conejos expuestos a 50 ppm de etilamina muestran daño pulmonar y lesión corneal. Una concentración más alta de 100 ppm indujo daño renal. Las ratas tienen menos sensibilidad, con solo una irritación menor a 100 ppm. La irritación y daño nasal ocurrieron a 500 ppm después de 24 semanas de exposición.
No existen estudios a largo plazo que evalúen el potencial carcinogénico. Tampoco se encuentran disponibles estudios de desarrollo fetal.
No existen datos sobre la exposición crónica a la etilamina en humanos.
Genotoxicidad
Se observaron resultados positivos en ensayos de genotoxicidad en cultivos celulares in vitro. La etilamina no alteró la síntesis de ADN en roedores.
Ecotoxicidad
La etilamina exhibe una toxicidad aguda moderada a baja para los organismos acuáticos, con valores de CL50 que van de 40 a 1000 ppm para peces de colores y valores de CE50 de 100 a 200 ppm para Daphnia magna.
Otros peligros
La etilamina es altamente inflamable y puede formar mezclas de vapores explosivas. Es un irritante severo para los ojos, la nariz y las vías respiratorias.
Referencias
- Amines, Aliphatic. Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a02_001.pub2
- Ethylamine. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005042
- https://www.sciencedirect.com/science/article/abs/pii/B9780128243152001949
- https://patents.google.com/patent/US20070112218A1/en
- https://www.nature.com/articles/s41467-021-22291-0
- https://products.basf.com/global/en/ci/ethylamine-solution-70