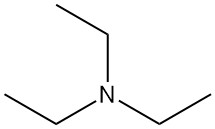
Triethylamine (TEA) is een tertiair amine, weergegeven door de chemische formule N(CH2CH3)3. Het is een kleurloze, gemakkelijk ontvlambare vloeistof met een ammoniakachtige geur. Het is een van de meest gebruikte organische aminebases in de synthetische organische chemie.
Inhoudsopgave
1. Fysieke eigenschappen van triethylamine
Triethylamine is een kleurloze, onaangenaam ruikende, ontvlambare vloeistof. Belangrijke fysieke eigenschappen staan in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | [121-44-8] |
| Chemische formule | (C2H5)3N |
| Kleur | Kleurloos |
| Fysische toestand | Vloeistof |
| Molecuulgewicht | 101,19 |
| Smeltpunt, °C | -115 |
| Kookpunt, °C | 89,3 |
| Dichtheid bij 20 °C | 0,7275 |
| Breukindex bij 20 °C | 1,4010 |
| Vlampunt, °C | -11 |
| pKb (25 °C) | 3,24 |
| Dissociatieconstante (pKa) | 10,76 |
| Geurdrempel, ppm; v/v | 0,48 |
| Oplosbaarheid in water | Mengbaar in water (112 g/l bij 20 °C) |
| Oplosbaarheid in organische oplosmiddelen | Mengbaar in ethanol en ethylether |
| Dampdrukdichtheid | 3,48 |
| Dampdruk bij 20 °C, torr | 54 |
| Zelfontvlambaarheid (°C) | 215 |
2. Chemische reacties van triethylamine
Triethylamine levert hoge brand- en veiligheidsrisico’s op bij blootstelling aan hitte, vlammen of oxidatiemiddelen, en het wordt explosief in dampvorm.
Onverdunde triethylamine gecomplexeerd met distikstoftetraoxide kan explosief ontbinden onder 0 °C.
Triethylamine reageert exotherm met maleïnezuuranhydride boven 150 °C, genereert hitte en kan mogelijk brandgevaar opleveren. Bij ontleding door hitte stoot het giftige stikstofoxidedampen (NOx) uit.
De belangrijkste reacties van triethylamine zijn:
1. Vorming van zouten met zuren
Vanwege zijn alkylsubstituenten is triethylamine een sterkere base dan ammoniak, en vormt het zeer goed in water oplosbare zouten met organische en anorganische zuren. Het verschil in oplosbaarheid tussen triethylamine en zijn zout maakt het een goede zuuracceptor en oplosmiddel voor gasreiniging en voor bepaalde extractieprocessen zoals de productie van semi-synthetische penicilline.
Het fungeert ook als een krachtige protonacceptor in verschillende reacties, waaronder oxidaties, reducties, eliminaties, substituties en addities. De resulterende quaternaire zouten worden na voltooiing gemakkelijk verwijderd.
2. Alkylering
De reactie van triethylamine met alkylhalogeniden en dialkylsulfaten om uiteindelijk quaternaire ammoniumverbindingen te geven, wordt gebruikt in preparatieve farmaceutische chemie en voor de bereiding van anticorrosiemiddelen en biociden.
3. Oxidatie
Triethylamine wordt door waterstofperoxide geoxideerd tot triethylamineoxide.

3. Productie van triethylamine
Triethylamine wordt geproduceerd door ammoniak te laten reageren met ethanol, N,N-diethylacetamide met lithiumaluminiumhydride, ethylchloride met ammoniak onder hitte en druk. en gasfase katalytische hydrogenering van acetonitril.
3.1. Productie van triethylamine door reactie van ammoniak en ethanol

De meest voorkomende methode omvat het laten reageren van ammoniak (NH3) met ethanol (CH3CH2OH) bij hoge temperaturen en druk boven een dehydratatie- of dehydrogenatiekatalysator. Katalysatoren zoals alumina, silica-alumina of zilver bevorderen de reactie effectief en leveren een mengsel van ethylamine, diethylamine en triethylamine op.
Vervolgens scheidingen door extracties en distillaties isoleren triethylamine met een hoge zuiverheid. Deze methode biedt hoge opbrengsten, maar vereist een zorgvuldige behandeling van vluchtige tussenproducten en energie-intensieve reactieomstandigheden.
Een mengsel van mono-, di- en triethylamine kan ook worden gesynthetiseerd uit aceetaldehyde, ammoniak en waterstof in aanwezigheid van een hydrogenatiekatalysator.

a) Verdamper; b) Warmtewisselaar; c) Oververhitter; d) Katalysator; e) Productkoeler; f) Gasscheider; g) Ammoniakkolom; h) Monoethylaminekolom; i) Diethylaminekolom; j) Decanter; k) Triethylaminekolom
3.2. Productie van triethylamine door reactie van N,N-diethylacetamide en lithiumaluminiumhydride

Een gespecialiseerde route gebruikt N,N-diethylacetamide (CH3CH2CON(CH2CH3)2) als substraat. Reductie met lithiumaluminiumhydride (LiAlH4) genereert direct triethylamine. Deze methode vermijdt de complexe menging van amineproducten, maar vereist gespecialiseerde reagentia en specifieke veiligheidsprotocollen vanwege de pyrofore aard van LiAlH4.
3.3. Productie van triethylamine door reactie van ethylchloride en ammoniak

Bij hoge temperatuur en druk kan ethylchloride (CH3CH2Cl) reageren met ammoniak om triethylamine te vormen. Dit proces vereist echter doorgaans extra zuiveringsstappen om bijproducten (HCl) en resterende reactanten te verwijderen.
3.4. Productie van triethylamine door gasfase katalytische hydrogenering van acetonitril

Triethylamine kan continu worden geproduceerd door hydrogenering van acetonitril in de gasfase, met behulp van een edelmetaal uit groep VIII van het periodiek systeem (bijv. platina, palladium) als katalysator.
Lithium-aluminium-spineldrager wordt gebruikt om de katalysatorprestaties te verbeteren. Deze reactie wordt uitgevoerd bij een temperatuur van 80 °C tot 115 °C en een druk van 1 tot 60 bar (relatieve druk).
Er wordt maximaal 3% monoethylamine en/of diethylamine toegevoegd ten opzichte van acetonitril. Deze fungeren als promotoren, waardoor de reactiesnelheid of selectiviteit mogelijk wordt verbeterd.
4. Toepassingen van triethylamine
Triethylamine (TEA) wordt voornamelijk gebruikt als katalysator bij het uitharden van harssystemen in gietvormen, met name bij de productie van zandkernen voor cold-box- of isocure-processen. TEA wordt verdampt tot een gas en in het systeem geïntroduceerd.
Naast zijn rol in gieterijtoepassingen, wordt TEA uitgebreid gebruikt als uithardingskatalysator in fenol-formaldehyde spaanplaatlijmen, met een jaarlijks verbruik van ongeveer 5 miljoen pond in de VS.
Bovendien wordt het gebruikt bij de zuivering van penicilline- en cefalosporine-antibiotica en in het grensvlakpolymerisatieproces voor de productie van polycarbonaatharsen.
Triethylamine wordt ook gebruikt als een scavenger van HCl in reacties, zoals tijdens de productie van benzylftalaten, met een focus op terugwinning en recycling.
TEA dient als ingrediënt in afdichtingsverf (0,5% w/w), bij de productie van papier- en kartonlijmen en als stabilisator voor gechloreerde oplosmiddelen zoals perchloorethyleen en trichloorethyleen.
Het werkt als een katalysator bij de vorming van urethaanschuimen en epoxyharsen en neemt deel aan dehydrohalogeneringsreacties en zuurneutralisatie voor condensatiereacties. TEA vindt ook toepassing in reverse-phase high-performance liquid chromatography (HPLC) als een mobiele-fase modifier.
In specifieke industrieën wordt TEA gebruikt als neutralisatiemiddel voor anionisch gestabiliseerde watergedragen harsen, waaronder polyesters, alkyden, acrylharsen en polyurethanen die carboxyl- of andere zure groepen bevatten.
Andere toepassingen van triethylamine zijn onder meer het gebruik ervan als een versnelleractivator voor rubber, als een corrosie-inhibitor, als een drijfgas, als een emulgator voor kleurstoffen, als een ingrediënt in fotografische ontwikkelingsversnellers, voor het drogen van drukinkten, in tapijtreinigers, bij de productie van herbiciden en pesticiden en bij de bereiding van emulgatoren voor pesticiden.
5. Toxicologie van triethylamine
1. Acute toxiciteit
- Inademing: Menselijke vrijwilligers die werden blootgesteld aan triethylaminedampen ondervonden visuele stoornissen en veranderingen in hersenactiviteit. Beroepsmatige blootstelling is ook in verband gebracht met oculaire en ademhalingsproblemen. Dierstudies tonen ernstige toxiciteit en mortaliteit aan na inademing van hoge doses, met LD50-waarden variërend van 420 tot 10.000 mg/m³ bij ratten.
- Inname: Orale blootstelling bij dieren resulteerde in dosisafhankelijke toxiciteit, met LD50-waarden variërend van 450 tot 1000 mg/kg bij knaagdieren. Bij mensen wordt ingenomen triethylamine voornamelijk onveranderd uitgescheiden, met een klein deel dat wordt gemetaboliseerd tot triethylamine-oxide en diethylamine.
- Dermaal: Triethylamine vertoont aanzienlijke huidirritatie bij dieren, met LD50-waarden rond de 0,5-0,794 ml/kg bij konijnen.
2. Chronische toxiciteit
- Inademing: Langdurige blootstelling (maanden) aan matige triethylamineconcentraties bij ratten veroorzaakte veranderingen in de longen, hersenen en lever. Veranderingen in het zenuwstelsel, bloedarmoede en chronische longontsteking werden waargenomen bij hogere blootstellingsniveaus.
- Oraal: Er werden geen bijwerkingen gemeld bij ratten die gedurende 2 maanden oraal triethylamine in een matige dosis kregen toegediend. Hogere doses leidden echter tot gedragsveranderingen en convulsies, waarbij vrouwtjes een grotere gevoeligheid vertoonden.
- Genotoxiciteit: In vitro- en in vivo-onderzoeken leverden tegenstrijdige resultaten op met betrekking tot de genotoxiciteit van triethylamine. Hoewel sommige testen mutageen potentieel in bacteriën suggereerden, lieten andere geen clastogene of aneugene effecten zien bij ratten.
3. Voortplanting en ontwikkeling
- Reproductieve studies: Een multigenerationele rattenstudie toonde geen significante impact op vruchtbaarheid of levensvatbaarheid van nakomelingen, hoewel een lichte vermindering van het gemiddelde lichaamsgewicht werd waargenomen in de derde generatie.
- Ontwikkelingstoxiciteit: Toediening van triethylamine aan drachtige konijnen verstoorde de vroege embryonale ontwikkeling.
4. Menselijke epidemiologie
- Kanker: Een onderzoek in een Deense gieterij koppelde beroepsmatige blootstelling aan triethylamine aan een verhoogd risico op blaaskankersterfte.
- Sensibilisatie: Dierstudies suggereren een laag potentieel voor huid- of luchtwegsensibilisatie voor triethylamine.
5. Andere observaties
- Triethylamine remt monoamineoxidase (MAO) en sulfotransferase-activiteit in dierlijke weefsels, wat mogelijk van invloed is op het metabolisme van neurotransmitters en steroïden.
- In vitro-onderzoeken suggereren dat triethylamine interageert met de afbraak en synthese van celproteïnen en lysosomale zwelling kan veroorzaken.
Referenties
- Aminen, alifatisch; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Proces voor de bereiding van triethylamine. – https://patents.google.com/patent/US4297512A/en
- Triethylamine; Review van toxicologische literatuur
- Triethylamine. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb12144e0013
- Triethylamine watervrij (BASF). – https://products.basf.com/global/en/ci/triethylamine-anhydrous.html




