Benzaldéhyde : production, réactions et utilisations

Le benzaldéhyde est l’aldéhyde aromatique le plus important, tant dans la nature que dans l’industrie. On le trouve dans de nombreuses plantes, liées ou non. L’amygdaline, un glycoside présent dans les amandes amères, est une source naturelle importante de benzaldéhyde.
Le parfum distinctif d’amande est dû à de petites quantités de benzaldéhyde libre, produit lors de l’hydrolyse de l’amygdaline. Le benzaldéhyde est également le principal composant des huiles essentielles extraites des noyaux de pêches, de cerises et d’abricots.
En 1818 et 1819, VOGEL et MATRÈS rapportèrent indépendamment l’extraction d’une huile volatile d’amandes amères, ainsi que de l’acide cyanhydrique. En 1832, WÖHLER et LIEBIG menèrent une étude approfondie de cette huile et déterminèrent sa composition chimique et sa relation avec l’acide benzoïque et le chlorure de benzoyle.
Table des matières
1. Propriétés physiques du benzaldéhyde
Le benzaldéhyde (C7H6O) est un liquide incolore hautement réfractif qui est volatil en présence de vapeur. Il est miscible avec de nombreux solvants organiques et peut être mélangé avec de l’acide sulfurique concentré, du dioxyde de carbone liquide, de l’ammoniac liquide, de la méthylamine et de la diéthylamine à 25 °C.
Voici un résumé des propriétés physiques du benzaldéhyde :
| Propriété | Valeur |
|---|---|
| Poids moléculaire | 106,13 g/mol |
| Couleur | Incolore |
| Odeur | Amandes amères |
| État physique | Liquide |
| Point d'ébullition | 179 °C à 101,3 kPa |
| Point de fusion | -56 °C |
| Indice de réfraction (n20D) | 1,5450 |
| Densité | 1,063 g/cm³ à 0 °C, 1,046 g/cm³ à 20 °C, 1,018 g/cm³ à 50 °C |
| Capacité thermique spécifique | 1,676 J g⁻¹ K⁻¹ à 25 °C |
| Chaleur d'évaporation | 371,0 J/g à 179 °C |
| Chaleur de combustion standard | 33,19 kJ/g |
| Point d'éclair | 64,5 °C |
| Température d'auto-inflammation | 190 °C |
| Limite inférieure d'explosivité | 1,4 % en volume |
| Viscosité dynamique (η) | 1,40 x 10⁻³ Pa · s à 25 °C
1,11 x 10⁻³ Pa · s à 40 °C |
| Tension(s) superficielle(s) | 40,04 x 10⁻³ N/m à 20 °C |
| Moment dipolaire (m) | 2,92 D (9,74 x 10⁻³⁰ C m) dans le benzène liquide |
| Constante diélectrique (εr) | 17,7 à 25 °C |
2. Réactions chimiques du benzaldéhyde
Le benzaldéhyde et ses dérivés ont un comportement chimique similaire aux aldéhydes aliphatiques, mais leur réactivité est réduite en raison de la résonance des électrons p du groupe carbonyle avec le cycle aromatique.
Cette propriété unique permet au benzaldéhyde de former divers composés, tels que des bases de Schiff avec des amines, des oximes avec de l’hydroxylamine, des hydrazones avec de la phénylhydrazine et des acétals avec des alcools. Il réagit également avec le cyanure d’hydrogène, le bisulfite de sodium et les composés de Grignard.
Une synthèse notable du benzaldéhyde est la réaction de Strecker, qui utilise de l’ammoniac et du cyanure d’hydrogène pour former un intermédiaire aminonitrile qui peut être saponifié pour produire de la DL-2-phénylglycine.
Le benzaldéhyde peut également s’auto-oxyder dans l’air pour former de l’acide benzoïque. Ce processus est affecté par la lumière et peut être accéléré par les peroxydes ou les sels de métaux lourds, mais ralenti par les antioxydants tels que les composés phénoliques et la diphénylamine. Le benzaldéhyde peut également être oxydé en acide benzoïque par des agents tels que l’acide nitrique et l’oxyde de chrome (VI).
La réduction ou l’hydrogénation du benzaldéhyde dans différentes conditions donne divers produits, notamment l’alcool benzylique, l’éther dibenzylique, le benzoïne, le 1,2-diphényléthane-1,2-diol, le stilbène, le toluène et le méthylcyclohexane. L’hydrogénation catalytique, utilisée industriellement, produit de l’alcool benzylique.
La réduction avec des alcoolates d’aluminium (réduction Meerwein-Ponndorf-Verley) est une autre méthode d’obtention de l’alcool benzylique, et ce procédé peut également réduire les aldéhydes insaturés, comme le cinnamaldéhyde, tout en conservant les doubles liaisons oléfiniques.
Le benzaldéhyde réagit avec l’ammoniac et l’hydrogène en présence de catalyseurs d’hydrogénation pour produire de la benzylamine, qui a d’importantes applications industrielles. La chloration des chaînes latérales du benzaldéhyde entraîne la formation de chlorure de benzoyle.
Comme les aldéhydes aliphatiques, le benzaldéhyde participe également aux réactions de condensation avec divers composés organiques contenant des atomes d’hydrogène actif. Certaines de ces réactions sont utilisées dans l’industrie. Par exemple, la condensation de Claisen-Schmidt avec de l’acétaldéhyde et un alcali aqueux produit du cinnamaldéhyde.

La condensation Perkin avec l’anhydride acétique en présence d’agents de condensation spécifiques conduit à la production industrielle d’acide cinnamique.

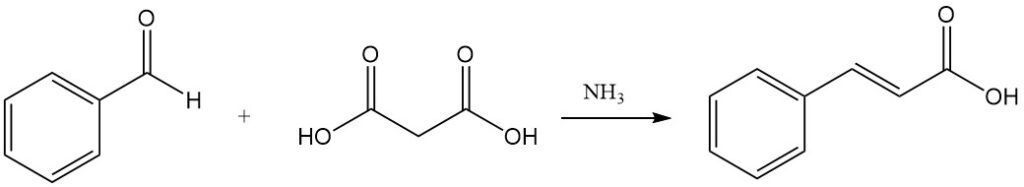
La condensation de Knoevenagel avec l’acide malonique, catalysée par des substances faiblement basiques comme l’ammoniac et les amines, est une autre voie d’accès à l’acide cinnamique.
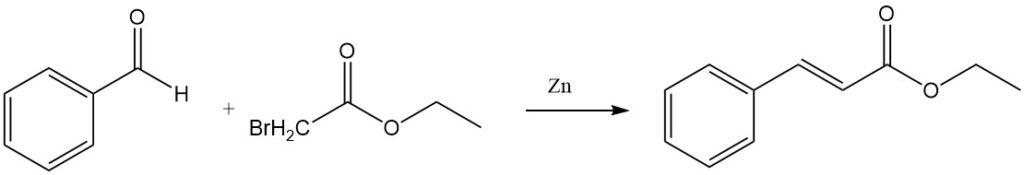
La réaction Reformatsky du benzaldéhyde et du bromoacétate d’éthyle en présence de zinc activé donne du cinnamate d’éthyle.
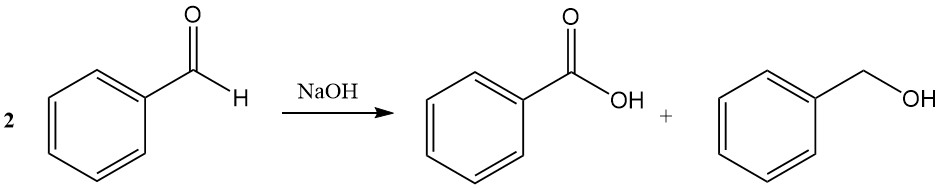
La réaction de Cannizzaro du benzaldéhyde conduit à la formation d’acide benzoïque et d’alcool benzylique en présence d’hydroxyde de sodium ou d’hydroxyde de potassium concentré.
La condensation Claisen-Tishchenko du benzaldéhyde est catalysée par le benzylate de sodium et d’aluminium pour former du benzoate de benzyle.
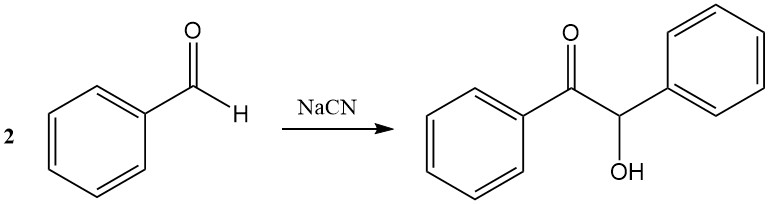
Lors de la condensation du benjoin, deux molécules de benzaldéhyde se combinent en présence de cyanure pour former le benjoin. Les sels de thiazolium peuvent remplacer le cyanure comme catalyseurs.
Le benzaldéhyde réagit différemment avec l’ammoniac que les aldéhydes aliphatiques, la réaction se poursuit jusqu’à la formation de 1-phényl-N,N’-bis(phénylméthylène)-méthanedi-amine (hydrobenzamide).

Le benzaldéhyde traité avec la solution de Fehling forme de l’alcool benzylique et de l’acide benzoïque, mais pas d’oxyde de cuivre (I). Les aldéhydes aromatiques ne polymérisent pas et ne forment pas de composés cycliques comme les aldéhydes aliphatiques.
Le benzaldéhyde se condense avec les phénols, les amines aromatiques et le benzène pour former des dérivés du triphénylméthane. Cette réaction est utilisée industriellement pour fabriquer des colorants Malachite Green.
La substitution électrophile du noyau aromatique dans le benzaldéhyde et d’autres aldéhydes aromatiques, tels que la chloration, la nitration et la sulfonation, se produit principalement en position méta.
3. Production de benzaldéhyde
Le benzaldéhyde est principalement produit par hydrolyse du chlorure de benzal ou par oxydation partielle du toluène. D’autres procédés de fabrication existent, mais ils n’ont actuellement pas d’importance industrielle.
3.1. Hydrolyse du chlorure de benzal
Le benzaldéhyde est produit par hydrolyse du chlorure de benzal, un composé facilement obtenu par chloration du toluène. Cette hydrolyse peut se faire dans des conditions alcalines ou acides.

Hydrolyse alcaline :
Le chlorure de benzal peut être saponifié avec divers agents alcalins, tels que l’hydroxyde de calcium, le carbonate de calcium, l’hydrogénocarbonate de sodium ou le carbonate de sodium. Le carbonate de sodium est l’agent préféré car il minimise les réactions secondaires.
Dans un procédé plus ancien, le chlorure de benzal est saponifié avec un léger excès de solution de carbonate de sodium à 15 % à 138 °C. Le réacteur est constitué de matériaux spécifiques, tels qu’un agitateur en acier au carbone recouvert d’Heresite (une résine phénolique) et un agitateur en alliage cuivre-silicium.
Ce procédé minimise la teneur en chlore du produit distillé à moins de 0,01 %. Un mélange de chlorure de benzal et de benzotrichlorure, couramment obtenu lors de la chloration de la chaîne latérale du toluène, peut également être hydrolysé. Dans ce processus, le benzotrichlorure est converti en benzoate de sodium puis en acide benzoïque.
Dans un procédé continu plus récent, le chlorure de benzal et l’agent saponifiant alcalin réagissent dans un réacteur à flux utilisant un solvant organique non réactif. Le benzaldéhyde extrait est ensuite séparé de la phase aqueuse alcaline par écoulement d’un solvant organique non réactif dans la direction opposée. Ce procédé continu intègre le réacteur, la zone d’extraction et la zone de lavage dans un seul appareil.
Alternativement, le chlorure de benzal peut être converti en benzaldéhyde en le faisant bouillir avec une solution aqueuse d’hexaméthylènetétramine. La réaction Sommelet peut également être utilisée pour produire du benzaldéhyde à partir de mélanges industriels de chlorure de benzyle et de chlorure de benzal.
Hydrolyse acide :
Le chlorure de benzal peut également être hydrolysé dans des conditions acides, en utilisant des acides et des sels métalliques comme catalyseurs. Cela donne des rendements élevés de benzaldéhyde (plus de 90 %) et de chlorure d’hydrogène, qui peuvent être récupérés sous forme d’acide chlorhydrique concentré.
Dans le passé, cette hydrolyse était souvent réalisée en présence d’acide sulfurique concentré, entraînant la formation de grandes quantités d’acide sulfurique dilué sous forme de déchet. Cette méthode convient à l’hydrolyse de certains benzaldéhydes substitués difficiles à saponifier par d’autres moyens.
Les sels métalliques, notamment les sels de fer ou de zinc, peuvent également catalyser l’hydrolyse du chlorure de benzal. Il est important d’éviter l’accumulation d’eau dans le mélange réactionnel, car cela peut réduire l’activité du catalyseur.
Le processus peut être réalisé en utilisant divers catalyseurs, tels que le phosphate de zinc, le laurate de zinc, les chlorures d’étain, le chlorure de cuivre (II), etc. La réaction peut être réalisée en discontinu ou en continu dans une cascade de réacteurs.
Hydrolyse en phase vapeur :
Un procédé continu innovant implique l’hydrolyse en phase vapeur du chlorure de benzal à des températures élevées, catalysée par du charbon actif traité avec de l’acide ou imprégné de chlorure ou de sulfate métallique. Ce procédé donne un rendement élevé en benzaldéhyde de 97 %.
Cette méthode est particulièrement adaptée à l’hydrolyse des chlorures de benzène substitués par un trifluorométhyle, qui seraient autrement difficiles à convertir en benzaldéhydes correspondants. Un processus similaire en phase vapeur consiste à hydrolyser le chlorure de benzal en benzaldéhyde à 300 °C à l’aide d’un catalyseur tel que le dioxyde de silicium ou l’oxyde d’aluminium.
3.2. Oxydation du toluène
Le benzaldéhyde peut être produit à partir du toluène par oxydation partielle, qui peut être réalisée soit en phase gazeuse, soit en phase liquide. Les conditions doivent être soigneusement contrôlées pour favoriser une oxydation partielle, car le benzaldéhyde peut être davantage oxydé en acide benzoïque et en d’autres produits.

Oxydation en phase gazeuse
Dans le procédé en phase gazeuse, la vapeur de toluène et l’oxygène traversent un lit de catalyseur à des températures élevées (250 à 650 °C). La réaction est très chaude, il est donc important de la refroidir efficacement.
Pour améliorer le rendement en benzaldéhyde, il est utile de diluer la vapeur de toluène et l’oxygène avec un gaz inerte, tel que la vapeur d’eau, l’azote ou le dioxyde de carbone.
Les meilleures conditions incluent de faibles taux de conversion (10 à 20 % par passage), des temps de séjour courts (0,1 à 1,0 secondes) et un contrôle précis de la quantité d’oxygène. Même dans ces conditions, le rendement ne représente généralement que 40 à 60 % du rendement théorique basé sur le toluène.
Cette oxydation en phase gazeuse du toluène produit également d’autres composés, tels que l’anhydride maléique, l’anhydride citraconique, l’anhydride phtalique, l’anthraquinone, le crésol, l’acide acétique et des quantités importantes d’acide benzoïque, de monoxyde de carbone et de dioxyde de carbone.
L’ajout de sulfate de potassium ou de fluorure de sodium au catalyseur ou l’utilisation d’une haute pression peut réduire la combustion complète.
Divers catalyseurs d’oxyde, contenant généralement du molybdène et d’autres éléments tels que le fer, le nickel, le cobalt, l’antimoine, le bismuth, le vanadium, le phosphore, le samarium, le tantale, l’étain et le chrome, sont souvent utilisés pour l’oxydation en phase gazeuse.
Certains catalyseurs combinent du palladium et de l’acide phosphorique sur du charbon actif, tandis que d’autres sont constitués d’oxydes mixtes d’argent et de métaux de transition. Un autre procédé utilise un catalyseur à oxydes mixtes contenant de l’uranium, du cuivre, du fer, du phosphore, du tellure et du plomb en plus du molybdène.
Oxydation en phase liquide
L’oxydation en phase liquide du toluène avec de l’oxygène est également une méthode courante. Cela se fait généralement en présence de catalyseurs tels que des composés de cobalt, de nickel, de manganèse, de fer ou de chrome. Des composés de plomb, des composés de ruthénium, des sels de thallium d’acides organiques et divers promoteurs ont également été utilisés, mais ils peuvent entraîner une corrosion.
La formation de benzaldéhyde en phase liquide peut également impliquer une oxydation avec d’autres agents tels que le méthanol, l’acétaldéhyde, l’acide benzoïque, l’acide acétique ou l’ajout d’eau.
La distillation est couramment utilisée pour purifier le benzaldéhyde brut obtenu à partir de ces procédés, avec des étapes de purification supplémentaires si nécessaire pour éliminer les impuretés qui décolorent le produit.
Sous-produit benzaldéhyde
Dans les procédés à grande échelle de production de caprolactame et de phénol, des quantités importantes de benzaldéhyde sont souvent produites comme sous-produits. En conséquence, les procédés d’oxydation dédiés à la production exclusive de benzaldéhyde sont moins couramment utilisés en milieu industriel.
Ces flux de benzaldéhyde sous-produits sont généralement traités pour obtenir du benzaldéhyde pur. Il est important de noter que même lors de la production de benzaldéhyde comme produit principal par oxydation catalytique en phase liquide, des quantités importantes d’acide benzoïque et d’autres sous-produits peuvent se former.
Le benzaldéhyde brut est généralement raffiné par distillation à pression réduite dans une colonne en acier inoxydable.
Autres procédés d’oxydation
Les processus qui impliquent l’oxydation du toluène avec des agents tels que le dioxyde de manganèse dans l’acide sulfurique, le persulfate de sodium, l’oxyde de chrome (VI) dans l’anhydride acétique ou le chlorure de chromyle n’ont généralement pas d’importance industrielle en raison des problèmes d’élimination des eaux usées.
3.3. Autres processus de production
Il existe d’autres façons de fabriquer du benzaldéhyde, mais elles ne sont pas aussi largement utilisées que les méthodes les plus courantes.
- Réaction du benzène et du monoxyde de carbone : Le benzaldéhyde peut être fabriqué en faisant réagir le benzène avec le monoxyde de carbone. Cependant, cette méthode n’est pas couramment utilisée dans l’industrie.
- Oxydation ou déshydrogénation de l’alcool benzylique : Le benzaldéhyde peut également être fabriqué en oxydant ou en déshydrogénant l’alcool benzylique. Cette méthode est possible, mais ce n’est pas le principal moyen de produire du benzaldéhyde à grande échelle.
- Oxydation du styrène catalysée par le ruthénium avec du périodate ou de l’hypochlorite : Le benzaldéhyde peut être fabriqué en utilisant du ruthénium pour catalyser l’oxydation du styrène avec du périodate ou de l’hypochlorite. Cette méthode n’est pas couramment utilisée dans l’industrie pour fabriquer du benzaldéhyde.
- Hydrolyse des mélanges de chlorure de benzyle et de chlorure de benzal : Le benzaldéhyde peut être fabriqué en hydrolysant des mélanges de chlorure de benzyle et de chlorure de benzal dans de l’acide nitrique dilué, en utilisant du pentoxyde de vanadium comme catalyseur. Cependant, ce n’est pas le principal moyen de production de benzaldéhyde dans l’industrie.
- Réduction du chlorure de benzoyle ou du benzoate de méthyle : Le benzaldéhyde peut également être fabriqué en réduisant le chlorure de benzoyle ou le benzoate de méthyle. Ces méthodes n’ont généralement pas d’importance industrielle pour la production de benzaldéhyde et sont plus susceptibles d’être utilisées dans la synthèse de dérivés nucléaires substitués spécifiques.
En résumé, ces autres méthodes de production de benzaldéhyde ne sont pas couramment utilisées dans l’industrie. Les méthodes décrites précédemment constituent les principales approches pour sa fabrication à grande échelle.
4. Utilisations du benzaldéhyde
Le benzaldéhyde est un produit chimique polyvalent et important avec un large éventail d’applications. Il est utilisé pour produire une variété d’odeurs et de saveurs, y compris celles trouvées dans l’huile d’amande amère naturelle, les parfums, les savons, les aliments et les boissons.
Le benzaldéhyde est utilisé pour produire des dérivés utilisés dans les industries des parfums et des arômes, tels que le cinnamaldéhyde, l’alcool cinnamylique, l’acide cinnamique et le benzoate de benzyle.
Le benzaldéhyde est également utilisé pour produire des colorants triphénylméthane, tels que la base leuco du vert malachite et le colorant acridine benzoflavine.
Dans l’industrie pharmaceutique, le benzaldéhyde est utilisé comme intermédiaire dans la fabrication du chloramphénicol, de l’éphédrine, de l’ampicilline, de la diphénylhydantoïne et d’autres produits.
D’autres intermédiaires chimiques importants obtenus à partir du benzaldéhyde comprennent le benjoin, la benzylamine, l’alcool benzylique, l’acide mandélique et la 4-phényl-3-butène-2-one (benzylidèneacétone).
Le benzaldéhyde est également utilisé en photochimie, comme inhibiteur de corrosion et auxiliaire de teinture, dans l’industrie de la galvanoplastie et dans la production de produits chimiques agricoles.
5. Toxicologie du benzaldéhyde
Le benzaldéhyde est utilisé dans les aliments, les cosmétiques, les produits pharmaceutiques et le savon comme agent aromatisant et parfumant. Il est généralement sans danger pour ces utilisations. Le benzaldéhyde a également des applications industrielles et agricoles.
Le benzaldéhyde a une toxicité aiguë modérée. La DL50 orale (dose qui tue 50 % d’une population testée) est de 1,3 g/kg chez le rat et de 1 g/kg chez le cobaye. La dose mortelle probable estimée pour un humain de 70 kg est de 50 ml. L’administration orale subchronique à des rongeurs n’a montré aucun effet indésirable à des doses quotidiennes de 400 mg/kg chez le rat et de 300 à 600 mg/kg chez la souris.
Cependant, des doses plus élevées ont causé des dommages au cerveau, aux reins et au pré-estomac. Les tests de mutagénicité étaient négatifs. Aucune étude n’a été rapportée sur les effets cancérigènes, tératogènes ou sur la reproduction du benzaldéhyde.
Les effets toxiques du benzaldéhyde comprennent la dépression, l’inactivité, les tremblements, les convulsions et le coma. La mort peut résulter d’une dépression respiratoire. Le benzaldéhyde a un faible effet anesthésique local et est légèrement irritant pour les yeux et les voies respiratoires supérieures. L’irritation cutanée est modérée et certaines personnes peuvent développer une réaction allergique.
Pour minimiser les risques, évitez tout contact avec le benzaldéhyde. Si un contact est nécessaire, porter des gants et des vêtements de protection. Dans les zones mal ventilées, utiliser un appareil respiratoire autonome pour éviter toute exposition par inhalation.
Référence
- Benzaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_463.pub2
