
Cos’è la benzaldeide?
La benzaldeide è l’aldeide aromatica più importante, sia in natura che nell’industria, con la formula C7H6O. È un liquido incolore con un odore caratteristico che ricorda la mandorla amara.
La benzaldeide si trova in molte piante, sia legata che non legata. Un’importante fonte naturale di benzaldeide è l’amigdalina, un glicoside presente nelle mandorle amare.
La caratteristica fragranza di mandorla è dovuta a piccole quantità di benzaldeide libera, che viene prodotta quando l’amigdalina viene idrolizzata. La benzaldeide è anche il componente principale degli oli essenziali estratti dai noccioli di pesche, ciliegie e albicocche.
Nel 1818 e nel 1819, VOGEL e MATRÈS riportarono indipendentemente l’estrazione di un olio volatile dalle mandorle amare, insieme all’acido cianidrico. Nel 1832, WÖHLER e LIEBIG condussero uno studio completo di questo olio e ne determinarono la composizione chimica e la relazione con acido benzoico e cloruro di benzoile.
Sommario
1. Proprietà fisiche della benzaldeide
La benzaldeide è un liquido incolore, altamente rifrangente, volatile in presenza di vapore. È miscibile con numerosi solventi organici e può essere miscelato con acido solforico concentrato, anidride carbonica liquida, ammoniaca liquida, metilammina e dietilammina a 25 °C.
Ecco un riepilogo delle proprietà fisiche della benzaldeide:
| Proprietà | Valore |
|---|---|
| Peso molecolare | 106,13 g/mol |
| Colore | Incolore |
| Odore | Mandorle amare |
| Stato fisico | Liquido |
| Punto di ebollizione | 179 °C a 101,3 kPa |
| Fusione point | -56 °C |
| Indice di rifrazione | 1,5450 |
| Densità | 1,063 g/cm3 a 0 °C, 1,046 g/cm3 a 20 °C, 1,018 g/cm3 a 50 °C |
| Capacità termica specifica | 1,676 J g⁻¹ K⁻¹ a 25 °C |
| Calore di evaporazione | 371,0 J/g a 179 °C |
| Calore di combustione standard | 33,19 kJ/g |
| Punto di infiammabilità | 64,5 °C |
| Temperatura di autoaccensione | 190 °C |
| Limite inferiore di esplosività | 1,4 vol% |
| Viscosità dinamica | 1,40 x 10-3 Pa · s a 25 °C
1,11 x 10-3 Pa · s a 40 °C |
| Tensione superficiale | 40,04 x 10-3 N/m a 20 °C |
| Momento di dipolo | 2,92 D (9,74 x 10-30 C m) in benzene liquido |
| Costante dielettrica | 17,7 a 25 °C |
2. Reazioni chimiche della benzaldeide
La benzaldeide e i suoi derivati hanno un comportamento chimico simile alle aldeidi alifatiche, ma la loro reattività è ridotta a causa della risonanza degli elettroni p del gruppo carbonilico con l’anello aromatico.
Questa proprietà unica consente alla benzaldeide di formare vari composti, come basi di Schiff con ammine, ossime con idrossilammina, idrazoni con fenilidrazina e acetali con alcoli. Reagisce anche con acido cianidrico, bisolfito di sodio e composti di Grignard.
Una sintesi degna di nota della benzaldeide è la reazione di Strecker, che utilizza ammoniaca e acido cianidrico per formare un intermedio amminonitrile che può essere saponificato per produrre DL-2-fenilglicina.
La benzaldeide può anche autoossidarsi nell’aria per formare acido benzoico. Questo processo è influenzato dalla luce e può essere accelerato da perossidi o sali di metalli pesanti, ma rallentato da antiossidanti come composti fenolici e difenilammina. La benzaldeide può anche essere ossidata ad acido benzoico da agenti come l’acido nitrico e l’ossido di cromo (VI).
La riduzione o l’idrogenazione della benzaldeide in diverse condizioni produce vari prodotti, tra cui alcol benzilico, etere dibenzilico, benzoino, 1,2-difeniletano-1,2-diolo, stilbene, toluene e metilcicloesano. L’idrogenazione catalitica, utilizzata a livello industriale, produce alcol benzilico.
La riduzione con alcolati di alluminio (riduzione di Meerwein-Ponndorf-Verley) è un altro metodo per ottenere alcol benzilico e questo processo può anche ridurre aldeidi insature, come la cinnamaldeide, mantenendo i doppi legami olefinici.
La benzaldeide reagisce con ammoniaca e idrogeno in presenza di catalizzatori di idrogenazione per produrre benzilammina, che ha importanti applicazioni industriali. La clorurazione a catena laterale della benzaldeide determina la formazione di cloruro di benzoile.
Come le aldeidi alifatiche, anche la benzaldeide partecipa alle reazioni di condensazione con vari composti organici contenenti atomi di idrogeno attivi. Alcune di queste reazioni sono utilizzate nell’industria. Ad esempio, la condensazione di Claisen-Schmidt con acetaldeide e soluzione alcalina acquosa produce cinnamaldeide.

La condensazione di Perkin con anidride acetica in presenza di specifici agenti condensanti porta alla produzione industriale di acido cinnamico.

Un altro modo per ottenere l’acido cinnamico è la condensazione di Knoevenagel con acido malonico, catalizzata da sostanze debolmente basiche come ammoniaca e ammine.
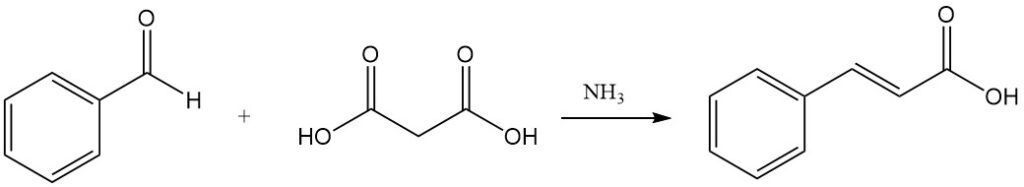
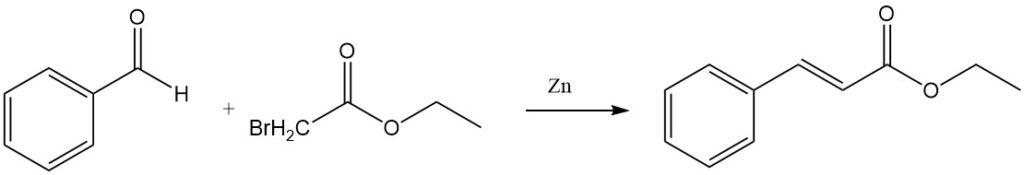
La reazione di Reformatsky della benzaldeide e dell’etilbromoacetato in presenza di zinco attivato produce etilcnnamato.
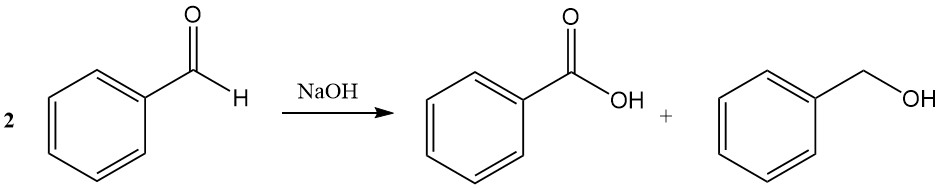
La reazione di Cannizzaro della benzaldeide porta alla formazione di acido benzoico e alcol benzilico in presenza di idrossido di sodio concentrato o idrossido di potassio.
La condensazione di Claisen-Tishchenko della benzaldeide è catalizzata da benzilato di sodio e alluminio per formare benzoato di benzile.
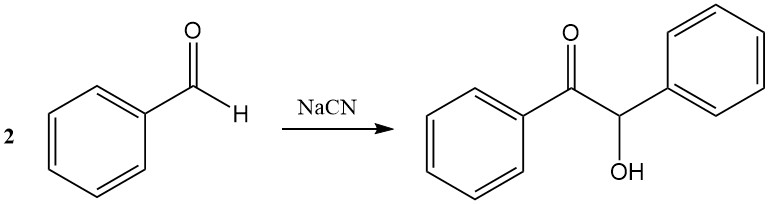
Nella condensazione del benzoino, due molecole di benzaldeide si combinano in presenza di cianuro per formare benzoino. I sali di tiazolio possono sostituire il cianuro come catalizzatori.
La benzaldeide reagisce con l’ammoniaca in modo diverso rispetto alle aldeidi alifatiche; la reazione continua fino alla formazione di 1-fenil-N,N’-bis(fenilmetilene)-metandiammina (idrobenzammide).

La benzaldeide trattata con la soluzione di Fehling forma alcol benzilico e acido benzoico, ma nessun ossido di rame (I). Le aldeidi aromatiche non polimerizzano né formano composti ciclici come le aldeidi alifatiche.
La benzaldeide si condensa con fenoli, ammine aromatiche e benzene per formare derivati del trifenilmetano. Questa reazione è utilizzata industrialmente per produrre coloranti verde malachite.
La sostituzione elettrofila del nucleo aromatico nella benzaldeide e in altre aldeidi aromatiche, come clorurazione, nitrazione e solfonazione, avviene principalmente in posizione meta.
3. Produzione di benzaldeide
La benzaldeide è prodotta principalmente idrolizzando il cloruro di benzale o ossidando parzialmente il toluene. Esistono altri processi di produzione, ma al momento non sono importanti a livello industriale.
3.1. Idrolisi del cloruro benzale
La benzaldeide è prodotta idrolizzando il cloruro benzale, un composto facilmente ottenibile clorando il toluene. Questa idrolisi può essere eseguita in condizioni alcaline o acide.

Idrolisi alcalina:
Il cloruro benzale può essere saponificato con vari agenti alcalini, come idrossido di calcio, carbonato di calcio, idrogenocarbonato di sodio o carbonato di sodio. Il carbonato di sodio è l’agente preferito perché riduce al minimo le reazioni collaterali.
In un processo più vecchio, il cloruro benzale viene saponificato con un leggero eccesso di soluzione di carbonato di sodio al 15% a 138 °C. Il reattore è realizzato con materiali specifici, come un recipiente agitatore in acciaio al carbonio rivestito con Heresite (una resina fenolica) e un agitatore in lega di rame e silicio.
Questo processo riduce al minimo il contenuto di cloro del prodotto distillato a meno dello 0,01%. Una miscela di cloruro di benzale e benzotricloruro, comunemente ottenuta nella clorurazione della catena laterale del toluene, può anche essere idrolizzata. In questo processo, il benzotricloruro viene convertito in benzoato di sodio e successivamente in acido benzoico.
In un processo continuo più recente, il cloruro di benzale e l’agente saponificante alcalino vengono fatti reagire in un reattore a flusso utilizzando un solvente organico non reattivo. La benzaldeide estratta viene quindi separata dalla fase alcalina acquosa facendo scorrere un solvente organico non reattivo nella direzione opposta. Questo processo continuo integra il reattore, la zona di estrazione e la zona di lavaggio in un unico apparato.
In alternativa, il cloruro di benzale può essere convertito in benzaldeide facendolo bollire con una soluzione acquosa di esametilentetrammina. La reazione di Sommelet può anche essere utilizzata per produrre benzaldeide da miscele industriali di cloruro di benzile e cloruro di benzale.
Idrolisi acida:
Il cloruro di benzale può anche essere idrolizzato in condizioni acide, utilizzando acidi e sali metallici come catalizzatori. Ciò produce rese elevate di benzaldeide (oltre il 90%) e cloruro di idrogeno, che può essere recuperato come acido cloridrico concentrato.
In passato, questa idrolisi veniva spesso eseguita in presenza di acido solforico concentrato, con conseguente formazione di grandi quantità di acido solforico diluito come rifiuto. Questo metodo è adatto per l’idrolisi di alcune benzaldeidi sostituite che sono difficili da saponificare con altri mezzi.
Anche i sali metallici, in particolare i sali di ferro o zinco, possono catalizzare l’idrolisi del cloruro di benzale. È importante impedire l’accumulo di acqua nella miscela di reazione, poiché può ridurre l’attività del catalizzatore.
Il processo può essere eseguito utilizzando vari catalizzatori, come fosfato di zinco, laurato di zinco, cloruri di stagno, cloruro di rame (II) e altro. La reazione può essere eseguita in batch o in continuo in una cascata di reattori.
Idrolisi in fase vapore:
Un innovativo processo continuo prevede l’idrolisi in fase vapore del cloruro di benzale a temperature elevate, catalizzata da carbone attivo trattato con acido o impregnato di cloruro o solfato di metallo. Questo processo produce un’elevata resa di benzaldeide del 97%.
Questo metodo è particolarmente adatto per idrolizzare i cloruri benzalici sostituiti con trifluorometile, che altrimenti sono difficili da convertire nelle corrispondenti benzaldeidi. Un processo simile in fase vapore comporta l’idrolisi del cloruro benzalico in benzaldeide a 300 °C utilizzando un catalizzatore come biossido di silicio o ossido di alluminio.
3.2. Ossidazione del toluene
La benzaldeide può essere prodotta dal toluene tramite ossidazione parziale, che può essere eseguita sia in fase gassosa che in fase liquida. Le condizioni devono essere attentamente controllate per favorire l’ossidazione parziale, poiché la benzaldeide può essere ulteriormente ossidata in acido benzoico e altri prodotti.

Ossidazione in fase gassosa
Nel processo in fase gassosa, il vapore di toluene e l’ossigeno vengono fatti passare attraverso un letto di catalizzatore ad alte temperature (250-650 °C). La reazione è molto calda, quindi è importante raffreddarla efficacemente.
Per migliorare la resa di benzaldeide, è utile diluire il vapore di toluene e l’ossigeno con un gas inerte, come vapore acqueo, azoto o anidride carbonica.
Le condizioni migliori includono bassi tassi di conversione (10-20% per passaggio), brevi tempi di residenza (0,1-1,0 secondi) e controllo preciso della quantità di ossigeno. Anche in queste condizioni, la resa è in genere solo il 40-60% della resa teorica basata sul toluene.
Questa ossidazione in fase gassosa del toluene produce anche altri composti, come anidride maleica, anidride citraconica, anidride ftalica, antrachinone, cresolo, acido acetico e quantità significative di acido benzoico, monossido di carbonio e anidride carbonica. L’aggiunta di solfato di potassio o fluoruro di sodio al catalizzatore o l’uso di alta pressione può ridurre la combustione completa.
Vari catalizzatori di ossido, in genere contenenti molibdeno e altri elementi come ferro, nichel, cobalto, antimonio, bismuto, vanadio, fosforo, samario, tantalio, stagno e cromo, sono spesso utilizzati per l’ossidazione in fase gassosa.
Alcuni catalizzatori combinano palladio e acido fosforico su carbone attivo, mentre altri sono costituiti da ossidi misti di argento e metalli di transizione. Un altro processo utilizza un catalizzatore di ossido misto con uranio, rame, ferro, fosforo, tellurio e piombo oltre al molibdeno.
Ossidazione in fase liquida
Anche l’ossidazione in fase liquida del toluene con ossigeno è un metodo comune. Di solito viene eseguita in presenza di catalizzatori come composti di cobalto, nichel, manganese, ferro o cromo. Sono stati utilizzati anche composti di piombo, composti di rutenio, sali di tallio di acidi organici e vari promotori, ma possono causare corrosione.
La formazione di benzaldeide nella fase liquida può anche comportare l’ossidazione con altri agenti come metanolo, acetaldeide, acido benzoico, acido acetico o l’aggiunta di acqua.
La distillazione è comunemente utilizzata per purificare la benzaldeide grezza ottenuta da questi processi, con ulteriori fasi di purificazione se necessario per rimuovere le impurità che scoloriscono il prodotto.
Benzaldeide come sottoprodotto
Nei processi su larga scala per la produzione di fenolo e caprolattame, spesso vengono prodotte quantità significative di benzaldeide come sottoprodotti. Di conseguenza, i processi di ossidazione dedicati per la produzione esclusiva di benzaldeide sono meno comunemente utilizzati in contesti industriali.
Questi flussi di benzaldeide come sottoprodotto vengono in genere elaborati per ottenere benzaldeide pura. È importante notare che anche quando si produce benzaldeide come prodotto primario mediante ossidazione catalitica in fase liquida, si possono formare quantità significative di acido benzoico e altri sottoprodotti.
La benzaldeide grezza viene solitamente raffinata mediante distillazione a pressione ridotta in una colonna di acciaio inossidabile.
Altri processi di ossidazione
I processi che comportano l’ossidazione del toluene con agenti quali biossido di manganese in acido solforico, persolfato di sodio, ossido di cromo (VI) in anidride acetica o cloruro di cromile non sono generalmente di importanza industriale a causa di problemi di smaltimento delle acque reflue.
3.3. Altri processi di produzione
Esistono altri modi per produrre benzaldeide, ma non sono ampiamente utilizzati come i metodi più comuni.
- Reazione di benzene e monossido di carbonio: la benzaldeide può essere prodotta facendo reagire il benzene con il monossido di carbonio. Tuttavia, questo metodo non è comunemente utilizzato nell’industria.
- Ossidazione o deidrogenazione dell’alcol benzilico: la benzaldeide può anche essere prodotta ossidando o deidrogenando l’alcol benzilico. Questo metodo è possibile, ma non è il modo principale per produrre benzaldeide su larga scala.
- Ossidazione catalizzata da rutenio dello stirene con periodato o ipoclorito: la benzaldeide può essere prodotta utilizzando il rutenio per catalizzare l’ossidazione dello stirene con periodato o ipoclorito. Questo metodo non è comunemente utilizzato nell’industria per produrre benzaldeide.
- Idrolisi di miscele di cloruro di benzile e cloruro di benzale: la benzaldeide può essere prodotta idrolizzando miscele di cloruro di benzile e cloruro di benzale in acido nitrico diluito, utilizzando il pentossido di vanadio come catalizzatore. Tuttavia, questo non è il modo principale per produrre benzaldeide nell’industria.
- Riduzione del cloruro di benzoile o del benzoato di metile: la benzaldeide può anche essere prodotta riducendo il cloruro di benzoile o il benzoato di metile. Questi metodi generalmente non hanno importanza industriale per la produzione di benzaldeide e hanno maggiori probabilità di essere utilizzati nella sintesi di specifici derivati sostituiti nel nucleo.
In sintesi, questi altri metodi per la produzione di benzaldeide non sono comunemente utilizzati nell’industria. I metodi descritti in precedenza sono gli approcci principali per la sua produzione su larga scala.
4. Utilizzi della benzaldeide
La benzaldeide è una sostanza chimica versatile e importante con un’ampia gamma di applicazioni. Viene utilizzato per produrre una varietà di odori e aromi, tra cui quelli presenti nell’olio di mandorle amare naturale, nei profumi, nei saponi, negli alimenti e nelle bevande.
La benzaldeide viene utilizzata per produrre derivati utilizzati nell’industria dei profumi e degli aromi, come cinnamaldeide, alcol cinnamilico, acido cinnamico e benzoato di benzile.
La benzaldeide viene anche utilizzata per produrre coloranti al trifenilmetano, come la base leuco del verde malachite e il colorante acridinico benzoflavina.
Nell’industria farmaceutica, la benzaldeide viene utilizzata come intermedio nella produzione di cloramfenicolo, efedrina, ampicillina, difenilidantoina e altri prodotti.
Altri importanti intermedi chimici ottenuti dalla benzaldeide includono benzoino, benzilammina, alcol benzilico, acido mandelico e 4-fenil-3-buten-2-one (benzilideneacetone).
La benzaldeide è anche utilizzata in fotochimica, come inibitore della corrosione e ausiliario di tintura, nell’industria galvanica e nella produzione di prodotti chimici agricoli.
5. Tossicologia della benzaldeide
La benzaldeide è utilizzata in alimenti, cosmetici, prodotti farmaceutici e saponi come agente aromatizzante e profumante. È generalmente sicura per questi usi. La benzaldeide ha anche applicazioni industriali e agricole.
La benzaldeide ha una moderata tossicità acuta. La LD50 orale (dose che uccide il 50% di una popolazione di prova) è di 1,3 g/kg nei ratti e 1 g/kg nelle cavie. La dose letale probabile stimata per un essere umano di 70 kg è di 50 mL. La somministrazione orale subcronica ai roditori non ha mostrato effetti avversi a dosi giornaliere di 400 mg/kg nei ratti e 300-600 mg/kg nei topi.
Tuttavia, dosi più elevate hanno causato danni al cervello, ai reni e allo stomaco. I test di mutagenicità sono stati negativi. Non sono stati segnalati studi sugli effetti cancerogeni, teratogeni o riproduttivi della benzaldeide.
Gli effetti tossici della benzaldeide includono depressione, inattività, tremori, convulsioni e coma. La morte può derivare dalla depressione respiratoria. La benzaldeide ha un debole effetto anestetico locale ed è leggermente irritante per gli occhi e le vie respiratorie superiori. L’irritazione cutanea è moderata e alcuni individui possono sviluppare una reazione allergica.
Per ridurre al minimo i rischi, evitare il contatto con la benzaldeide. Se il contatto è necessario, indossare guanti e indumenti protettivi. In aree scarsamente ventilate, utilizzare un autorespiratore per prevenire l’esposizione all’inalazione.
Riferimento
- Benzaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_463.pub2




