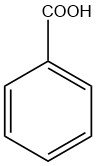
Cos’è l’acido benzoico?
L’acido benzoico è un composto organico solido cristallino bianco con formula chimica C6H5COOH. Il nome “acido benzoico” deriva dalla gomma benzoina, una sostanza resinosa ricavata dalla pianta di storace originaria dell’Asia meridionale.
L’acido benzoico si trova naturalmente in alcuni frutti e verdure, come mirtilli rossi, prugne, susine, mele, cannella e chiodi di garofano. Fu estratto per la prima volta da SCHEELE nel 1775 e la sua struttura chimica fu successivamente chiarita da LIEBIG e W€OHLER nel 1832.
I metodi iniziali per produrre acido benzoico furono sviluppati alla fine del 1800, utilizzando l’idrolisi del benzotricloruro o la decarbossilazione dell’anidride ftalica.
Attualmente, il metodo più comunemente utilizzato per produrre acido benzoico è l’ossidazione del toluene con aria, un processo che ha soppiantato le precedenti tecniche di ossidazione del dicromato e dell’acido nitrico.
Sommario
1. Produzione di acido benzoico
L’ossidazione in fase liquida del toluene con ossigeno molecolare è stata sviluppata durante la seconda guerra mondiale da I.G. Farbenindustrie in Germania. L’impianto utilizzava un reattore di ossidazione a colonna a bolle in acciaio rivestito in alluminio, dotato di un tubo di ingresso dell’aria, un separatore e un assorbitore per il recupero del toluene.
La reazione è stata catalizzata con naftenato di cobalto (0,1%) e il reattore era dotato di serpentine di scambio termico per rimuovere il calore generato durante la reazione. La reazione è stata condotta a 140 °C e circa 0,2 MPa per 30 ore, con conseguente conversione del toluene al 50%, di cui l’80% è stato trasformato in acido benzoico.
La presenza di composti di zolfo, composti di azoto, fenoli e olefine come impurità era critica, poiché inibivano la reazione di ossidazione. Anche altri sali di cobalto solubili in olio sono stati utilizzati come catalizzatori.
Dopo la reazione di ossidazione, il prodotto grezzo è stato neutralizzato con carbonato di sodio per ottenere benzoato di sodio e il toluene non reagito è stato recuperato tramite distillazione. Il processo di ossidazione è stato un processo a catena di radicali liberi e i perossidi sono stati intermedi di reazione.
Mentre il cobalto e il manganese si sono comportati in modo simile come catalizzatori, il rame ha influenzato negativamente la reazione. Anche le alte pressioni hanno ritardato la reazione, specialmente a concentrazioni di catalizzatore inferiori. A temperature superiori a 130 °C, la velocità di reazione è stata determinata dalla diffusione dell’ossigeno e i composti fenolici si sono gradualmente accumulati durante la reazione, inibendola alla fine.
Nei processi moderni, l’ossidazione viene condotta a 165 °C e 0,9 MPa e il calore di reazione viene rimosso dalla circolazione esterna del contenuto del reattore.
La pressione del liquido scaricato dal reattore viene ridotta a quella atmosferica e il toluene non reagito viene recuperato.
L’acido benzoico viene purificato tramite rettifica e il residuo di fondo viene estratto per recuperare il catalizzatore al cobalto. Il gas di scarico viene raffreddato per recuperare la maggior parte del toluene, purificato e ventilato.
Il reattore di ossidazione può essere una colonna a bolle o un serbatoio agitato, con acciaio inossidabile come materiale di costruzione preferito.
Il prodotto è contaminato da piccole quantità di acido ftalico, monossido di carbonio e anidride carbonica nel gas di scarico e la resa di acido benzoico varia con la conversione del toluene, con selettività per benzaldeide e alcol benzilico superiore al 10% a conversioni inferiori.
Per produrre prodotti di qualità superiore, sono necessarie ulteriori lavorazioni come sublimazione, ricristallizzazione e neutralizzazione.
I metilbifenili sono responsabili dell’odore del prodotto e per la loro rimozione, sono stati proposti estrazione e trattamento in un flusso di gas inerte.
L’ossidazione catalitica degli idrocarburi alchilaromatici può essere migliorata aggiungendo composti di bromo al catalizzatore di cobalto in acido acetico.
Questo metodo è ora ampiamente utilizzato nella produzione di acido tereftalico ed è applicabile anche al processo dell’acido benzoico.
Un altro tipo di attivatore del catalizzatore di cobalto è un composto carbonilico facilmente ossidabile come il metiletilchetone o l’acetaldeide. Questi additivi consentono una notevole riduzione della temperatura di reazione, ma a causa del loro elevato consumo, la tecnologia non sembra essere pratica.
L’ossidazione in fase vapore del toluene a temperature più elevate è un altro potenziale processo, che utilizza vari catalizzatori come vanadio, tungsteno, uranio, molibdeno e argento. Tuttavia, le rese non erano paragonabili a quelle del processo in fase liquida.
2. Reazioni chimiche dell’acido benzoico
La stabilità dell’acido benzoico verso comuni agenti ossidanti come aria, permanganato, acido cromico, ipoclorito e acido nitrico diluito è stata ben documentata.
A temperature superiori a 220 °C, l’acido benzoico reagisce con sali di rame (II) per produrre fenolo e suoi derivati. Questa reazione, che è seguita dalla rigenerazione del rame (II) a base di ossigeno molecolare, è la base per la produzione industriale di fenolo dall’acido benzoico.
In condizioni simili, l’acido benzoico reagisce con l’ammoniaca per produrre anilina.
Dopo il riscaldamento a 150 °C, si verifica la disidratazione, con conseguente formazione di anidride benzoica.
Quando riscaldato a temperature superiori a 370 °C o fino a 245 °C in presenza di catalizzatori, si verifica la decarbossilazione, che porta alla formazione di benzene e di una piccola quantità di fenolo. L’uso di polvere di rame e cadmio catalizza il processo di decarbossilazione.
Quando il benzoato di potassio reagisce con l’anidride carbonica, si sproporziona in tereftalato e benzene, con l’ausilio di sali di cadmio e zinco come catalizzatori.
È stato dimostrato che l’idrossido di potassio fuso converte l’acido benzoico in acidi idrossibenzoici.
L’acido benzoico può essere idrogenato direttamente utilizzando idrogeno molecolare, con conseguente produzione di benzaldeide in una resa quantitativa. La reazione è catalizzata da zirconio e altri ossidi metallici.
L’idrogenazione su catalizzatori di metalli nobili porta alla formazione di acido cicloesancarbossilico (acido esaidrobenzoico).
Inoltre, la clorurazione produce acido 3-clorobenzoico, la nitrazione forma acido 3-nitrobenzoico e la solfonazione forma acido 3-solfobenzoico.
3. Utilizzi dell’acido benzoico
La stragrande maggioranza dell’acido benzoico viene consumata internamente per la produzione di fenolo, con solo una piccola quantità immessa sul mercato libero.
Nel 2006, l’uso di benzoato di sodio e potassio come conservanti alimentari ha rappresentato il 41% del consumo globale di acido benzoico.
L’acido benzoico è anche impiegato nella produzione di plastificanti benzoati, resine alchidiche e cloruro di benzile.
Gli esteri glicolici derivati dall’acido benzoico sono utilizzati come plastificanti nelle resine viniliche, con una domanda crescente negli Stati Uniti a causa della loro sostituzione del butilbenzilftalato negli adesivi in emulsione di poli(acetato di vinile).
Il benzoato di sodio funge da mercato principale per conservanti e anticorrosivi.
L’acido benzoico trova applicazione nelle resine alchidiche modificate per migliorare le proprietà superficiali degli smalti di rifinitura per autoveicoli.
Inoltre, viene utilizzato come intermedio per la produzione di profumi, prodotti farmaceutici e cosmetici.
Riferimento
- “Benzoic Acid and Derivatives”, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_555