Herstellungsmethoden aliphatischer Alkohole
Industriell sind mehrere lebenswichtige Alkohole von erheblicher Bedeutung. Dazu gehören Methanol, Ethanol, 1-Propanol, 1-Butanol und 2-Methyl-1-propanol (auch bekannt als Isobutylalkohol).
Auch Weichmacheralkohole (von C6 bis C11) und Fettalkohole (C12–C18) werden in großem Umfang bei der Herstellung von Waschmitteln verwendet. Diese Alkohole werden hauptsächlich durch verschiedene Verfahren gewonnen: Synthesegas (Methanol), Oxosynthese von Olefinen oder das Ziegler-Verfahren.
Neben den genannten Anwendungen dienen Alkohole als wirksame Lösungs- und Verdünnungsmittel für Farben, wobei hauptsächlich C1–C6-Alkohole verwendet werden. Sie fungieren auch als wesentliche Zwischenprodukte bei der Herstellung von Estern und verschiedenen organischen Verbindungen. Alkohole finden Anwendung als Flotationsmittel, Schmiermittel und Kraftstoffzusätze, einschließlich Methanol, Ethanol und Tert-Butylalkohol.
Für industrielle Anwendungen werden aus Kostengründen oft Isomerenmischungen bevorzugt, da reine Alkohole teuer sein können. Darüber hinaus können Mischungen mit unterschiedlichen Kohlenstoffatomzahlen für bestimmte Zwecke Vorteile bieten. Dadurch ist die Marktverfügbarkeit von Alkoholmischungen vergleichbar mit der von reinen Einzelalkoholen.
Inhaltsverzeichnis
Einführung
Die Herstellung aliphatischer Alkohole erfolgt durch verschiedene industrielle Prozesse, von denen einige im Folgenden aufgeführt sind:
- Synthese aus Kohlenmonoxid und Wasserstoff (C1)
- Oxo-Synthese, oft begleitet von Hydrierung der zunächst gebildeten Aldehyde (C3 – C20)
- Hydrierung von Aldehyden, Carbonsäuren oder Estern
- Aldolkondensation niederer Aldehyde mit anschließender Hydrierung der Alkenale (C3 → C6, C4 → C8, C8 → C16)
- Oxidation von Trialkylaluminiumverbindungen (Ziegler-Verfahren)
- Oxidation gesättigter Kohlenwasserstoffe
- Hydratisierung von Olefinen (C2–C4)
- Homologation von Alkoholen
- Hydrocarbonylierung nach dem Reppe-Verfahren
- Hydrocarboxymethylierung
- Fermentationsprozesse (C2–C5)
- Guerbet-Prozess
Unter diesen Prozessen sind die Methanol- und die Ethanolsynthese mit jährlichen Produktionen von etwa 49 × 106 t bzw. 99 × 106 t von größter Bedeutung. Auch die Oxosynthese ist von großer industrieller Relevanz und macht etwa 6,3 × 106 t Jahresproduktion aus.
Darüber hinaus haben die Hydratisierung von Ethylen und Propen zu Ethanol und 2-Propanol sowie die Oxidation von Trialkylaluminiumverbindungen (Alfol-Verfahren oder Ziegler-Verfahren) erhebliche kommerzielle Bedeutung erlangt.
Darüber hinaus haben Fermentationsverfahren, insbesondere für die Ethanolproduktion, aufgrund des Anstiegs der Ölpreise in bestimmten Regionen wieder an Bedeutung gewonnen.
1. Synthese aus Kohlenmonoxid und Wasserstoff
Aus Synthesegas wird kommerziell nur Methanol hergestellt. In der Vergangenheit wurden Verfahren wie Synol, Isobutylol und Oxyl verwendet, die zu Gemischen sauerstoffhaltiger Verbindungen mit Alkoholen als Hauptbestandteilen führten. Allerdings werden diese Methoden in der westlichen Welt nicht mehr angewendet. Neuere Entwicklungen erzeugen entweder sauerstoffhaltige Verbindungen oder Alkoholgemische.
Ein solches Verfahren ist die IFP-Methode (Inst. Français du Pétrole) für höhere Alkohole. Dabei werden hochaktivierte Katalysatoren unter Niederdruck-Methanolsynthesebedingungen eingesetzt. Der Katalysator besteht aus Mischoxiden von Kupfer und Kobalt, kombiniert mit mindestens einem anderen Metall (Al, Ce, Cr, Fe, La, Mn, Pr, Nd, Y oder Zn) sowie mindestens einem Gruppe I oder II Metallverbindung.
Durch Anpassung der Katalysatorzusammensetzung kann der höhere Alkoholgehalt im Produkt zwischen 20 und 50 Gew.-% variiert werden. Dieser Prozess führt jedoch zur Bildung mehrerer Nebenprodukte wie Kohlenwasserstoffe, Ester und Ketone.
Trotz dieser Fortschritte wird derzeit keines der oben genannten neueren Verfahren in der Industrie eingesetzt. Bei der Fischer-Tropsch-Synthese entstehen jedoch geringe Mengen höherer Alkohole als Nebenprodukte.
2. Oxo-Synthese
Die Oxosynthese ist eine Methode zur Herstellung von Alkoholen im Bereich C3–C20. Dabei reagieren Olefine (ungesättigte Kohlenwasserstoffe) mit Synthesegas (einem Gemisch aus Kohlenmonoxid und Wasserstoff) zu Aldehyden. Anschließend werden diese Aldehyde hydriert, um die gewünschten Alkohole herzustellen.
Eine spezielle Variante der Oxo-Synthese ist der sogenannte Shell-Prozess, bei dem der Katalysator HCo(CO)3PR3 eingesetzt wird, der eine starke Hydrierungsaktivität aufweist. Dieser Katalysator ermöglicht die direkte Hydrierung des zunächst gebildeten Aldehyds im Oxoreaktor.

Das Shell-Verfahren wurde 1963 erstmals kommerziell unter Verwendung von Propen zur Herstellung von 1-Butanol und 2-Ethylhexanol eingesetzt. Später, im Jahr 1965, wurde es zur Herstellung von Waschalkoholen weiterentwickelt. Seine Hauptanwendung liegt in der Herstellung höherer Alkohole.
Ein wesentlicher Vorteil des Shell-Verfahrens ist seine Fähigkeit, Olefine mit internen Doppelbindungen zu hydroformylieren. Die Reaktionsbedingungen begünstigen die Isomerisierung der Doppelbindung, was zur Bildung von α-Olefinen führt.
Beispielsweise können die durch den „SHOP-Prozess“ von Shell aus Ethylen gewonnenen ω-Olefin-Fraktionen mithilfe von Synthesegas in Alkohole umgewandelt werden. Die resultierenden Alkoholmischungen bestehen zu bis zu 80 % aus linearen Verbindungen und finden Verwendung in der Weichmacher- und Waschmittelindustrie.
3. Hydrierung von Aldehyden, Carbonsäuren und Estern
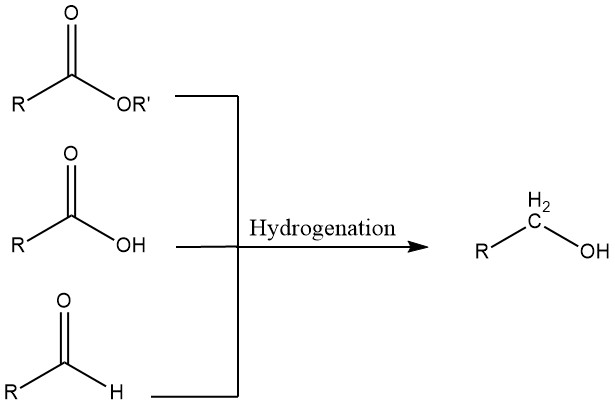
Aldehyde können mit homogenen oder heterogenen Katalysatoren hydriert werden. Homogene Systeme sind dann von Vorteil, wenn Ausgangsmaterialien Schwefel enthalten, der heterogene Katalysatoren vergiften würde, oder wenn der zur Hydrierung verwendete Wasserstoff Kohlenmonoxid enthält.
In den meisten Fällen werden jedoch heterogene Katalysatoren bevorzugt. Diese Katalysatoren sind sowohl bei Gasphasenreaktionen bei Temperaturen von 90–180 °C und Drücken von 25 bar als auch bei Flüssigphasenreaktionen bei 80–220 °C und Drücken bis zu 300 bar wirksam. Die in industriellen Prozessen verwendete Hydriertemperatur wird als Kompromiss zwischen optimaler Energieausnutzung und langer Katalysatorlebensdauer gewählt.
Für kontinuierliche Prozesse werden Festbettsysteme mit Katalysatoren bevorzugt. Der Aldehyd wird entweder in Dampfform, verdünnt mit überschüssigem Wasserstoff, oder in flüssiger Form mit Wasserstoff durch das Hochdruckrohr geleitet, das das Katalysatorbett enthält.
Um die bei der Reaktion entstehende Wärme abzuführen, wird Wasserstoff durch einen Wärmetauscher zirkuliert. Die Hydrierung von 2-Ethyl-2-hexenal, eine besonders wichtige Reaktion, wird typischerweise in einem einzigen Schritt unter Verwendung eines nickelhaltigen Katalysators durchgeführt.
Ähnliche einstufige Prozesse wurden vorgeschlagen. Üblich sind jedoch auch zweistufige Verfahren, bei denen die primäre Hydrierung in der Gasphase (z. B. unter Verwendung kupferhaltiger Katalysatoren) und die sekundäre Hydrierung in der Flüssigphase oder im Rieselbettverfahren (z. B. mit nickelhaltigen Katalysatoren) erfolgt Katalysatoren).
Diese Katalysatoren werden typischerweise auf Aluminiumoxid oder Kieselgel geträgert. Zusätzlich zu Nickel und Kupfer wurden erfolgreiche Katalysatoren unter Verwendung von Zink, Chrom und Kombinationen dieser Metalle entwickelt.
Zur Herstellung von Fettalkoholen werden die entsprechenden Carbonsäureester hydriert. Als Ausgangsstoffe dienen natürliche Fette und Öle, die zunächst zu Methylestern umgeestert und anschließend entweder durch Natrium (Bouveault-Blanc-Reduktion) oder durch katalytische Hydrierung zu Alkoholen reduziert werden.
Die Natriumreduktion ermöglicht die Herstellung ungesättigter Fettalkohole aus den Estern ungesättigter Fettsäuren.
Die Hydrierung von Fettsäuren und Fettsäureestern erfordert im Vergleich zur Aldehydhydrierung strengere Bedingungen. Der Prozess kann kontinuierlich oder diskontinuierlich unter Verwendung von Kupfer-Chromoxid-Katalysatoren (Adkins-Katalysatoren) entweder in Suspension oder im Festbett durchgeführt werden.
Typisch sind Reaktionstemperaturen von 240–300 °C und Drücke von 200–300 bar. Durch Modifizierung der Katalysatoren (z. B. durch Zugabe von Cadmium) können ungesättigte Fettsäureester direkt in ungesättigte Fettalkohole umgewandelt werden.
4. Aldolkondensation niederer Aldehyde und Hydrierung der Alkenale
In industriellen Prozessen ist die Oxosynthese die einzige Aldehydquelle, die für die Aldolkondensation verwendet wird.
Nach der Entfernung von Isoaldehyden und Nebenprodukten wird die Kondensationsreaktion entweder durch Säuren oder Basen katalysiert. Die Reaktivität jedes Aldehyds wird durch seine Kettenlänge und den Verzweigungsgrad beeinflusst und erfordert spezifische Reaktionsbedingungen, die auf jede einzelne Verbindung zugeschnitten sind.
Die bei der Kondensation entstehenden Aldole unterliegen einer Dehydratisierung, was zur Bildung von Alkenalen führt. Anschließend werden diese Alkenale mit heterogenen Katalysatoren hydriert. Typischerweise werden für diesen Prozess die gleichen Katalysatoren verwendet, die auch für die Hydrierung von Oxo-Aldehyden eingesetzt werden.
Mit dieser Methode können 2-Ethylhexanol, 2-Methylpentanol und begrenzte Mengen hochverzweigter isomerer C16- und C18-Alkohole hergestellt werden.
Allerdings hat das Aldoxverfahren, bei dem das bei der Oxosynthese gebildete Aldehydgemisch einer Aldolkondensation im Oxoreaktor unterzogen wird, aufgrund des Vorhandenseins gemischter Aldole in den Endprodukten keine breite Akzeptanz gefunden. Dennoch sind bestimmte gemischte Aldole, beispielsweise die von Acetaldehyd mit höheren Aldehyden, für bestimmte Anwendungen von Bedeutung.
5. Oxidation von Trialkylaluminiumverbindungen
Ethylen kann mit Triethylaluminium addieren, was zu einer Mischung von Trialkylaluminiumverbindungen mit höherer Molekularmasse führt. Diese Produkte können mit Luft oxidiert werden, was zur Bildung der entsprechenden Aluminiumalkoxide führt.
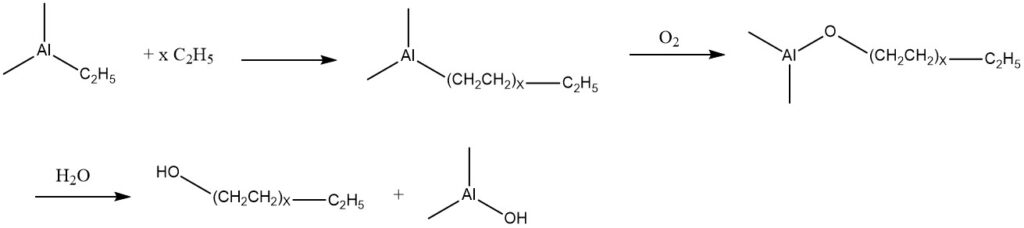
Anschließend werden diese Alkoxide hydrolysiert, wodurch eine Mischung linearer primärer Alkohole entsteht, die die gleiche Anzahl an Kohlenstoffatomen besitzen wie die Alkylgruppen in den Trialkylaluminiumkomponenten.
Basierend auf dieser als Ziegler-Prozess bekannten Reaktion wurden zwei kommerzielle Verfahren entwickelt. Eine davon stammt von Conoco, die in den USA seit 1962 tätig ist, und in Deutschland von Condea Chemie (Conoco und Deutsche Texaco) seit 1964.
Der andere stammt von der Ethyl Corp., die seit 1965 in Betrieb ist. Die Hauptunterschiede zwischen den beiden Verfahren liegen in der Kettenlängenverteilung und Linearität der resultierenden Alkohole sowie den technischen Eigenschaften, die mit deren Erzeugung und Steuerung verbunden sind Verteilung.
Beim Alfol-Alkohol-Verfahren (Conoco-Verfahren) wird die Kettenwachstumsreaktion bei möglichst niedriger Temperatur durchgeführt, um Verdrängungsreaktionen zu vermeiden, die zur Bildung von Olefinen führen könnten. Die resultierenden Alkohole zeigen eine Kettenlängenverteilung, die einer Poisson-Kurve ähnelt, und sind praktisch 100 % linear.
Der Alfol-Alkoholprozess liefert typischerweise ein breites Spektrum an Alkoholen (C2–C28), und obwohl Anpassungen vorgenommen werden können, um die Kettenlängen der hergestellten Alkohole zu erhöhen oder zu verringern, bleibt das Verteilungsmuster konsistent.
Andererseits hat die Ethyl Corp. erfolgreich ein Verfahren mit kontrolliertem linearem Kettenwachstum entwickelt, das überwiegend C12- und C14-Alkohole liefert. Diese Alkohole sind zu 95 % linear aufgebaut.
6. Oxidation gesättigter Kohlenwasserstoffe
Bei der Baschkirow-Oxidation werden aliphatische Kohlenwasserstoffe mit Luft in Gegenwart von Borsäure oxidiert, was zu hohen Ausbeuten an Borsäureestern führt.
Diese Ester werden dann in einem nachfolgenden Schritt hydrolysiert, wodurch sekundäre Alkohole entstehen, bei denen die Hydroxylgruppen statistisch entlang der Molekülkette verteilt sind. Die Reaktion verläuft über ein sekundäres Hydroperoxid als Zwischenprodukt.
Die Oxidation wird typischerweise in der flüssigen Phase bei Temperaturen zwischen 150–170 °C und in Gegenwart von 4–5 Gew.-% Metaborsäure durchgeführt. Es wird ein Stickstoff-Sauerstoff-Gemisch (ca. 3,5 % O2) bei normalem oder leicht erhöhtem Druck verwendet.
Einige neuere Anlagen enthalten Amine als Cokatalysatoren. Um wirtschaftlich akzeptable Selektivitäten von 80–85 % zu erreichen, wird der Umsatzgrad unter 20 % gehalten.
Zur Entfernung von Ausgangsmaterialien und Oxidationsnebenprodukten wird Flash-Verdampfung eingesetzt, gefolgt von einer Reinigung in alkalischen und Wasserwäschern, wobei n-Kohlenwasserstoffe recycelt werden.
Die erhaltenen Metaborsäureester bzw. Boroxine sind oxidationsbeständig und thermisch stabil. Nach der fraktionierten Destillation erhält man Alkohole mit einer Reinheit von über 98 %.
Den Abschluss des Prozesses bildet das „Hydrofinishing“ (Hydrierung an heterogenen Nickelkatalysatoren) zur Entfernung von Farb- und Geruchsstoffen.
Orthoborsäure in der wässrigen Lösung wird durch Dehydratisierung in Metaborsäure umgewandelt, und eine Rückgewinnung kann auch durch Kristallisation erreicht werden.
Bei einigen neueren Verfahrensvarianten wird das Borsäurekonzentrat mit den n-Kohlenwasserstoffen vermischt und die Mischung entwässert, um Agglomerationen und Verstopfungen zu verhindern. Die getrocknete Aufschlämmung wird dann in den Oxidationsreaktor zurückgeführt.
Baschkirow entwickelte das deutsche Werk ursprünglich in den 1950er Jahren zu einem kommerziellen Verfahren. Das erste Werk nahm 1959 in Shebekino/Belgorod, UdSSR, die Produktion auf. Werke wurden auch in der Sowjetunion und in Japan betrieben. Allerdings wurde das Werk von Union Carbide (UCC) in den Vereinigten Staaten 1977 geschlossen.
Die dabei entstehenden sekundären Alkohole werden üblicherweise in Alkylphenolethoxide umgewandelt und als Waschmittel eingesetzt. Aufgrund der aufwendigen Rückführung von Kohlenwasserstoffen und Borsäure sowie Nachteilen bei der Anwendung sekundärer Alkohole hat dieses Verfahren in der westlichen Welt jedoch keine nennenswerte Bedeutung erlangt.
Neben der Baschkirow-Oxidation besteht eine weitere wichtige Anwendung der Borsäure-katalysierten Oxidation in der Herstellung von Cyclohexanol und Cyclohexanon aus Cyclohexan als Zwischenprodukten bei der Herstellung von Caprolactam, Adipinsäure und Phenol.
Darüber hinaus wird es bei der Synthese von Cyclododecanol (einem Zwischenprodukt der Nylon-12-Synthese) und Cyclododecanon aus Cyclododecan verwendet. Der Prozess beinhaltet die Oxidation mit Alkylhydroperoxiden, wobei Eisenporphyrine als nützliche Katalysatoren dienen.
Alkohole können aus Fettsäuren durch Veresterung fraktionierter Rohsäuren (hauptsächlich im C10–C15-Bereich) mit Methanol oder Butanol und anschließende Hydrierung gewonnen werden. Wenn lineare Kohlenwasserstoffe als Ausgangsstoffe verwendet werden, können lineare Alkohole hergestellt werden.
Abhängig vom spezifischen Kohlenwasserstoff, Katalysator und den Reaktionsbedingungen kann die Alkoholmischung jedoch 5–15 % verzweigtkettige Alkohole enthalten. Aufgrund von Verunreinigungen in den Fettsäuren können die daraus gewonnenen Alkohole Geruchsstoffe enthalten, was ihren Einsatzbereich einschränkt.
7. Hydratation von Olefinen
Die Hydratisierung von Alkenen ist eine gängige Methode zur Herstellung niederer Alkohole. Nach der Regel von Markownikow entstehen bei dieser Reaktion sekundäre und tertiäre Alkohole (außer im Fall von Ethylen).
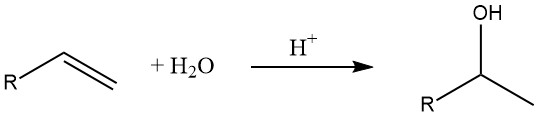
Die Geschwindigkeit der Hydratationsreaktion hängt von der Stabilität des intermediären Carbeniumions ab, wobei tertiäre Carbeniumionen stabiler sind als sekundäre und primäre.
Daher erfolgt die Hydratation von Isobuten aufgrund der relativen Stabilität des intermediären tertiären Carbeniumions leicht bei Raumtemperatur in Gegenwart niedriger H⁺-Ionenkonzentrationen. Andererseits erfordert die Hydratisierung von Ethylen erhöhte Temperaturen und Drücke.
In industriellen Umgebungen werden zwei Varianten der Hydratationsreaktion verwendet. Beim indirekten Verfahren erfolgt die Flüssigphasenreaktion in zwei Schritten. Zunächst reagiert das Olefin mit Schwefelsäure zu Mono- und Dialkylsulfaten, die dann nach Verdünnung mit Wasser hydrolysiert werden und den Alkohol bilden. Dieses Verfahren erfordert jedoch einen kostspieligen Rekonzentrierungsschritt zur Wiederverwendung der Schwefelsäure.
Beim direkten Verfahren erfolgt die Hydratation in der Gasphase. Da die Reaktion exotherm ist und zu einer Volumenverringerung führt (2 Mol Reaktant bilden 1 Mol Produkt), wird die Alkoholbildung durch hohen Druck und niedrige Temperatur begünstigt.
Aufgrund der unvollständigen Konvertierung ist bei diesem Prozess eine aufwendige Gasrückführung notwendig. Effiziente Katalysatoren für die direkte Hydratationsreaktion umfassen phosphorsäurehaltige Materialien wie Celite, obwohl zunehmend auch Ionenaustauscher verwendet werden.
Die direkte Hydratation wird hauptsächlich bei der Herstellung von Ethanol aus Ethylen und Isopropylalkohol aus Propen eingesetzt. Es spielt auch eine wichtige Rolle bei der Herstellung von 2-Butanol aus einer Mischung von 1-Buten und 2-Buten (Raffinat II) und tert-Butylalkohol aus Isobuten.
8. Homologation von Alkoholen
Homologation ist eine chemische Reaktion, bei der Alkohole mit Synthesegas in Gegenwart komplexer Mehrkomponenten-Katalysatorsysteme reagieren. Abhängig von den spezifischen Reaktionsbedingungen können die erhaltenen Produkte entweder Aldehyde oder Alkohole mit einer zusätzlichen CH2-Gruppe im Vergleich zu den Ausgangsmaterialien sein.
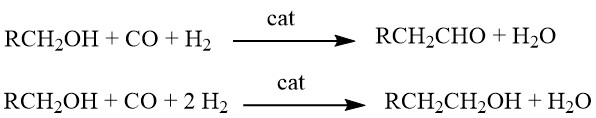
Ursprünglich wurde diese Reaktion für die Synthese von Ethanol aus Methanol entwickelt. Seine Anwendungen wurden jedoch auf die Herstellung homologer Aldehyde (z. B. Acetaldehyd aus Methanol), Carbonsäuren (z. B. Propionsäure aus Essigsäure), Carbonsäureestern (z. B. Ethylacetat aus Methylacetat) und sogar der Herstellung erweitert Synthese von Styrol (durch Homologation von Benzylalkohol zu 2-Phenylethanol, gefolgt von Dehydratisierung).
Trotz erheblicher Fortschritte in diesem Bereich wurde der Homologationsprozess aufgrund mehrerer Herausforderungen nicht im industriellen Maßstab umgesetzt. Der bisher erreichte Umsatz und die Selektivität reichen für eine praktische industrielle Anwendung noch nicht aus und es bestehen Schwierigkeiten bei der Wiederverwertung der komplexen Homologierungskatalysatoren. Infolgedessen bleibt die Anwendung der Homologisierungsreaktion im industriellen Maßstab begrenzt.
9. Reppe-Prozess
Der Reppe-Hydrocarbonylierungsprozess umfasst die Reaktion von Olefinen mit Kohlenmonoxid und Wasser unter Verwendung von Ammoniumsalzen von Tetracarbonyldihydridoeisen als Katalysator zur Herstellung von Alkoholen. Ähnlich wie bei der Oxosynthese entstehen auch bei diesem Verfahren verzweigtkettige Produkte, sodass sich ein Molverhältnis von linearen zu verzweigtkettigen Alkoholen von etwa 9:1 ergibt.

Beispielsweise reagiert Propen bei Temperaturen von 90–110 °C und Drücken zwischen 5 und 20 bar zu Butanolen mit einer hohen Ausbeute von 90 %. Etwa 4 % des Propens werden zu Propan hydriert. Allerdings erfordert die Umwandlung höherer Olefine strengere Reaktionsbedingungen.
Trotz seines Potenzials kann das Reppe-Hydrocarbonylierungsverfahren hinsichtlich der industriellen Bedeutung nicht mit der Hydroformylierung konkurrieren. Die einzige bekannte Anlage, die dieses Verfahren zur Herstellung von Butanol aus Propen nutzt (Japan Butanol Co., mit einer Kapazität von 30.000 t/a), stellte Anfang der 1980er Jahre ihren Betrieb ein.
10. Hydrocarboxymethylierung
Die Hydrocarboxymethylierung ist eine Variante des Reppe-Verfahrens, bei dem höhere Olefine unter Verwendung eines Kobalt-Pyridin-Katalysators mit Kohlenmonoxid und Methanol reagieren.
Die resultierenden Produkte sind Ester von Carbonsäuren, die im Vergleich zum ursprünglichen Olefin-Ausgangsmaterial ein Kohlenstoffatom mehr in der Stammkette aufweisen. Diese Ester können weiter hydriert werden, um die entsprechenden Alkohole zu ergeben.
Trotz seines Potenzials hat das Verfahren aus wirtschaftlichen Gründen jedoch keine nennenswerte industrielle Bedeutung erlangt. Heutzutage können die Produkte aus natürlichen Rohstoffen kostengünstiger hergestellt werden. Daher hat die Hydrocarboxymethylierung in industriellen Anwendungen noch keine breite Bedeutung erlangt.
11. Gärung
Die Fermentation, die als eine der ältesten Methoden zur Herstellung von Ethanol gilt, wird immer noch in großem Umfang praktiziert. In kleinerem Maßstab werden Pentanole aus Fuselalkoholen gewonnen.
In jüngster Zeit kommt der Butanol-Aceton-Fermentation von Kohlenhydrat-Rohstoffen eine zunehmende Bedeutung zu.
Unternehmen wie Gevo und Butamax (ein Joint Venture zwischen BP und DuPont) haben umfangreiche Untersuchungen zur Herstellung von Butanol aus erneuerbaren Rohstoffen durchgeführt. Dies deutet auf ein wachsendes Interesse an der Nutzung von Fermentationsprozessen zur Herstellung von Butanol aus nachhaltigen Quellen hin.
12. Guerbet-Alkohole
Beim Guerbet-Verfahren werden gesättigte primäre Alkohole dimerisiert, um α-verzweigte primäre Alkohole zu erzeugen. Typischerweise wird die Reaktion durch Rückflusskochen des Alkohols in Gegenwart eines alkalischen Kondensationsmittels und eines Hydrierungs-Dehydrierungskatalysators durchgeführt, wie unten gezeigt:
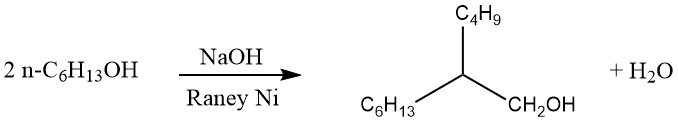
Das bei der Reaktion entstehende Wasser und geringe Mengen Wasserstoff werden kontinuierlich entfernt. Bei längerem Erhitzen können auch trimere α-verzweigte primäre Alkohole entstehen.
Die Ausbeute an dimeren Alkoholen im Guerbet-Verfahren beträgt etwa 80 %. Diese Ausbeute kann durch Recycling der Rückstände und schrittweise Zugabe von frischem Katalysator gesteigert werden. Während verschiedene Substanzen, darunter metallisches Natrium, als Kondensationsmittel vorgeschlagen wurden, werden für industrielle Anwendungen üblicherweise Alkalimetallhydroxide bevorzugt.
Kurzkettige Alkohole mit kürzeren Kettenlängen als Cetylalkohol (C16) werden vorzugsweise bei höherem Druck dimerisiert. Mit diesem Verfahren ist es möglich, kurzkettige Alkohole in C10–C20-Alkohole umzuwandeln. Es werden beispielsweise 2-Hexyldecanol und 2-Octyldodecanol hergestellt, die als ölige Komponenten mit vorteilhaften Lösungsmitteleigenschaften in der Kosmetik Anwendung finden.
Allerdings hat die Guerbet-Reaktion keine industrielle Bedeutung erlangt, da sich Alkohole mit typischer α-Verzweigung mit anderen Methoden leichter herstellen lassen. Beispielsweise kann 2-Ethyl-1-hexanol durch Hydroformylierung von Propen zur Herstellung von Butanal und anschließendem Aldolkondensationsschritt gewonnen werden.
Aufgrund der Verfügbarkeit alternativer Verfahren zur Synthese von α-verzweigten Alkoholen hat sich die Guerbet-Reaktion nicht als großtechnischer Prozess etabliert.
13. Andere Prozesse
Die Epoxidierung linearer α-Olefine mit anschließender hydrierender Spaltung ist von großem kommerziellen Interesse. Bei diesem Prozess entstehen Weichmacheralkohole (C6–C10) oder Waschalkohole (C10–C16).
Für den hydrierenden Spaltschritt können verschiedene Katalysatoren eingesetzt werden. Die Selektivität gegenüber primären Alkoholen kann durch die Wahl des Katalysators, die Bedingungen des Hydrierungsprozesses und die Verwendung von Lösungsmitteln beeinflusst werden.
Darüber hinaus ist die Hydrolyse von Carbonsäureestern für industrielle Anwendungen von gewisser Bedeutung.
Referenz
- Alcohols, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_279.pub2
