Alkylation des composés aromatiques
L’alkylation de Friedel-Crafts
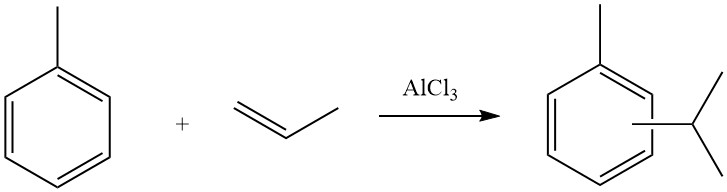
L’alkylation Friedel-Crafts de composés aromatiques implique une substitution électrophile catalysée par un acide, dans laquelle un groupe alkyle remplace un hydrogène aromatique. Une gamme variée d’agents d’alkylation, tels que des oléfines, des halogénures d’alkyle et des alcools, est couramment utilisée à cette fin.
Cette réaction peut être appliquée à divers substrats aromatiques, y compris des composés hétéroaromatiques et même des composés comme le ferrocène. Ces réactions sont généralement rapides et exothermiques, et elles sont souvent conduites dans des conditions douces en phase liquide.
Cependant, dans certains cas, des procédés en phase vapeur avec des conditions plus strictes sont utilisés pour certains substrats. Lorsque des oléfines, des halogénures d’alkyle et des alcools sont utilisés comme agents d’alkylation, les réactions globales se déroulent comme suit :
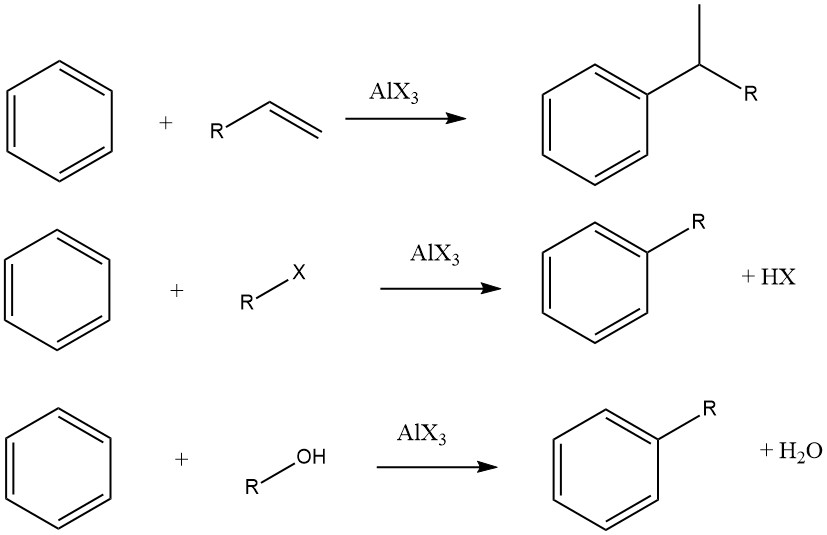
Table des matières
Le degré d’isomérisation de la fraction alkyle et le respect de la règle de Markovnikov au cours du processus d’addition varient en fonction de l’acidité du catalyseur.
1.1. Catalyseurs pour l’alkylation de Friedel-Crafts
Les catalyseurs utilisés dans le procédé d’alkylation de Friedel-Crafts sont acides et leur efficacité dépend de divers facteurs, notamment les conditions de réaction, les agents d’alkylation et les substrats aromatiques. Les acides de Lewis et les acides de Brønsted peuvent agir comme catalyseurs actifs, et les catalyseurs fréquemment utilisés sont classés en fonction de leurs structures chimiques.
| Groupe | Exemples | Type d'acide |
|---|---|---|
| Halogénures acides | AlCl3, AlBr3, SnCl4, SbCl5, FeCl3 | Acides de Lewis |
| Alkyles et alcoolates métalliques | AlR3, BR3, ZnR2, Al(OPh)3 | Acides de Lewis |
| Acides protoniques | HCl, HCl – AlCl3, H2SO4, HF, H3PO4 | Acide de Brønsted |
| Oxydes acides et dérivés | zéolithes, oxydes mixtes et superacides solides, argiles, hétéropolyacides | Acide de Brønsted/Lewis |
| Acides supportés | H3PO4 – SiO2, BF3 – Al2O3 | Acide de Brønsted/Lewis |
| Résines échangeuses de cations | Permutit Q, Amberlite IR 112, Dowex 50, Nafion - silice, Deloxan | Acide de Brønsted |
Traditionnellement, les halogénures acides tels que AlCl3 ou AlBr3 et les acides protoniques tels que HCl, HF ou H2SO4, supportés sur de la surface de diatomées, ont été largement utilisés. Cependant, une évolution se produit vers le remplacement de ces catalyseurs par des zéolithes et des oxydes inorganiques en raison de leur respect de l’environnement, de leur facilité de manipulation et de leurs implications en termes de coût dans la conception des procédés.
La présence de bases, notamment de composés organiques azotés, réduit l’acidité et l’efficacité du catalyseur. L’oxygène, même à des concentrations aussi faibles que 20 ppm, peut conduire à la formation de matières résineuses lourdes sur le catalyseur. Des diènes comme le butadiène dans une charge de butène contribuent également à la production de substances résineuses ou goudronneuses sur le catalyseur.
Fait intéressant, des traces d’humidité ou d’autres fournisseurs de protons peuvent améliorer l’activité catalytique, en particulier pour les acides de Lewis. Cependant, des quantités plus élevées de ces composés sont préjudiciables aux performances du catalyseur.
Dans certains cas, des poisons de catalyseur doux, tels que des composés nitrés organiques, sont intentionnellement utilisés pour réduire l’acidité du catalyseur et prévenir les réactions secondaires telles que l’isomérisation. Ces composés nitrés organiques forment des complexes stoechiométriques avec les acides de Lewis, résultant en des processus d’alkylation plus propres avec des rendements modérés.
De plus, certains adduits comme BF3·OEt2 ou BF3·C6H5OH agissent comme des catalyseurs doux de Friedel-Crafts. Les impuretés dans les catalyseurs, comme la présence de chlorure ferrique dans le chlorure d’aluminium, peuvent réduire considérablement le rendement du produit et avoir un impact sur le déroulement de la réaction catalysée par les acides de Lewis.
1.2. Isomérisation des agents alkylants
En raison de la nature acide des conditions de réaction dans l’alkylation de Friedel-Crafts, les réactifs d’alkylation subissent souvent des réarrangements et ont tendance à se transformer en l’isomère le plus ramifié possible. Ceci est démontré dans les réactions du benzène avec le chlorure de propyle, où l’isopropylbenzène est le produit principal, et avec le chlorure de n-butyle, qui conduit à la formation de sec-butylbenzène.
Dans ces cas, l’isomérisation de l’agent alkylant est initiée par la migration d’un atome d’hydrogène plutôt que par des réarrangements directs du carbone. Le moteur de cette isomérisation est la formation du carbocation le plus stable, suivant la tendance habituelle : primaire < secondaire < tertiaire.
Par exemple, lorsque le benzène est alkylé avec des 1-oléfines linéaires à longue chaîne, la réaction conduit non seulement à la formation de 2-alkylbenzène mais également à une distribution aléatoire du substituant phényle le long de la chaîne alkyle dans la plupart des cas.
Cet effet pourrait également être attribué à l’isomérisation des produits de réaction alkylés, car le n-butylbenzène est transformé en sec-butylbenzène en présence d’un catalyseur de Friedel-Crafts comme AlCl3.
Dans certaines conditions de réaction, l’alkylation du benzène avec des halogénures d’alkyle tertiaire peut entraîner la formation d’alkylbenzènes secondaires plutôt que d’alkylbenzènes tertiaires.
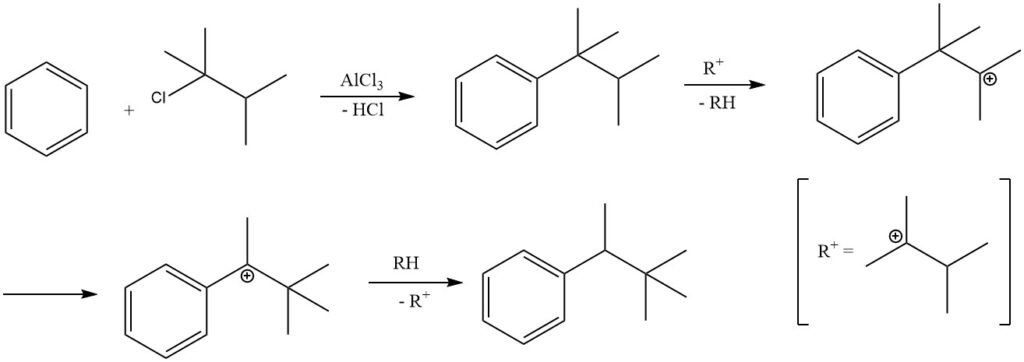
Par exemple, l’alkylation du benzène avec du 2-chloro-2,3-diméthylbutane produit principalement du 2,2-diméthyl-3-phénylbutane en raison de l’isomérisation du produit primaire tert-hexylbenzène. L’isolement du produit primaire, le tert-hexylbenzène, n’est possible que lorsque des catalyseurs moins actifs, tels que le chlorure ferrique, sont utilisés.
1.3. Réactivité des substrats aromatiques
La substitution électrophile des composés aromatiques dans l’alkylation de Friedel-Crafts est influencée par la présence de substituants sur le substrat aromatique. Les substituants donneurs d’électrons tels que alkyle, NR2 ou OR (où R est un groupe alkyle) augmentent la réactivité, amenant le nouveau substituant à entrer de préférence en position ortho ou para.
En conséquence, lorsque le benzène est alkylé avec des oléfines, du benzène monosubstitué se forme. Cependant, ce benzène monosubstitué réagit plus rapidement avec une autre molécule d’oléfine que le benzène lui-même, conduisant à un mélange complexe de benzènes mono- et polyalkylés.
Le degré de polysubstitution est affecté par les conditions de réaction et est réduit par l’encombrement stérique des groupes alkyle volumineux. Les oléfines volumineuses comme le cyclohexène ou les oléfines linéaires C6 – C18 permettent de bons rendements de monoalkylation dans le benzène.
L’éthylène ou le propène peuvent être monoalkylés grâce au recyclage de produits polyalkylés et à un choix judicieux des conditions de réaction, comme on le voit dans la synthèse industrielle de l’éthylbenzène et du cumène.
Dans l’alkylation des benzènes monosubstitués, les isomères ortho et para prédominent initialement. Cependant, l’isomérisation ultérieure aboutit souvent à un mélange à l’équilibre plus riche en méta-produit.
L’ortho-substitution n’est favorisée que si elle est stériquement gênée. Par exemple, la réaction du benzène et du 4-méthylcyclohexène catalysée par HF produit 75% de dérivé monoalkyle et 25% de dérivé dialkyle, 75% étant l’isomère para et seulement 25% l’isomère méta.
De même, l’alkylation du cumène par le 2-butène sur BF3 – H3PO4 donne 91% de produit para, et la dialkylation du benzène avec du propène sur silice – alumine donne préférentiellement du p-diisopropylbenzène, adapté à la synthèse de l’acide téréphtalique et de l’hydroquinone.
Le remplacement du benzène par des halogénures désactive la réaction. Les phénols ou les éthers phényliques réagissent beaucoup plus rapidement que le benzène lors de l’alkylation en raison de la densité électronique considérablement accrue dans les positions ortho et para.
Dans les matériaux microporeux, les réactivités, les sélectivités des produits et les préférences des isomères dépendent largement du type, du nombre et de la force des sites acides et de la géométrie des pores de la zéolite. L’alkylation utilisant des catalyseurs solides nécessite généralement des températures plus élevées, à l’exception des acides solides très forts, tels que les superacides solides.
1.4. Désalkylation et transalkylation
De nombreux catalyseurs utilisés pour alkyler des composés aromatiques peuvent également favoriser la réaction inverse d’alkylation, en particulier à des températures plus élevées. Par exemple, lorsque des alkylbenzènes sont chauffés avec AlCl3, des mélanges de benzène et de benzènes polyalkylés se forment par alkylation inverse.
La tendance des composés alkylaromatiques à subir une dismutation dépend également de la structure du substituant alkyle, suivant l’ordre : tert-C4H9 > iso-C3H7 > n-C3H7 > C2H5 > CH3.
La dismutation et la transalkylation des méthylbenzènes se produisent entre 300 et 450 °C en présence de catalyseurs acides solides tels que SiO2 – Al2O3, tandis que la dismutation et la transalkylation des éthylbenzènes et des isopropylbenzènes ont lieu en dessous de 100 °C avec des catalyseurs typiques de Friedel-Crafts.
Le transfert de groupe alkyle intermoléculaire (transalkylation) est utilisé dans divers procédés industriels. Par exemple, dans la synthèse de l’éthylbenzène, le produit de dialkylation indésirable réagit avec un excès de benzène frais pour obtenir une conversion élevée de l’éthylène en éthylbenzène.
En présence d’un excès de BF3 – HF, la dismutation des monoalkylbenzènes donne majoritairement l’isomère méta. Ceci est dû à la grande stabilité du complexe [m-Et2C6H5]+[BF4]-. Un type de complexe similaire est utilisé commercialement pour extraire sélectivement le m-xylène de mélanges de composés aromatiques en C8.
L’équilibre entre les réactions d’alkylation et de désalkylation explique la distribution des produits dans l’alkylation des composés aromatiques substitués. Initialement, des isomères ortho et para se forment et peuvent être isolés avec des temps de réaction courts (contrôle cinétique). Cependant, avec des temps de réaction prolongés, ces isomères s’isomérisent en méta isomères plus stables (contrôle thermodynamique).
Dans le commerce, les procédés de désalkylation sont utilisés pour convertir le toluène en benzène, isomériser le m-xylène en les dérivés ortho et para souhaités et disproportionner le toluène en benzène et xylènes. Ces procédés tirent parti du comportement d’équilibre du composé alkylaromatique.
2. Alkylation du benzène
L’alkylation du benzène trouve trois applications commerciales majeures :
1. Alkylation avec de l’éthylène pour produire de l’éthylbenzène, qui sert d’intermédiaire pour la production de styrène. La capacité de production mondiale d’éthylbenzène était d’environ 20 millions de tonnes métriques par an en 1991.
2. Alkylation avec du propène pour produire du cumène, qui est un intermédiaire pour la production de phénol, avec de l’acétone comme sous-produit. La capacité de production mondiale de cumène était d’environ 7,5 millions de tonnes métriques par an en 1992.
3. Alkylation avec des oléfines à longue chaîne contenant de 10 à 18 atomes de carbone pour produire des alkylbenzènes, qui sont ensuite sulfonés pour produire des composés tensioactifs. La capacité de production d’alkylbenzènesulfonates linéaires (LAB) en 1992 était d’environ 180 000 tonnes métriques par an.
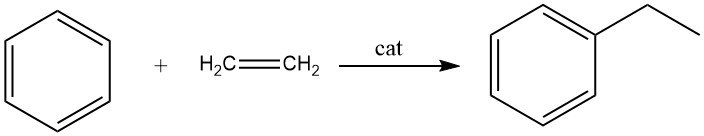
2.1. Alkylation du benzène avec de l’éthylène
L’alkylation du benzène avec l’éthylène entraîne la formation d’éthylbenzène, une réaction rapide et exothermique.
Au cours de ce processus, des quantités importantes de polyéthylbenzènes sont produites comme sous-produits. L’alkylation peut être effectuée à la fois en phase liquide et en phase vapeur.
Dans les procédés en phase liquide, AlCl3 est le catalyseur le plus couramment utilisé, mais d’autres catalyseurs tels que BF3, FeCl3, ZrCl4, SnCl4, H3PO4 et les phosphates alcalino-terreux sont également utilisés. La réaction est généralement conduite à pression atmosphérique et à des températures comprises entre 85 et 95 °C.
L’alkylation en phase vapeur du benzène est largement pratiquée, en particulier aux États-Unis. Elle est généralement réalisée à environ 300 °C et 40 – 65 bar en utilisant des catalyseurs hétérogènes acides comme Al2O3-SiO2 ou H3PO4-SiO2.
Pour améliorer la sélectivité à la monoalkylation, un faible rapport éthylène-benzène (0,2 : 1,0) est utilisé. Le procédé Alkar, développé par Universal Oil Products, est utilisé commercialement dans plusieurs usines et utilise du trifluorure de bore supporté sur de l’alumine anhydre modifiée comme catalyseur non corrosif.
Le procédé Alkar permet une large plage de concentration d’éthylène (5 à 95 %) dans le gaz d’alimentation, permettant l’utilisation de gaz de dégagement provenant du craquage catalytique ou de la tête de déméthanisation, ou d’éthylène de haute pureté. Les conditions du procédé impliquent généralement des températures d’environ 300 °C et des pressions d’environ 60 bars, conduisant à une conversion complète de l’éthylène.
La distribution des isomères obtenue à l’aide du catalyseur Alkar pour l’alkylation du benzène avec l’éthylène est la suivante :
Diéthylbenzènes :
1,2- (26%);
1,3- (49 %) ; et
1,4- (25%).
Triéthylbenzènes :
1,2,3- (3%);
1,2,4- (35%); et
1,3,5- (62%).
Les catalyseurs zéolitiques ont acquis un intérêt significatif pour l’éthylation du benzène. Mobil Oil et Badger ont introduit un procédé en phase vapeur à lit fixe utilisant des zéolithes ZSM-5 propriétaires, conduit à 420 – 430 °C et 15 – 20 bar.
L’éthylène pur ou dilué peut être utilisé comme matière première après purification. Les polyalkylbenzènes peuvent être recyclés pour la transalkylation, ce qui donne un rendement final élevé en éthylbenzène (98 à 99 % en moles). Les catalyseurs à base de zéolithe présentent des avantages par rapport aux catalyseurs acides liquides de Brønsted ou de Lewis, étant non corrosifs et inoffensifs pour l’environnement, simplifiant la construction, la manipulation et l’élimination.
Un autre procédé à base de zéolite appelé le procédé EBMax, utilisant le catalyseur de zéolite MCM-22 exclusif de Mobil, fonctionne en phase liquide. De plus, un catalyseur à base de zéolithe développé par Unocal est utilisé dans une technologie d’alkylation en phase liquide à lit fixe sous licence Lummus/Unocal/UOP.
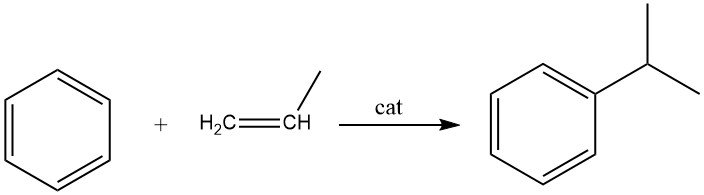
2.2. Alkylation du benzène avec du propène
L’alkylation du benzène avec le propène conduit à la production de cumène, qui est une réaction exothermique. Le cumène est un composé essentiel utilisé principalement dans la synthèse du phénol avec l’acétone comme co-produit. Une petite partie du cumène est également utilisée dans la production d’α-méthylstyrène.
Les procédés en phase liquide et en phase vapeur sont utilisés commercialement pour la synthèse du cumène. Le procédé en phase liquide largement utilisé par Universal Oil Products utilise un catalyseur d’acide phosphorique solide (SPA) supporté sur de la terre de diatomées.
La réaction est conduite à 15 – 35 bar et à des températures de 200 – 250 °C. Pour éviter la polyalkylation et obtenir une conversion élevée du propène (environ 94 %), un rapport molaire du benzène au propène de 5:1 est nécessaire. La conversion diminue à 70 % lorsqu’un rapport d’alimentation benzène-propène de 4:1 est utilisé.
L’augmentation de la pression et de la température améliore la conversion plutôt que les rendements en cumène. En plus du catalyseur SPA, l’acide sulfurique et AlCl3 sont également utilisés pour la production de cumène.
De nouvelles technologies de production de cumène basées sur des catalyseurs à base de zéolithe ont été développées par diverses sociétés telles que Mobil/Raytheon, UOP, CDTech, Dow/Kellogg et Enichem. Ces procédés impliquent généralement deux réacteurs et une unité de distillation.
Le premier réacteur effectue l’alkylation, tandis que le second réacteur transalkyle les fractions lourdes (tri- et polyisopropylbenzènes) avec du benzène frais.
La zéolite MCM-22 de Mobil, la zéolite exclusive d’UOP dans le procédé QMax, la zéolite mordénite hautement désaluminée de Dow et le catalyseur zéolite BEA d’Enichem sont des exemples de zéolites utilisées dans ces procédés.
De plus, le cumène peut être davantage alkylé avec du propène en utilisant un catalyseur de silicate d’aluminium prétraité en phase liquide sous pression à 150 – 250 °C. Cela conduit à la production principalement de p-diisopropylbenzène et de m-diisopropylbenzène, avec seulement des traces de l’isomère ortho.
Les isomères peuvent être séparés par distillation, et le mélange de m-diisopropylbenzène et d’o-diisopropylbenzène peut être isomérisé pour produire davantage de p-diisopropylbenzène par transalkylation avec du benzène. Les diisopropylbenzènes sont également des intermédiaires importants dans la production d’hydroquinone ou de résorcinol.
2.3. Alkylation du benzène avec des oléfines supérieures
Les monoalkylbenzènes avec 10 à 14 atomes de carbone dans la chaîne alkyle, tels que le dodécylbenzène, jouent un rôle important en tant qu’intermédiaires dans la production d’alkylbenzènesulfonates, largement utilisés dans les produits détergents commerciaux anioniques (tensioactifs).
Jusque vers 1965, l’oléfine primaire utilisée pour cette réaction était le tétramère de propène. Cependant, en raison de préoccupations environnementales liées à la biodégradabilité des détergents à base de tétramère de propène, l’industrie s’est tournée vers les alkylbenzènesulfonates linéaires.
Les oléfines linéaires avec 10 à 14 atomes de carbone sont maintenant utilisées comme matière première pour la production d’alkylbenzènesulfonate. La réaction est généralement catalysée par HF liquide, H2SO4 ou AlCl3, et les conditions de réaction appropriées sont les suivantes :
1. HF : 0 – 10 °C, rapport molaire benzène/alcène de 4 – 10 et 2 – 3 kg d’alcène par kilogramme de HF.
2. H2SO4 : 10 – 30 °C, rapport molaire benzène/alcène de 4 – 5, et 2 volumes d’alcène par volume de 96 – 98 % H2SO4.
3. AlCl3 : 55 – 60 °C, rapport molaire benzène/oléfine de 3 – 4 et 25 moles d’alcène par mole d’AlCl3.
Le procédé HF est considéré comme le plus économique en termes de consommation de catalyseur. Elle est réalisée en phase liquide à pression atmosphérique et 10°C. Une agitation et un refroidissement efficaces sont nécessaires pour contrôler la réaction exothermique et déterminer les temps de réaction.
Le produit est séparé de l’acide dans un décanteur, lavé puis distillé à pression atmosphérique pour récupérer le benzène et à pression réduite pour isoler les alkylbenzènes.
Récemment, certains catalyseurs d’alkylation solides ont été décrits dans la littérature, mais en raison de la baisse de la demande d’alkylbenzènes linéaires (LAB) dans les régions industrialisées, seul le procédé Detal d’UOP a commercialisé une nouvelle technologie utilisant un catalyseur non corrosif pour remplacer le HF. Ce procédé utilise un catalyseur de silice fluorée – alumine et fonctionne en phase liquide à environ 130 °C, obtenant une linéarité et une conversion élevées.
Les propriétés détergentes des alkylbenzènesulfonates sont influencées par le degré de ramification dans la chaîne latérale alkyle, trois à cinq groupes méthyle dans le dodécylbenzène étant optimaux. La position du groupe phényle sur la chaîne alkyle affecte également les propriétés détergentes.
L’alkylation de Friedel – Crafts conduit à un mélange de produits à l’équilibre avec une distribution aléatoire du phényle sur la chaîne alkyle. La composition du produit est influencée par la nature du catalyseur, différents catalyseurs favorisant différents isomères de monoalkylbenzènes.
Les acides de Lewis comme AlCl3 sont capables d’isomériser les phénylalcanes formés, tandis que les acides protoniques isomérisent uniquement les oléfines avant l’alkylation finale du benzène.
2.4. Alkylation du benzène avec des chlorures d’alkyle
Commercialement, l’alkylation du benzène avec des chlorures d’alkyle est une autre méthode utilisée pour produire des alkylates détergents. Le chlorure d’alkyle, issu de la chloration des paraffines, contient environ 70 % de paraffine. Ce mélange est mis à réagir avec un grand excès de benzène dans une tour d’alkylation émaillée, en utilisant AlCl3 comme catalyseur, à 80 °C.
Au cours de la réaction, du chlorure d’hydrogène se forme en quantités stoechiométriques, ce qui assure un mélange intime des réactifs et est séparé en tête de réacteur.
Les produits sont ensuite séparés du catalyseur dans un décanteur, neutralisés, lavés et distillés pour récupérer le benzène et la paraffine qui sont recyclés. Les alkylats sont ensuite purifiés par distillation sous pression réduite.
Un défi avec ce procédé est la formation de quantités considérables de dérivés d’indane et de tétraline en tant que sous-produits en raison de la présence d’impuretés dichloroalcanes dans le chlorure d’alkyle.
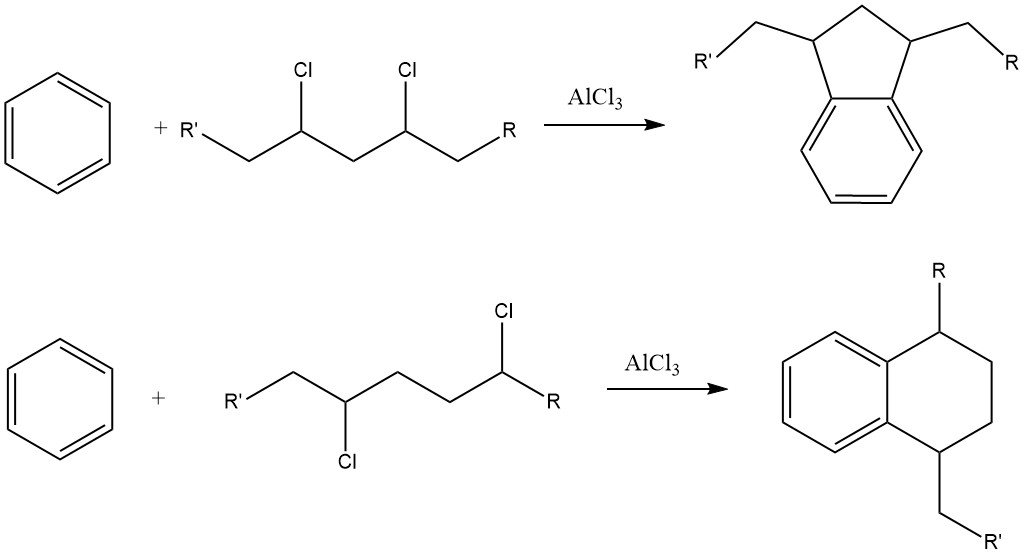
Les alkylbenzènes avec plus de 15 atomes de carbone dans la chaîne latérale conduisent à des alkylbenzènesulfonates qui sont presque insolubles dans l’eau mais très solubles dans les milieux organiques, tels que les huiles minérales.
Ces solutions en huile minérale trouvent leur application dans l’industrie métallurgique comme fluides de forage et de coupe ou dans l’industrie textile comme fluides de filage ou batch. De plus, les alkylbenzènesulfonates de ce type sont de plus en plus utilisés comme agents d’engorgement dans les procédés de récupération assistée du pétrole.
2.5. Alkylations diverses du benzène
Le benzène peut subir une alkylation avec une large gamme de composés, y compris diverses oléfines linéaires, ramifiées, cycliques, aryl- ou autrement substituées, halogénures d’alkyle, alcools, éthers, alcynes et diènes.
Certaines de ces réactions ont été commercialisées avec succès, comme la synthèse de tert-butylbenzène à partir de benzène et d’isobutène. Le tert-butylbenzène trouve une application dans la production de parfums.
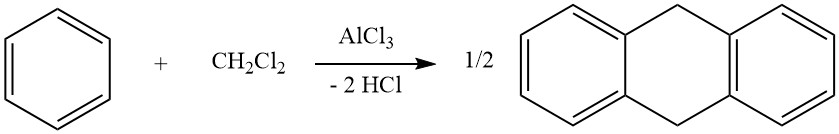
3. Cycloalkylation
Un exemple de cycloalkylations intermoléculaires implique la réaction du dichlorométhane et du benzène, conduisant à la formation de 9,10-dihydroanthracène avec du diphénylméthane. Dans cette réaction, des dérivés d’anthracène sont également produits.
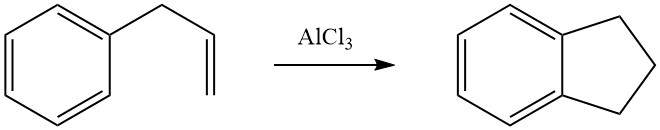
La cycloalkylation intramoléculaire est possible pour les composés aromatiques alkylés qui portent une double liaison ou un groupe fonctionnel, tel qu’un halogène ou un groupe hydroxy, dans leur chaîne latérale. Par exemple, le 3-phényl-1-propène subit une isomérisation en présence d’AlCl3 pour former de l’indane.
BASF a développé une synthèse d’anthraquinone basée sur la cycloalkylation. Cela implique la dimérisation du styrène en phase liquide en 1-méthyl-3-phénylindane, en utilisant l’acide phosphorique comme catalyseur. Le composé résultant est ensuite soumis à une oxydation catalytique en phase vapeur pour produire de l’anthraquinone.
3.1. Arylation des composés aromatiques
L’arylation des composés aromatiques peut être réalisée en utilisant diverses méthodes, y compris la réaction avec des halogénures d’aryle, la réaction avec des halogénures de diazonium et la condensation déshydrogénante.
Les halogénures d’aryle, tels que le fluorobenzène, le chlorobenzène et le bromobenzène, peuvent être utilisés comme agents d’arylation dans les arylations de Friedel-Crafts. Cependant, leur réactivité est relativement faible, le fluorobenzène étant le plus réactif suivi du chlorobenzène et du bromobenzène.
L’arylation avec le fluorobenzène peut donner des biphényles comme produits, tandis que la décomposition des tétrafluoroborates d’aryldiazonium dans des solvants aromatiques peut conduire à des produits arylés sur le cycle avec le fluorobenzène.
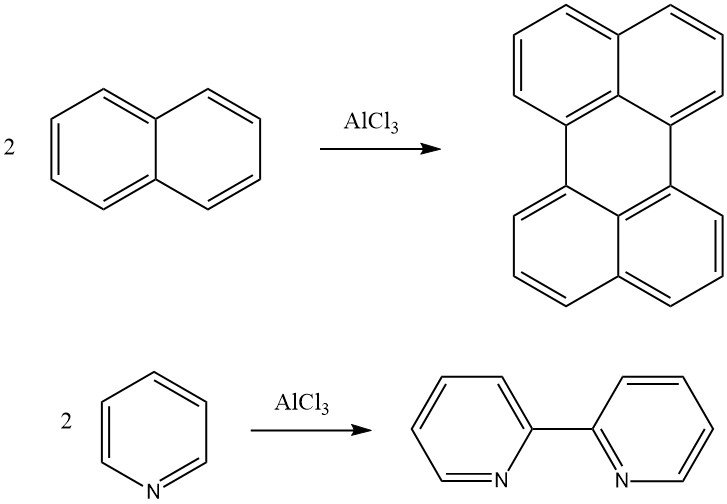
La réaction de Scholl est une condensation déshydrogénante d’un composé aromatique en présence de catalyseurs de Friedel-Crafts. Par exemple, le naphtalène peut être converti en pérylène et la pyridine peut être convertie en 2,2′-dipyridyle par cette réaction. Des composés aromatiques polycondensés de haut poids moléculaire peuvent également être formés en utilisant la réaction de Scholl.
4. Alkylation des benzènes substitués
L’alkylation du benzène conduit généralement à un mélange de composés monoalkylés, dialkylés et polysubstitués. La réactivité et l’orientation dans la deuxième étape de substitution dépendent des propriétés électroniques et stériques du premier substituant et de la taille de l’agent alkylant.
Les benzènes dialkylés ont une importance commerciale significative. Par exemple, les diéthylbenzènes sont utilisés pour améliorer les indices d’octane des carburants et sont obtenus comme sous-produits dans la production d’éthylbenzène.
Les dialkylbenzènes peuvent être déshydrogénés pour produire des divinylbenzènes, qui sont cruciaux pour la réticulation des polyoléfines comme le polystyrène dans la fabrication de résines échangeuses d’ions.
L’éthylméthylbenzène, formé par l’éthylation du toluène, est industriellement précieux comme matière de départ pour les styrènes qui ont des substitutions méthyle dans le cycle aromatique. Un autre exemple est la production de diisopropylbenzène par réaction de propène avec du cumène (alkylation du benzène avec du propène).
4.1. L’alkylation du toluène avec du propène
Le processus industriel d’alkylation du toluène avec du propène pour produire du cymène est réalisé par des sociétés comme Sumitomo Chemicals. Le mélange de cymène résultant est principalement constitué d’isomères méta et para, qui est ensuite soumis à une oxydation pour donner de l’acétone et des crésols.
Ces crésols comprennent environ 39,5 % de méta et para-crésols et 36 % de méta-crésol et servent de matières premières essentielles pour les résines phénoliques et les plastifiants.
Un autre aspect important implique la production de benzènes polyméthylés par des procédés tels que la dismutation du toluène ou la méthylation du benzène ou du toluène. Ces benzènes polyméthylés peuvent subir une oxydation pour former les acides correspondants, qui trouvent des applications dans divers polymères tels que les polyesters, les polyamides et les polyimides.
4.2. Alkylation de composés aromatiques supérieurs
L’alkylation de composés aromatiques supérieurs, tels que le biphényle, l’indane, la tétraline et les composés aromatiques polynucléaires tels que le naphtalène, l’acénaphtène, l’anthracène, le fluorène et le phénanthrène, a été documentée.
Par exemple, l’alkylation du naphtalène avec des oléfines supérieures est employée commercialement pour produire des agents fluorescents utilisés dans les huiles lubrifiantes. Cette réaction en phase liquide utilise AlCl3 comme catalyseur à des températures allant jusqu’à 180 °C.
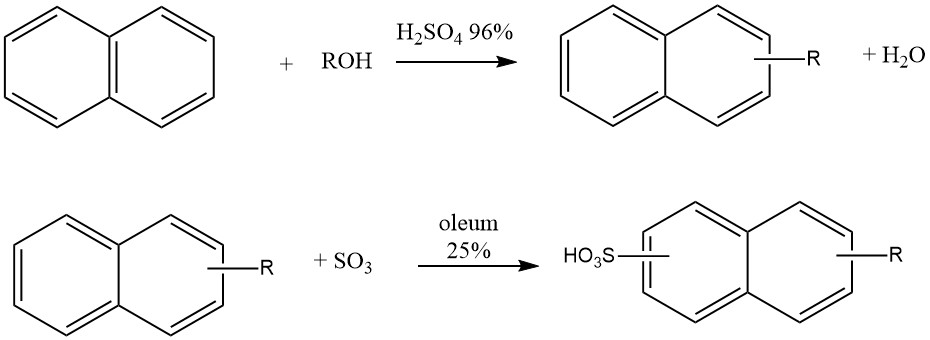
Une autre application industrielle de l’alkylation du naphtalène est la production de détergents de type « Nekal » (BASF), qui sont des alkylnaphtalènesulfonates. Ces composés ont été parmi les premiers détergents synthétiques et continuent d’être utilisés comme tensioactifs dans l’industrie textile.
La synthèse de ces alkylnaphtalènesulfonates implique un processus en un seul pot où le naphtalène réagit avec le butanol, l’hexanol ou des mélanges de propanol-butanol en présence d’acide sulfurique à 96% à 50 ° C. Après alkylation, 25% d’oléum est ajouté pour la sulfonation.
De plus, le procédé Hock implique l’oxydation du 2-isopropylnaphtalène, résultant en 2-naphtol. Pour obtenir du 2-isopropylnaphtalène, une réaction entre le naphtalène et le propène en utilisant du ZnCl2 ou des silicates d’aluminium comme catalyseurs à 150 – 200 °C peut être effectuée, produisant également de petites quantités de l’isomère 1-isopropyle.
De plus, les 2,6-dialkylnaphtalènes ont suscité un intérêt considérable en raison de leur conversion en acide 2,6-naphtalènedicarboxylique, utilisé dans la production de plastique haute performance poly(éthylène-2,6-naphtalène dicarboxylate) (polyéthylènenaphténate, PEN).
Divers catalyseurs sélectifs de forme, y compris la mordénite, ont été étudiés pour alkyler les naphtalènes. Alternativement, Amoco a commercialisé une autre route en 1995 avec une capacité d’environ 40 000 t/a. Ils alkylent l’o-xylène avec du butadiène sur un catalyseur fortement basique, donnant de l’o-tolylpentène, qui subit ensuite une cyclisation, une déshydrogénation et une isomérisation.
5. Alkylation des phénols
L’alkylation des phénols est une réaction industrielle très importante, aboutissant à la production d’alkylphénols largement utilisés dans diverses applications, telles que les antioxydants, les herbicides, les insecticides et les polymères.
En raison de la densité électronique accrue dans le cycle aromatique associé au groupe hydroxyle nucléophile, l’alkylation se produit dans des conditions plus douces par rapport aux hydrocarbures aromatiques.
Divers facteurs, y compris les conditions de réaction, les catalyseurs et les agents alkylants, influencent la formation de phénols principalement ortho- ou para-monoalkylés, 2,4- ou 2,6-dialkylés et 2,4,6-trialkylés.
Des températures plus élevées conduisent à des isomères méta thermodynamiquement plus stables en raison de réactions secondaires. De plus, des températures et des concentrations de catalyseur basses peuvent produire des quantités importantes d’éthers d’alkylaryle, tandis que des températures, des concentrations de catalyseur et une force d’acide plus élevées favorisent la formation prédominante d’alkylphénols.
Des agents d’alkylation tels que les oléfines, les alcools et les halogénures d’alkyle sont utilisés dans le processus d’alkylation. Trois grands types de procédés industriels d’alkylation des phénols ont été développés :
1. L’alkylation en phase liquide consiste à ajouter l’agent alkylant à une solution ou une suspension du catalyseur dans le phénol. Après la réaction, le catalyseur est séparé et tout catalyseur résiduel est décomposé par neutralisation.
2. Les procédés en phase liquide à lit fixe fonctionnent avec les réactifs passant sur le catalyseur dans des réacteurs tubulaires à des pressions élevées, qui sont refroidis de l’extérieur.
3. L’alkylation en phase vapeur consiste à envoyer le phénol et l’agent alkylant, tel que le méthanol ou une oléfine, dans un réacteur à lit fixe fonctionnant à 300 – 400 °C, avec une évacuation efficace de la chaleur de réaction.
La récupération du produit implique une distillation, les phénols non convertis et les agents alkylants étant recyclés, et divers phénols mono-, di- et trialkylés séparés. L’élimination complète des traces de catalyseur acide est cruciale pour éviter les réactions secondaires pendant la distillation, telles que l’isomérisation, la transalkylation et la dismutation.
Les procédés en phase liquide utilisent des catalyseurs acides de Lewis comme AlCl3, BF3 ou Al(C6H5O)3, des acides protoniques comme HF, H2SO4, H3PO4 ou l’acide p-tolylsulfonique, ou des résines échangeuses d’ions acides, comme les résines Nafion ou les polystyrènes sulfonés.
Les procédés en phase vapeur nécessitent des catalyseurs à haute stabilité thermique, tels que les montmorillonites, les zéolithes telles que la faujasite et les oxydes métalliques tels que γ-Al2O3, MgO, CaO et Fe2O3 – CrO3.
La régiosélectivité peut être contrôlée à l’aide de différents catalyseurs. Par exemple, HF, BF3, Al2O3•SiO2 ou des résines échangeuses d’ions acides favorisent principalement les produits p-substitués lors de l’alkylation des phénols avec des oléfines.
En revanche, Al(C6H5O)3, formé à partir de phénol et d’aluminium métallique, notamment en présence de traces de sels de mercure, conduit presque exclusivement à des produits 2-alkylés et 2,6-dialkylés. Cette sélectivité pour l’ortho alkylation est attribuée à un état de transition à six chaînons impliquant le phénolate d’aluminium et une oléfine.
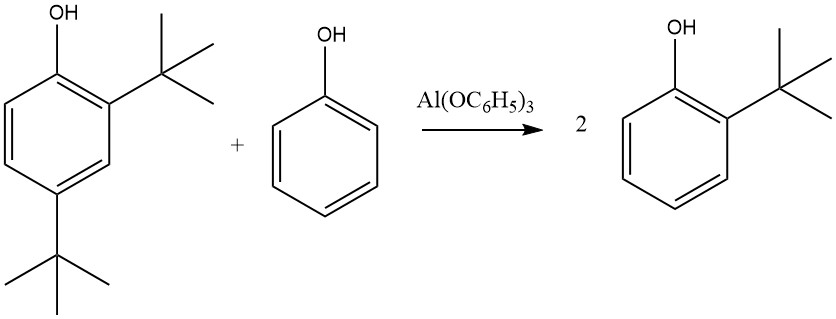
D’autres sels métalliques de phénol, y compris ceux de zinc, de magnésium et de calcium, peuvent également activer cette réaction, qui n’est pas limitée au phénol ; Le 2-naphtol, le 2-crésol ou le 4-crésol peuvent également être alkylés par l’éthylène, le propène, les butènes, le cyclohexène ou d’autres oléfines, avec une réactivité variable, où l’isobutène présente la réactivité la plus élevée et l’éthylène la plus faible.
En présence de γ-Al2O3 comme catalyseur, une sélectivité élevée pour les o-phénols monoalkylés peut être atteinte. Ce procédé fonctionne à des températures élevées de 200 à 350 °C en phase liquide à des pressions de 20 à 200 bars et convient à un fonctionnement continu en lit fixe.
En ce qui concerne les produits alkylphénols, les alkylphénols sont souvent produits dans des opérations discontinues, offrant une plus grande flexibilité. Cependant, pour les composés produits en grande quantité, tels que les crésols, le 2,6-xylénol, le 2-sec-butylphénol, le 4-tert-butylphénol, l’octylphénol, le nonylphénol, le dodécylphénol, le thymol ou le 2,6-di-tert-butyl-4-méthylphénol, des procédés continus avec des capacités allant jusqu’à 25 000 t/a chacun ont été mis en place.
5.1. Alkylation du phénol avec du méthanol
L’alkylation du phénol avec du méthanol à des températures élevées et avec un catalyseur donne principalement du 2-crésol (60 à 70 % à 50 % de conversion du phénol et à 300 °C) et du 2,6-xylénol, accompagnés de quantités mineures de 4-crésols, 2,4- et 2,3-xylénols et une petite quantité de 3-crésol.
La réaction peut être conduite en phase liquide ou vapeur. Dans les procédés en phase vapeur, les réactifs sont introduits à pression atmosphérique ou légèrement élevée dans un réacteur tubulaire avec un catalyseur à lit fixe à des températures allant de 300 à 450 °C.
L’utilisation d’Al2O3 activé à 300 °C, et de MgO et CeO2 à 540 et 450 °C, respectivement, donne une sélectivité élevée pour le 2-crésol et le 2,6-xylénol. Cependant, l’utilisation de catalyseurs très acides comme l’oxyde d’aluminium, les silicates d’aluminium, les zéolithes et le phosphate d’aluminium, en particulier à des températures plus élevées, conduit à une transalkylation-isomérisation, entraînant une production accrue de 3-crésol et de 4-crésol.
Les procédés en phase liquide utilisent des catalyseurs tels que Al2O3, Al(OMe)3, Al(OC6H5)3 ou ZnCl2 – HCl à des pressions élevées. Dans tous les cas, le rapport xylénol/crésol augmente avec le rapport méthanol/phénol, la température et la pression.
5.2. Alkylation des phénols avec des oléfines
L’alkylation du phénol avec le méthanol est effectuée à des températures élevées, généralement entre 320 et 340 °C, en présence de 1 à 2 % d’Al(C6H5O)3 et à 200 bars, ce qui entraîne la formation de 2-éthylphénol.
D’autre part, l’alkylation du phénol avec du propène pour produire du 2-isopropylphénol peut être réalisée à des températures inférieures de 280 à 300 °C en utilisant γ-Al2O3 comme catalyseur.
De plus, la propylation des crésols pour produire du thymol ou du carvacol est effectuée dans des procédés continus en phase liquide utilisant du γ-Al2O3, des silicates d’aluminium ou des zéolithes. Dans des conditions similaires, le 2-sec-butylphénol peut être produit à partir de phénol et de n-butènes.
La production de 2-tert-butylphénol et de 2,6-di-tert-butylphénol peut être réalisée à 100 °C sous des pressions allant jusqu’à 20 bar en présence d’Al(C6H5O)3, en exploitant la haute réactivité de l’isobutène.
En variante, le 4-tert-butylphénol peut être préparé à pression atmosphérique et à des températures allant de 80 à 140 °C en utilisant H2SO4, H3PO4, BF3 ou de préférence des résines échangeuses de cations acides.
L’important antioxydant 2,6-di-tert-butyl-4-méthylphénol est produit à partir de 4-crésol et d’isobutène à 70 °C en utilisant H2SO4 comme catalyseur. De même, l’alkylation du phénol avec des 2-méthylbutènes à 100 – 120 °C en présence de BF3 ou de H3PO4 donne du 4-tert-amylphénol, et avec un excès de 2-méthylbutènes, du 2,4-di-tert-amylphénol est formé.
Un processus commercial important implique l’alkylation du phénol avec des oléfines linéaires ou ramifiées contenant de 6 à 20 atomes de carbone, conduisant à des alkylphénols qui, après éthoxylation et sulfatation, trouvent une large application en tant que détergents anioniques.
Le diisobutène, le tripropène et le tétrapropène sont les agents alkylants préférés, et la réaction est catalysée dans des conditions douces (50 à 85 ° C) en utilisant du BF3 dans des réacteurs discontinus ou tubulaires. Les résines échangeuses de cations acides, telles que le polystyrène sulfoné macroréticulaire, sont également d’excellents catalyseurs qui facilitent la séparation du catalyseur.
Pour obtenir un meilleur contrôle de la température, la réaction peut être effectuée en deux étapes, en utilisant un catalyseur d’acidité réduite dans la première étape. Chemische Werke H€uls (aujourd’hui Degussa-H€uls) en Allemagne utilise un procédé de ce type pour produire du nonylphénol.
Dans la première étape de ce procédé à lit fixe, la température augmente de 80 à 120 °C, et dans la deuxième étape, elle monte de 110 à 130 °C. Les silicates d’aluminium activés peuvent également servir de catalyseurs, mais ils nécessitent des températures de réaction plus élevées et des temps de réaction plus longs.
La production industrielle d’alkylphénols, d’haloalkylphénols et de composés apparentés est importante et ces composés sont largement utilisés comme inhibiteurs d’oxydation, détergents, bactéricides, fongicides, insecticides et désinfectants.
6. Alkylation des amines aromatiques
En raison de la basicité des amines aromatiques, les catalyseurs acides ne sont pas bien adaptés à leur alkylation. Par exemple, l’utilisation du catalyseur Friedel – Crafts AlCl3 dans la réaction de l’éthylène avec l’aniline donne principalement des produits résineux non identifiés avec seulement de petites quantités de 2-éthylaniline.
Cependant, l’anilide d’aluminium, Al(C6H5NH)3, formé in situ par chauffage de poudre d’aluminium dans l’aniline avec dégagement d’hydrogène, s’avère être un catalyseur efficace pour cette réaction. Dans des conditions de 300 à 340 °C et 200 bars, la 2,6-diéthylaniline est obtenue après 2 à 3 heures, tandis que des temps de réaction plus courts conduisent à la formation de 2-éthylaniline.
L’activité catalytique de l’anilide d’aluminium est encore renforcée par l’ajout de catalyseurs Friedel – Crafts tels que AlCl3, SnCl4, TiCl4, SiCl4, BF3 ou ZnCl2. Les mélanges de métaux alcalins et d’AlCl3 dans l’aniline présentent également une activité, conduisant sélectivement à la N-alkylation.
Cette réaction a été étendue à diverses anilines substituées, notamment la 2-, 3- et 4-toluidine, la 2,6-, 2,4- et 2,5-xylidine, la 2-propylaniline, la 2- et 3-chloroaniline et l’α-naphtylamine. De plus, des diamines telles que la m-phénylènediamine ou la 2,4-toluylènediamine, ainsi que des amines secondaires comme la diphénylamine, peuvent également subir une alkylation.
Dans le processus d’alkylation avec des oléfines, la réactivité diminue dans l’ordre éthylène > propène > 1-butène > isobutène, ce qui est opposé à l’ordre de réactivité observé dans l’alkylation du phénol avec le catalyseur Al(OC6H5)3.
Notamment, l’isobutène démontre une activité avec les catalyseurs Friedel – Crafts tels que AlCl3, BF3 ou la montmorillonite même à 200 – 250 ° C, mais avec l’anilide d’aluminium, la réaction se déroule lentement. Lorsque la montmorillonite est utilisée, une formation sélective de 4-tert-butylaniline se produit, tandis que les catalyseurs BF3 ou AlCl3 donnent des mélanges des isomères 2 et 4.
Dans l’alkylation des anilines avec du méthanol, les tamis moléculaires agissent comme catalyseurs, ce qui donne un mélange complexe contenant de la 2-toluidine, de la 2,6- et de la 2,4-xylidine et de la 2,4,6-triméthylaniline. Industriellement, les 2,6-dialkylanilines, telles que la 2-éthyl-6-méthylaniline, sont produites comme intermédiaires pour les herbicides et les colorants.
7. Alkylation des composés hétéroaromatiques et des substrats associés
Divers composés aromatiques hétérocycliques, y compris les furanes, les thiophènes et les N-hétérocycles, peuvent être soumis à des réactions d’alkylation, bien que des informations limitées soient disponibles sur leurs applications commerciales.
Les dérivés de cyclopentadiényle subissent également une alkylation Friedel – Crafts d’une manière similaire à d’autres composés aromatiques.
7.1. Furane
Le furane présente une réactivité plus élevée dans les alkylations Friedel – Crafts par rapport au benzène. Cependant, les furanes ont tendance à subir une résinification rapide en présence d’acides, ce qui peut compliquer la séparation des produits.
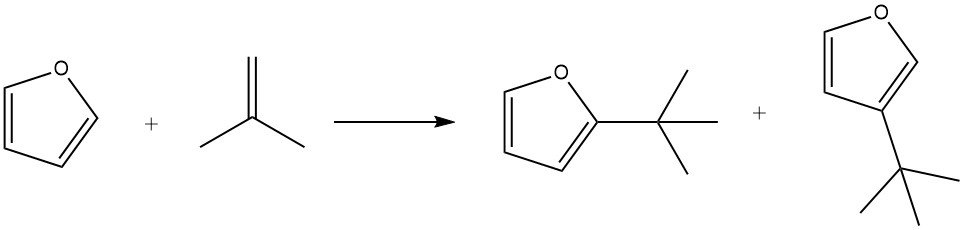
En utilisant de l’acide phosphorique sur le kieselguhr comme catalyseur, le furane peut être efficacement alkylé avec de l’isobutène à 100 ° C en 3 heures, ce qui donne un rendement de 85% des alkylats, ainsi que des quantités mineures d’isooctène.
Dans des conditions douces (par exemple, 50 ° C pendant 1 heure), la substitution en position 2 est favorisée. Cependant, des temps de réaction plus longs (7 heures), des températures plus élevées (150 ° C) et des concentrations de catalyseur plus élevées favorisent la formation de produits substitués en position 3. De plus, la formation de 2,5-di-tert-butylfurane a également été observée au cours du procédé.
7.2. Thiophène
Le thiophène présente une réactivité significativement plus élevée dans les réactions de Friedel – Crafts par rapport aux hydrocarbures aromatiques, permettant son alkylation avec diverses oléfines, notamment le propène, le 1-butène, les 2-méthylbutènes, le cyclohexène et des alcools comme l’alcool isopropylique et l’alcool tert-butylique.
Des résultats positifs ont été obtenus en utilisant des catalyseurs acides tels que l’acide phosphorique à 60 °C ou la silice alumine à 200 °C. Cependant, l’utilisation de H2SO4, HF, BF3•OMe2 et AlCl3 a entraîné des réactions secondaires. Dans tous les cas, le thiophène a été substitué en position 2, et des produits à point d’ébullition plus élevé, tels que des composés dialkylés, ont également été produits.
De plus, l’élimination du thiophène de l’essence de craquage lors du raffinage avec de l’acide sulfurique concentré à froid est probablement une réaction d’alkylation. Les oléfines présentes dans l’essence agissent comme des agents alkylants, conduisant à la formation d’alkylthiophènes à point d’ébullition élevé, qui restent sous forme de résidu lors de la distillation.
7.3. N-hétérocycles
Les N-hétérocycles peuvent subir une alkylation en présence d’amides d’aluminium comme catalyseurs. Alors que les composés hétérocycliques comme le carbazole et l’indole réagissent lentement avec l’aluminium métallique pour former l’amide, l’anilide d’aluminium sert de catalyseur efficace.
Par exemple, lorsque le carbazole réagit avec l’éthylène en présence d’aniline et de poudre d’aluminium, il produit du 1-éthylcarbazole. Cette réaction se produit dans un autoclave à 280 °C et 200 bar.
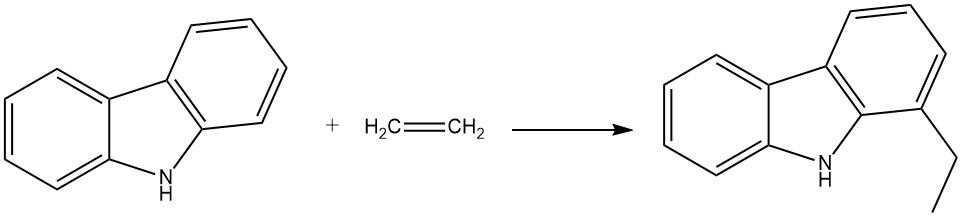
Le propène peut également réagir dans des conditions similaires pour donner du 1-isopropylcarbazole, bien qu’avec un rendement légèrement inférieur.
La combinaison de carbazole et de propène avec AlCl3 comme catalyseur à 90 – 100 °C entraîne la formation de diisopropylcarbazole. Une autre réaction sur un catalyseur de silicate d’aluminium à 180 – 200 ° C donne du tétra- et du pentaisopropylcarbazole. De plus, l’éthylation du pyrrole peut être obtenue à l’aide d’un catalyseur de silicate d’aluminium à 200 – 370 °C.
7.4. Composés aromatiques non benzénoïdes
Les composés aromatiques non benzénoïdes, tels que les ferrocènes, les fulvènes, les azulènes, les pseudoazulènes, les indolizines et les cyclazines, partagent des similitudes chimiques non seulement avec les systèmes benzénoïdes mais aussi avec les oléfines.
Leurs réactions de substitution électrophiles se produisent généralement dans des conditions plus douces par rapport aux dérivés du benzène. Cependant, en raison de leur stabilité relativement faible, une sélection rigoureuse des catalyseurs et des conditions de réaction est essentielle.
Le ferrocène peut subir une alkylation en présence d’acides de Lewis, tels que AlCl3, avec divers substrats, notamment le méthanol, les halogénures d’éthyle, d’isopropyle, de butyle et de benzyle, le 1,2-dichloroéthane, l’éthylène, le propène et l’isobutène.
La réaction conduit souvent à des mélanges complexes de produits homoannulaires et hétéroannulaires (où les deux cycles sont alkylés), car le système devient plus réactif après la première étape d’alkylation.
L’alkylation du ferrocène avec des oléfines semble être plus favorable, comme la réaction avec l’isobutène, qui se produit même à température ambiante. À des températures plus élevées (100 à 150 ° C), le tri-tert-butylferrocène hétéroannulaire est obtenu avec un rendement de 44%, ainsi que du tétra-tert-butylferrocène. L’encombrement stérique empêche la fixation de plus de deux substituants tert-butyle au même cycle cyclopentadiényle.
8. Diverses réactions d’alkylation
L’alkylation de composés aromatiques à l’aide de réactifs bi- ou polyfonctionnels entraîne la formation d’une gamme variée de produits mono-, di- ou polynucléaires précieux avec des applications commerciales importantes.
8.1. Haloalkylations
Dans des conditions de réaction appropriées, les haloalkylations de composés aromatiques avec des agents d’alkylation bi- ou polyfonctionnels peuvent produire des produits d’haloalkylation primaires tout en évitant une cycloalkylation indésirable ou une liaison de plusieurs noyaux.
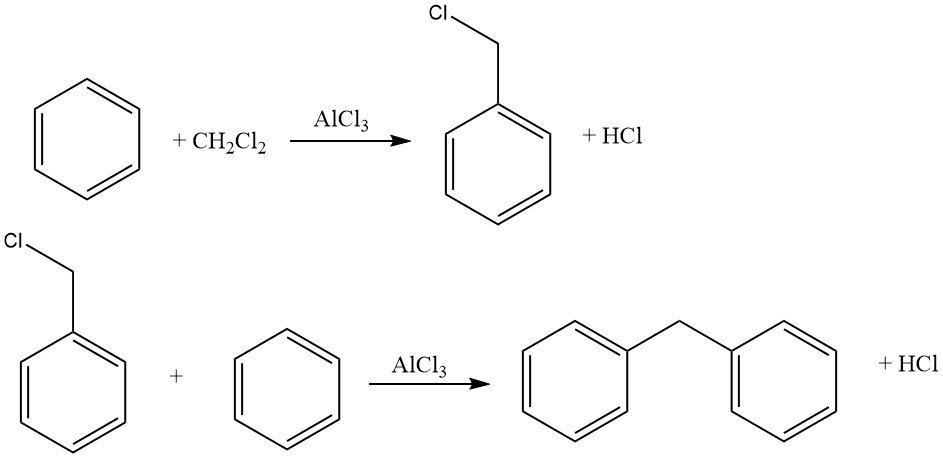
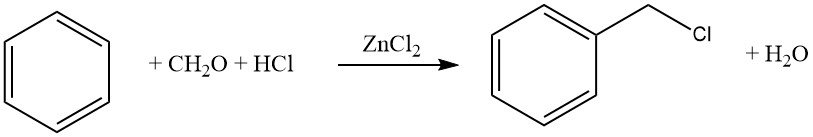
Les agents d’haloalkylation courants comprennent l’aldéhyde-halogénure d’hydrogène, les éthers haloalkyliques, les haloalcools et des composés similaires. Ce procédé permet l’halométhylation, l’haloéthylation, l’haloalkylation supérieure, ainsi que la bis- et la polyalkylation.
La réaction est souvent catalysée par le chlorure de zinc, mais d’autres catalyseurs tels que les halogénures acides (par exemple, ZnCl2 – AlCl3, SnCl4, AlCl3 – cétones, AlCl3 – pyridine) ou les acides protoniques (HCl, H2SO4, H3PO4, acide p-toluènesulfonique) peuvent également être utilisés.
Un exemple courant de cette réaction est la chlorométhylation à l’aide de formaldéhyde-HCl (réaction de Blanc). Bien que cette réaction soit synthétiquement intéressante, il faut faire preuve de prudence en raison de la formation d’intermédiaires réactifs, en particulier d’éthers chlorométhyliques, qui sont hautement cancérigènes.
8.2. Hydroxyalkylation
L’hydroxyalkylation de composés aromatiques à l’aide d’aldéhydes et de cétones en présence d’acides revêt une importance industrielle significative. Les électrophiles attaquant le noyau aromatique sont formés par la réaction d’aldéhydes ou de cétones avec des acides de Lewis ou protoniques (où R, R0 = H, alkyle, aryle).
La réaction aboutit à la formation d’un alcool benzylique substitué. Dans des conditions acides, cet alcool réagit avec une autre molécule du composé aromatique pour produire un diarylméthane substitué.
Un exemple notable de cette réaction est l’hydroxyalkylation du phénol avec l’acétone, donnant du 2,2-bis-(4-hydroxyphényl)propane, communément appelé bisphénol A. Ce composé est produit industriellement dans des procédés continus utilisant H2SO4 (ou HCl sec dans le procédé Hooker) comme catalyseur et le méthylmercaptan comme promoteur, ce qui donne des rendements presque quantitatifs à 50 °C.
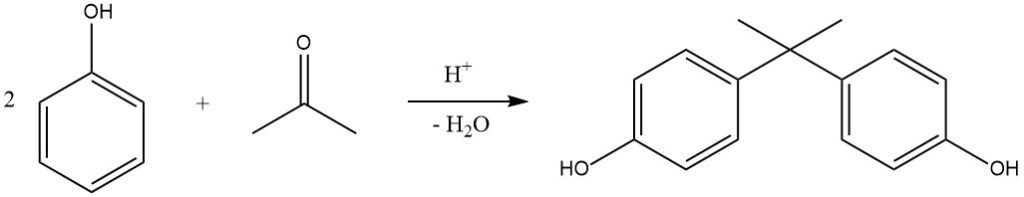
Les résines échangeuses de cations sont également de plus en plus utilisées comme catalyseurs en raison de leur processus de séparation simplifié. Le bisphénol A est principalement utilisé pour la production de résines époxy et polycarbonate.
Les hydroxyalkylations sont très polyvalentes, permettant à de nombreux aldéhydes et cétones substitués par des alkyles et des aryles de réagir avec divers composés aromatiques. Par exemple, l’insecticide DDT est produit à partir de chloral et de chlorobenzène.
La réaction du phénol avec le formaldéhyde conduit à des hydroxyméthylphénols, qui peuvent se condenser davantage pour former des résines phénoliques à des températures élevées.
Lorsque des oxiranes (époxydes) sont utilisés comme agents alkylants, des composés aromatiques β-hydroxyalkylés sont obtenus. Par exemple, la réaction du benzène avec l’oxyde d’éthylène en présence d’une quantité stoechiométrique d’AlCl3 conduit à un alcoolate d’aluminium qui, lors de l’hydrolyse, donne du β-phényléthanol.
8.3. Amidométhylation
L’amidométhylation, également connue sous le nom de réaction de Tscherniac-Einhorn, est un processus dans lequel les N-hydroxyméthylamides ou les imides correspondants réagissent avec des composés aromatiques dans des conditions douces en présence d’acide sulfurique. Cette réaction permet l’introduction d’un groupe amidométhyle dans le noyau aromatique.
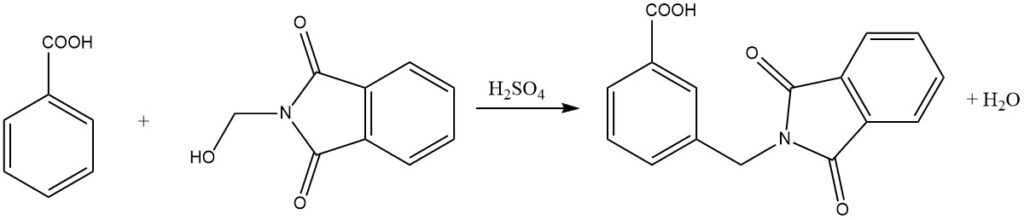
De plus, des composés aromatiques moins réactifs, tels que les acides benzoïques, peuvent également subir une amidoalkylation par ce processus. Remarquablement, même les composés aromatiques nitro-substitués peuvent être alkylés en utilisant des amides d’acide N-chlorométhylcarboxylique en présence d’AlCl3 comme catalyseur.
Référence
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
FAQ
L’alkylation de Friedel-Crafts est une réaction chimique utilisée pour introduire des groupes alkyle (tels que méthyle, éthyle, etc.) sur un cycle aromatique. Cela implique la substitution d’un atome d’hydrogène sur le cycle aromatique par un groupe alkyle, entraînant la formation de composés alkylaromatiques.
Friedel-Crafts Alkylation a diverses applications industrielles. Les composés alkylaromatiques produits par cette réaction sont utilisés comme matières premières dans la synthèse de colorants, de produits pharmaceutiques, de parfums et de produits agrochimiques. De plus, ils servent d’intermédiaires dans la production de polymères et d’autres composés organiques.
Outre le benzène, d’autres composés aromatiques tels que le naphtalène, le toluène, le phénol, l’aniline et divers composés aromatiques hétérocycliques tels que les furanes et les thiophènes peuvent subir des réactions d’alkylation. Les conditions et réactifs spécifiques peuvent varier en fonction de la nature du composé aromatique et de la substitution alkyle souhaitée.
Oui, Friedel-Crafts Alkylation a des limites et des défis. Une limitation majeure est la possibilité de suralkylation, qui peut conduire à des produits polyalkylés. L’encombrement stérique dans certains composés aromatiques peut également entraver la réaction. De plus, certains agents alkylants et catalyseurs acides de Lewis peuvent être sensibles à l’humidité et à l’air, nécessitant une manipulation et des conditions de réaction soigneuses.
Bien que l’alkylation de Friedel-Crafts soit un outil utile pour l’introduction de groupes alkyle sur des cycles aromatiques, elle peut ne pas toujours convenir à la synthèse de molécules hautement complexes en raison du potentiel de produits de substitution multiples. Dans de tels cas, des méthodes plus sélectives ou contrôlées peuvent être nécessaires pour obtenir la synthèse souhaitée.
