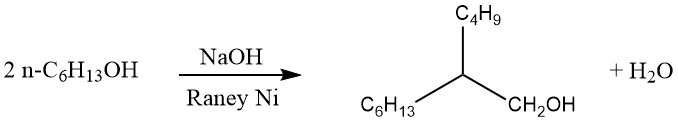
1. De Friedel-Crafts-alkylering
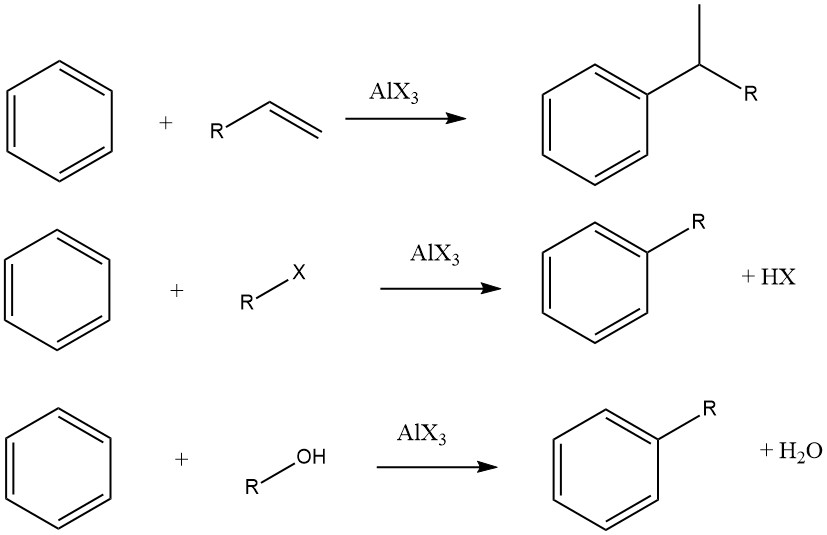
De Friedel-Crafts-alkylering van aromatische verbindingen omvat een zuurgekatalyseerde elektrofiele substitutie, waarbij een alkylgroep een aromatische waterstof vervangt. Een breed scala aan alkyleringsmiddelen, zoals olefinen, alkylhalogeniden en alcoholen, wordt hiervoor vaak gebruikt.
Deze reactie kan worden toegepast op verschillende aromatische substraten, waaronder heteroaromatische verbindingen en zelfs verbindingen zoals ferroceen. Deze reacties zijn doorgaans snel en exotherm en worden vaak uitgevoerd onder milde omstandigheden in de vloeibare fase.
In sommige gevallen worden echter dampfaseprocessen met strengere omstandigheden gebruikt voor bepaalde substraten. Wanneer olefinen, alkylhalogeniden en alcoholen worden gebruikt als alkyleringsmiddelen, verlopen de algehele reacties als volgt:
Inhoudsopgave
De mate van isomerisatie van de alkylgroep en de naleving van de Markovnikov-regel tijdens het additieproces variëren afhankelijk van de zuurgraad van de katalysator.
1.1. Katalysatoren voor Friedel-Crafts-alkylering
Katalysatoren die worden gebruikt in het Friedel-Crafts-alkyleringsproces zijn zuur en hun effectiviteit hangt af van verschillende factoren, waaronder reactieomstandigheden, alkyleringsmiddelen en aromatische substraten. Zowel Lewis-zuren als Brønsted-zuren kunnen als actieve katalysatoren fungeren en veelgebruikte katalysatoren worden geclassificeerd op basis van hun chemische structuren.
| Groep | Voorbeelden | Type zuur |
|---|---|---|
| Zure haliden | AlCl3, AlBr3, SnCl4, SbCl5, FeCl3 | Lewiszuren |
| Metaalalkylen en alkoxiden | AlR3, BR3, ZnR2, Al(OPh)3 | Lewis zuren |
| Protonzuren | HCl, HCl – AlCl3, H2SO4, HF, H3PO4 | Brønstedzuur |
| Zure oxiden en derivaten | zeolieten, gemengde oxiden en vaste superzuren, kleisoorten, heteropolyzuren | Brønsted/Lewiszuur |
| Ondersteunde zuren | H3PO4 – SiO2, BF3 – Al2O3 | Brønsted/Lewis-zuur |
| Kationenuitwisselingsharsen | Permutit Q, Amberlite IR 112, Dowex 50, Nafion – silica, Deloxan | Brønsted-zuur |
Traditioneel worden zure haliden zoals AlCl3 of AlBr3 en protonzuren zoals HCl, HF of H2SO4, ondersteund op diatomeeënaarde, op grote schaal gebruikt. Er vindt echter een verschuiving plaats naar het vervangen van deze katalysatoren door zeolieten en anorganische oxiden vanwege hun milieuvriendelijkheid, gebruiksgemak en lagere kostenimplicaties voor procesontwerp.
De aanwezigheid van basen, met name organische stikstofverbindingen, vermindert de zuurgraad en efficiëntie van de katalysator. Zuurstof, zelfs bij concentraties zo laag als 20 ppm, kan leiden tot de vorming van zware harsachtige materialen op de katalysator. Diënen zoals butadieen in een buteenvoeding dragen ook bij aan de productie van harsachtige of teerachtige stoffen op de katalysator.
Interessant genoeg kunnen sporen van vocht of andere protonleveranciers de katalytische activiteit verbeteren, met name voor Lewis-zuren. Hogere hoeveelheden van deze verbindingen zijn echter schadelijk voor de prestaties van de katalysator.
In sommige gevallen worden milde katalysatorvergiften, zoals organische nitroverbindingen, opzettelijk gebruikt om de zuurgraad van de katalysator te verlagen en nevenreacties zoals isomerisatie te voorkomen. Deze organische nitroverbindingen vormen stoichiometrische complexen met Lewis-zuren, wat resulteert in schonere alkyleringsprocessen met matige opbrengsten.
Bovendien werken bepaalde adducten zoals BF3·OEt2 of BF3·C6H5OH als milde Friedel-Crafts-katalysatoren. Onzuiverheden in katalysatoren, zoals de aanwezigheid van ferrichloride in aluminiumchloride, kunnen de productopbrengst aanzienlijk verlagen en het verloop van de reactie die wordt gekatalyseerd door Lewis-zuren beïnvloeden.
1.2. Isomerisatie van de alkylerende middelen
Vanwege de zure aard van de reactieomstandigheden bij Friedel-Crafts-alkylering ondergaan alkylerende reagentia vaak herrangschikkingen en worden ze vaak getransformeerd in het meest vertakte isomeer dat mogelijk is. Dit wordt aangetoond in reacties van benzeen met propylchloride, waarbij isopropylbenzeen het hoofdproduct is, en met n-butylchloride, wat leidt tot de vorming van sec-butylbenzeen.
In deze gevallen wordt de isomerisatie van het alkyleringsmiddel geïnitieerd door de migratie van een waterstofatoom in plaats van directe koolstofherschikkingen. De drijvende kracht achter deze isomerisatie is de vorming van het meest stabiele carbocation, volgens de gebruikelijke trend: primair < secundair < tertiair.
Wanneer benzeen bijvoorbeeld wordt gealkyleerd met lineaire 1-olefinen met lange ketens, leidt de reactie niet alleen tot de vorming van 2-alkylbenzeen, maar in de meeste gevallen ook tot een willekeurige verdeling van de fenylsubstituent langs de alkylketen.
Dit effect kan ook worden toegeschreven aan de isomerisatie van de gealkyleerde reactieproducten, aangezien n-butylbenzeen wordt omgezet in sec-butylbenzeen in aanwezigheid van een Friedel-Crafts-katalysator zoals AlCl3.
Onder bepaalde reactieomstandigheden kan het alkyleren van benzeen met tertiaire alkylhalogeniden resulteren in de vorming van secundaire alkylbenzenen in plaats van tertiaire alkylbenzenen.
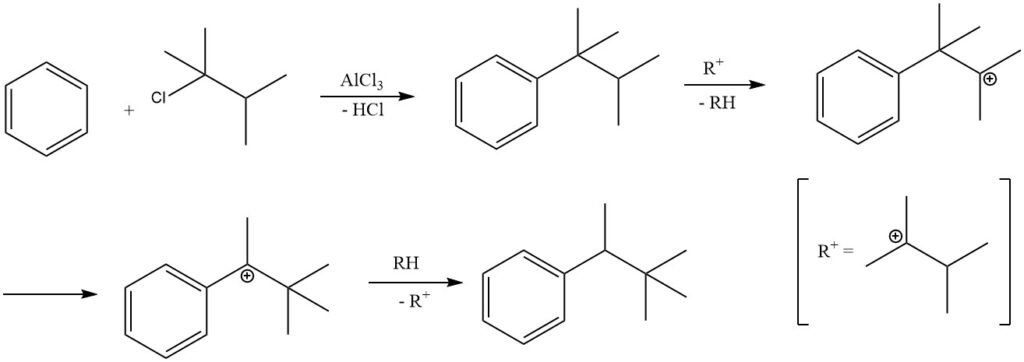
Bijvoorbeeld, alkylering van benzeen met 2-chloor-2,3-dimethylbutaan produceert voornamelijk 2,2-dimethyl-3-fenylbutaan door de isomerisatie van het primaire product tert-hexylbenzeen. De isolatie van het primaire product, tert-hexylbenzeen, is alleen mogelijk wanneer minder actieve katalysatoren, zoals ferrichloride, worden gebruikt.
1.3. Reactiviteit van aromatische substraten
De elektrofiele substitutie van aromatische verbindingen in Friedel-Crafts-alkylering wordt beïnvloed door de aanwezigheid van substituenten op het aromatische substraat. Elektronendonerende substituenten zoals alkyl, NR2 of OR (waarbij R een alkylgroep is) verhogen de reactiviteit, waardoor de nieuwe substituent bij voorkeur de ortho- of parapositie ingaat.
Als gevolg hiervan wordt, wanneer benzeen wordt gealkyleerd met olefinen, monogesubstitueerd benzeen gevormd. Deze monogesubstitueerde benzeen reageert echter sneller met een ander olefinemolecuul dan benzeen zelf, wat leidt tot een complex mengsel van mono- en polygealkyleerde benzenen.
De mate van polysubstitutie wordt beïnvloed door reactieomstandigheden en wordt verminderd door sterische hindering van omvangrijke alkylgroepen. Omvangrijke olefinen zoals cyclohexeen of lineaire C6-C18-olefinen zorgen voor goede opbrengsten van monoalkylering in benzeen.
Ethyleen of propeen kan worden monogealkyleerd door recycling van polygealkyleerde producten en zorgvuldige keuze van reactieomstandigheden, zoals te zien is in de industriële synthese van ethylbenzeen en cumeen.
Bij de alkylering van monogesubstitueerde benzenen overheersen ortho- en para-isomeren aanvankelijk. Echter, daaropvolgende isomerisatie resulteert vaak in een evenwichtsmengsel dat rijker is aan het meta-product.
Ortho-substitutie wordt alleen begunstigd als het sterisch gehinderd wordt. Bijvoorbeeld, de reactie van benzeen en 4-methylcyclohexeen gekatalyseerd door HF produceert 75% monoalkyl derivaat en 25% dialkyl derivaat, waarbij 75% het para-isomeer is en slechts 25% het meta-isomeer.
Op dezelfde manier levert cumeenalkylering door 2-buteen over BF3 – H3PO4 91% paraproduct op, en dialkylering van benzeen met propeen over silica – alumina geeft bij voorkeur p-diisopropylbenzeen, geschikt voor de synthese van tereftaalzuur en hydrochinon.
Het vervangen van benzeen door haliden deactiveert de reactie. Fenolen of fenylethers reageren veel sneller dan benzeen bij alkylering vanwege de aanzienlijk verbeterde elektronendichtheid in de ortho- en paraposities.
In microporeuze materialen hangen reactiviteiten, productselectiviteiten en isomeervoorkeuren grotendeels af van het type, aantal en sterkte van zure plaatsen en de geometrie van zeolietporiën. Alkylering met vaste katalysatoren vereist over het algemeen hogere temperaturen, met uitzondering van zeer sterke vaste zuren, zoals vaste superzuren.
1.4. Dealkylering en transalkylering
Veel van de katalysatoren die worden gebruikt voor het alkyleren van aromatische verbindingen kunnen ook de omgekeerde reactie van alkylering bevorderen, vooral bij hogere temperaturen. Wanneer alkylbenzenen bijvoorbeeld worden verhit met AlCl3, worden mengsels van benzeen en polygealkyleerde benzenen gevormd door omgekeerde alkylering.
De neiging van alkylaromatische verbindingen om disproportionering te ondergaan, hangt ook af van de structuur van de alkylsubstituent, in de volgorde: tert-C4H9 > iso-C3H7 > n-C3H7 > C2H5 > CH3.
Disproportionering en transalkylering van methylbenzenen vinden plaats bij 300 – 450 °C in aanwezigheid van vaste zure katalysatoren zoals SiO2 – Al2O3, terwijl disproportionering en transalkylering van ethylbenzenen en isopropylbenzenen plaatsvinden onder 100 °C met typische Friedel-Crafts-katalysatoren.
De intermoleculaire alkylgroepoverdracht (transalkylering) wordt gebruikt in verschillende industriële processen. Bijvoorbeeld, bij de synthese van ethylbenzeen reageert het ongewenste dialkyleringsproduct met een overmaat aan verse benzeen om een hoge conversie van ethyleen naar ethylbenzeen te bereiken.
In aanwezigheid van een overmaat aan BF3–HF levert de disproportionering van monoalkylbenzenen voornamelijk het meta-isomeer op. Dit komt door de hoge stabiliteit van het complex [m-Et2C6H5]+[BF4]−. Een soortgelijk type complex wordt commercieel gebruikt om m-xyleen selectief te extraheren uit mengsels van C8-aromatische verbindingen.
Het evenwicht tussen alkylerings- en dealkyleringsreacties verklaart de productverdeling bij de alkylering van gesubstitueerde aromatische verbindingen. Aanvankelijk worden ortho- en para-isomeren gevormd en kunnen worden geïsoleerd met korte reactietijden (kinetische controle). Bij langere reactietijden isomeriseren deze isomeren echter tot de stabielere meta-isomeren (thermodynamische controle).
Commercieel worden dealkyleringsprocessen gebruikt om tolueen om te zetten in benzeen, m-xyleen te isomeriseren tot de gewenste ortho- en para-derivaten en tolueen te disproportioneren tot benzeen en xylenen. Deze processen maken gebruik van het evenwichtsgedrag van de alkylaromatische verbinding.
2. Alkylering van benzeen
De alkylering van benzeen kent drie belangrijke commerciële toepassingen:
- Alkylering met ethyleen om ethylbenzeen te produceren, dat dient als tussenproduct voor de productie van styreen. De wereldwijde productiecapaciteit voor ethylbenzeen bedroeg in 1991 ongeveer 20 miljoen metrische ton per jaar.
- Alkylering met propeen om cumeen te produceren, dat een tussenproduct is voor de productie van fenol, met aceton als bijproduct. De wereldwijde productiecapaciteit voor cumeen bedroeg in 1992 ongeveer 7,5 miljoen metrische ton per jaar.
- Alkylering met langketenige olefinen met 10 – 18 koolstofatomen om alkylbenzenen te produceren, die vervolgens worden gesulfoneerd om oppervlakteactieve verbindingen te produceren. De productiecapaciteit voor lineaire alkylbenzeensulfonaten (LAB) bedroeg in 1992 ongeveer 180.000 metrische ton per jaar.
2.1. Alkylering van benzeen met ethyleen
De alkylering van benzeen met ethyleen resulteert in de vorming van ethylbenzeen, een reactie die snel en exotherm is.
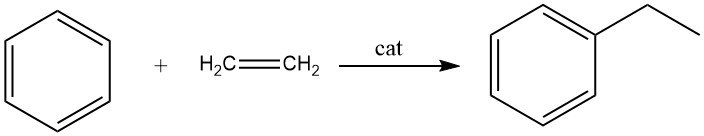
Tijdens dit proces worden aanzienlijke hoeveelheden polyethylbenzenen geproduceerd als bijproducten. De alkylering kan zowel in de vloeibare fase als in de dampfase worden uitgevoerd.
In vloeistoffaseprocessen is AlCl3 de meest gebruikte katalysator, maar andere katalysatoren zoals BF3, FeCl3, ZrCl4, SnCl4, H3PO4 en aardalkalifosfaten worden ook gebruikt. De reactie wordt doorgaans uitgevoerd bij atmosferische druk en temperaturen variërend van 85 tot 95 °C.
Dampfase-alkylering van benzeen wordt veel toegepast, vooral in de Verenigde Staten. Het wordt gewoonlijk uitgevoerd bij ongeveer 300 °C en 40 – 65 bar met behulp van zure heterogene katalysatoren zoals Al2O3-SiO2 of H3PO4-SiO2.
Om de selectiviteit voor monoalkylering te verbeteren, wordt een lage ethyleen-benzeenverhouding (0,2 : 1,0) gebruikt. Het Alkar-proces, ontwikkeld door Universal Oil Products, wordt commercieel gebruikt in verschillende fabrieken en gebruikt boortrifluoride op gemodificeerd watervrij aluminiumoxide als niet-corrosieve katalysator.
Het Alkar-proces maakt een breed scala aan ethyleenconcentraties (5 – 95%) in het toevoergas mogelijk, waardoor het mogelijk is om afgas van katalytisch kraken of demethanizer overhead of zeer zuiver ethyleen te gebruiken. De procesomstandigheden omvatten doorgaans temperaturen van ongeveer 300 °C en drukken van ongeveer 60 bar, wat leidt tot volledige omzetting van ethyleen.
De isomeerverdeling verkregen met behulp van de Alkar-katalysator voor benzeenalkylering met ethyleen is als volgt:
Di-ethylbenzenen:
1,2- (26%);
1,3- (49%); en
1,4- (25%).
Tri-ethylbenzenen:
1,2,3- (3%);
1,2,4- (35%); en
1,3,5- (62%).
Zeolietkatalysatoren hebben aanzienlijke belangstelling gekregen voor benzeenethylering. Mobil Oil en Badger introduceerden een vastbeddampfaseproces met gepatenteerde ZSM-5-zeolieten, uitgevoerd bij 420 – 430 °C en 15 – 20 bar.
Zuiver of verdund ethyleen kan na zuivering als grondstof worden gebruikt. Polyalkylbenzenen kunnen worden gerecycled voor transalkylering, wat resulteert in een hoge uiteindelijke opbrengst van ethylbenzeen (98 – 99 mol%). Zeolietkatalysatoren hebben voordelen ten opzichte van vloeibare Brønsted- of Lewiszuurkatalysatoren, omdat ze niet-corrosief en milieuvriendelijk zijn, waardoor de constructie, verwerking en verwijdering worden vereenvoudigd.
Een ander op zeoliet gebaseerd proces, het EBMax-proces, met behulp van de gepatenteerde MCM-22-zeolietkatalysator van Mobil, werkt in de vloeibare fase. Daarnaast wordt een op zeoliet gebaseerde katalysator die is ontwikkeld door Unocal, gebruikt in een vastbed-, vloeistoffase-alkyleringstechnologie die in licentie is gegeven door Lummus/Unocal/UOP.
2.2. Alkylering van benzeen met propeen
De alkylering van benzeen met propeen leidt tot de productie van cumeen, wat een exotherme reactie is. Cumeen is een essentiële verbinding die voornamelijk wordt gebruikt bij de synthese van fenol met aceton als co-product. Een klein deel van cumeen wordt ook gebruikt bij de productie van α-methylstyreen.
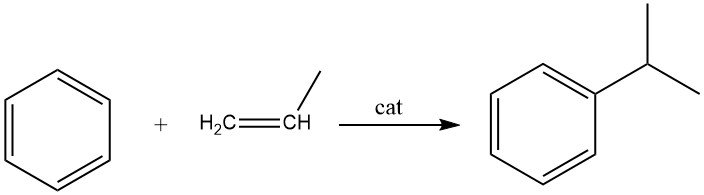
Zowel vloeistoffase- als dampfaseprocessen worden commercieel gebruikt voor de synthese van cumeen. Het veelgebruikte vloeistoffaseproces van Universal Oil Products maakt gebruik van een vaste fosforzuurkatalysator (SPA) op diatomeeënaarde.
De reactie wordt uitgevoerd bij 15 – 35 bar en temperaturen van 200 – 250 °C. Om polyalkylering te voorkomen en een hoge propeenconversie (ongeveer 94%) te bereiken, is een molaire verhouding van benzeen tot propeen van 5:1 vereist. De conversie neemt af tot 70% wanneer een 4:1 benzeen-propeenvoedingsverhouding wordt gebruikt.
Toenemende druk en temperatuur verbeteren de conversie in plaats van de cumeenopbrengsten. Naast de SPA-katalysator worden ook zwavelzuur en AlCl3 gebruikt voor de productie van cumeen.
Nieuwe cumeenproductietechnologieën op basis van zeolietkatalysatoren werden ontwikkeld door verschillende bedrijven zoals Mobil/Raytheon, UOP, CDTech, Dow/Kellogg en Enichem. Deze processen omvatten doorgaans twee reactoren en een destillatie-eenheid.
De eerste reactor voert alkylering uit, terwijl de tweede reactor zware uiteinden (tri- en polyisopropylbenzenen) transalkyleert met verse benzeen.
De MCM-22-zeoliet van Mobil, de gepatenteerde zeoliet van UOP in het QMax-proces, sterk gedealumineerde mordenietzeoliet van Dow en de BEA-zeolietkatalysator van Enichem zijn voorbeelden van zeolieten die in deze processen worden gebruikt.
Bovendien kan cumeen verder worden gealkyleerd met propeen met behulp van een voorbehandelde aluminiumsilicaatkatalysator in de vloeibare fase onder druk bij 150 – 250 °C. Dit leidt tot de productie van voornamelijk p-diisopropylbenzeen en m-diisopropylbenzeen, met slechts sporen van het ortho-isomeer.
De isomeren kunnen worden gescheiden door destillatie en het mengsel van m-diisopropylbenzeen en o-diisopropylbenzeen kan worden geïsomeriseerd om p-diisopropylbenzeen verder te produceren door transalkylering met benzeen. De diisopropylbenzenen zijn ook belangrijke tussenproducten bij de productie van hydrochinon of resorcinol.
2.3. Alkylering van benzeen met hogere olefinen
Monoalkylbenzenen met 10 – 14 koolstofatomen in de alkylketen, zoals dodecylbenzeen, spelen een belangrijke rol als tussenproducten bij de productie van alkylbenzeensulfonaten, die veel worden gebruikt in anionische commerciële detergenten (oppervlakteactieve stoffen).
Tot ongeveer 1965 was het primaire olefine dat voor deze reactie werd gebruikt propeentetrameer. Vanwege milieuzorgen met betrekking tot de biologische afbreekbaarheid van detergenten op basis van propeentetrameer, schakelde de industrie echter over op lineaire alkylbenzeensulfonaten.
Lineaire olefinen met 10 – 14 koolstofatomen worden nu gebruikt als grondstof voor de productie van alkylbenzeensulfonaat. De reactie wordt doorgaans gekatalyseerd door vloeibare HF, H2SO4 of AlCl3, en geschikte reactieomstandigheden zijn als volgt:
- HF: 0 – 10 °C, molaire verhouding benzeen tot alkeen van 4 – 10, en 2 – 3 kg alkeen per kilogram HF.
- H2SO4: 10 – 30 °C, molaire verhouding benzeen tot alkeen van 4 – 5, en 2 volumes alkeen per volume van 96 – 98% H2SO4.
- AlCl3: 55 – 60 °C, molaire verhouding benzeen tot olefine van 3 – 4, en 25 mol alkeen per mol AlCl3.
Het HF-proces wordt beschouwd als het meest economisch in termen van katalysatorverbruik. Het wordt uitgevoerd in de vloeibare fase bij atmosferische druk en 10 °C. Effectief roeren en koelen zijn nodig om de exotherme reactie te controleren en de reactietijden te bepalen.
Het product wordt gescheiden van het zuur in een bezinker, gewassen en vervolgens gedestilleerd bij atmosferische druk om benzeen te winnen en bij verminderde druk om de alkylbenzenen te isoleren.
Onlangs zijn er enkele vaste alkyleringskatalysatoren beschreven in de literatuur, maar vanwege de afgenomen vraag naar lineaire alkylbenzenen (LAB) in geïndustrialiseerde regio’s, heeft alleen het Detal-proces van UOP een nieuwe technologie op de markt gebracht met een niet-corrosieve katalysator om HF te vervangen. Dit proces maakt gebruik van een gefluorideerde silica-aluminakatalysator en werkt in de vloeibare fase bij ongeveer 130 °C, waardoor een hoge lineariteit en conversie wordt bereikt.
De reinigende eigenschappen van alkylbenzeensulfonaten worden beïnvloed door de mate van vertakking in de alkylzijketen, waarbij drie tot vijf methylgroepen in dodecylbenzeen optimaal zijn. De positie van de fenylgroep op de alkylketen heeft ook invloed op de reinigende eigenschappen.
Friedel-Crafts-alkylering leidt tot een evenwichtsproductmengsel met een willekeurige verdeling van de fenyl over de alkylketen. De productsamenstelling wordt beïnvloed door de aard van de katalysator, waarbij verschillende katalysatoren verschillende isomeren van monoalkylbenzenen bevoordelen.
Lewiszuren zoals AlCl3 zijn in staat de gevormde fenylalkanen te isomeriseren, terwijl protonzuren alleen de olefinen isomeriseren vóór de uiteindelijke alkylering van benzeen.
2.4. Alkylering van benzeen met alkylchloriden
Commercieel gezien is de alkylering van benzeen met alkylchloriden een andere methode die wordt gebruikt voor het produceren van detergentalkylaten. Het alkylchloride, verkregen uit de chlorering van paraffines, bevat ongeveer 70% paraffine. Dit mengsel wordt gereageerd met een grote overmaat aan benzeen in een geëmailleerde alkyleringstoren, met AlCl3 als katalysator, bij 80 °C.
Tijdens de reactie wordt waterstofchloride gevormd in stoichiometrische hoeveelheden, wat zorgt voor een grondige menging van de reactanten en wordt gescheiden aan de bovenkant van de reactor.
De producten worden vervolgens gescheiden van de katalysator in een bezinker, geneutraliseerd, gewassen en gedestilleerd om benzeen en paraffine te winnen, die worden gerecycled. De alkylaten worden verder gezuiverd door destillatie onder verlaagde druk.
Een uitdaging bij dit proces is de vorming van aanzienlijke hoeveelheden indaan- en tetralinederivaten als bijproducten vanwege de aanwezigheid van dichlooralkaanverontreinigingen in het alkylchloride.
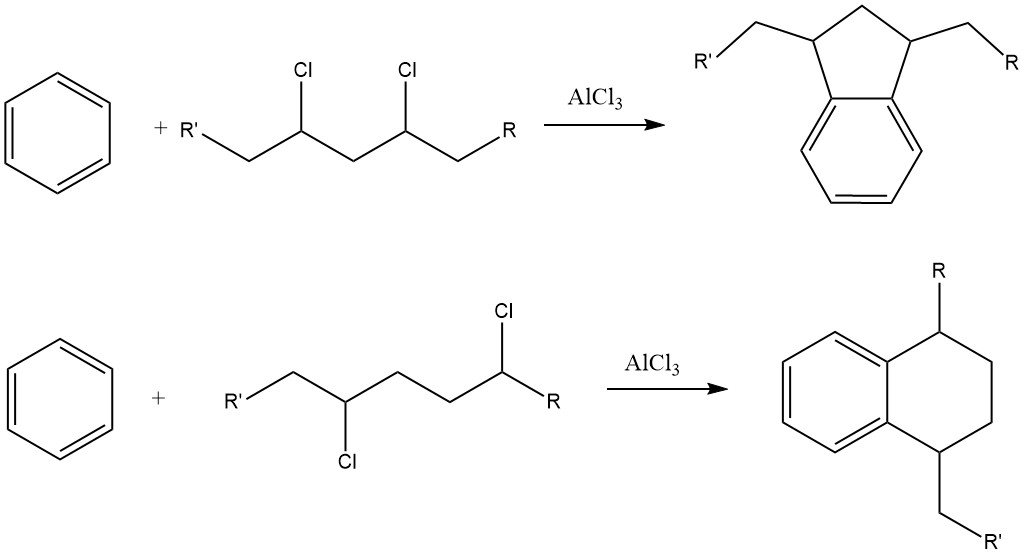
Alkylbenzenen met meer dan 15 koolstofatomen in de zijketen leiden tot alkylbenzeensulfonaten die vrijwel onoplosbaar zijn in water, maar zeer goed oplosbaar in organische media, zoals minerale oliën.
Deze oplossingen in minerale olie worden gebruikt in de metaalverwerkende industrie als boor- en snijvloeistoffen of in de textielindustrie als spin- of batchvloeistoffen. Bovendien worden alkylbenzeensulfonaten van dit type steeds vaker gebruikt als overstromingsmiddelen in verbeterde petroleumwinningsprocessen.
2.5. Diverse alkyleringen van benzeen
Benzeen kan alkylering ondergaan met een breed scala aan verbindingen, waaronder verschillende lineaire, vertakte, cyclische, aryl- of anderszins gesubstitueerde olefinen, alkylhaliden, alcoholen, ethers, alkynen en diënen.
Sommige van deze reacties zijn succesvol gecommercialiseerd, zoals de synthese van tert-butylbenzeen uit benzeen en isobuteen. Tert-butylbenzeen vindt toepassing in de productie van parfums.
3. Cycloalkylering
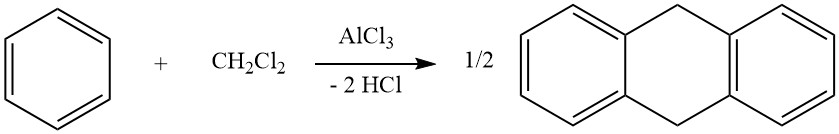
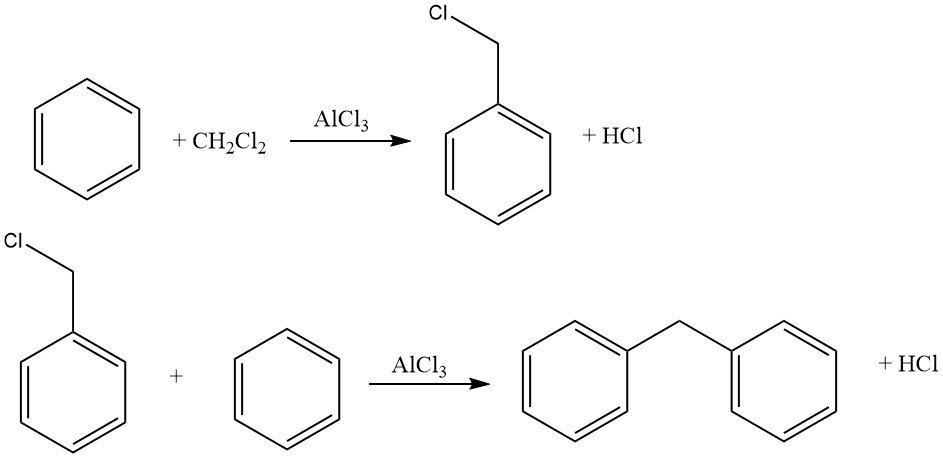
Een voorbeeld van intermoleculaire cycloalkyleringen betreft de reactie van dichloormethaan en benzeen, wat leidt tot de vorming van 9,10-dihydroantraceen samen met wat difenylmethaan. Bij deze reactie worden ook antraceenderivaten geproduceerd.
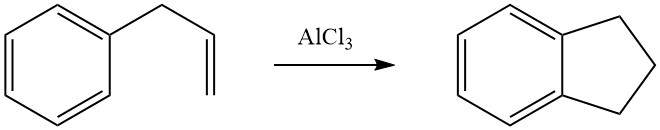
Intramoleculaire cycloalkylering is mogelijk voor gealkyleerde aromatische verbindingen die een dubbele binding of een functionele groep, zoals een halogeen- of hydroxygroep, in hun zijketen dragen. Bijvoorbeeld, 3-fenyl-1-propeen ondergaat isomerisatie in de aanwezigheid van AlCl3 om indaan te vormen.
BASF ontwikkelde een synthese voor antrachinon op basis van cycloalkylering. Dit omvat de dimerisatie van styreen in de vloeibare fase tot 1-methyl-3-fenylindaan, waarbij fosforzuur als katalysator wordt gebruikt. De resulterende verbinding wordt vervolgens onderworpen aan katalytische oxidatie in de dampfase om antrachinon te produceren.
3.1. Arylering van aromatische verbindingen
Arylering van aromatische verbindingen kan worden bereikt met behulp van verschillende methoden, waaronder reactie met arylhalogeniden, reactie met diazoniumhalogeniden en dehydrogenerende condensatie.
Arylhalogeniden, zoals fluorbenzeen, chloorbenzeen en broombenzeen, kunnen worden gebruikt als aryleringsmiddelen in Friedel-Crafts-aryleringen. Hun reactiviteit is echter relatief laag, waarbij fluorbenzeen het meest reactief is, gevolgd door chloorbenzeen en broombenzeen.
Arylatie met fluorbenzeen kan bifenylen als producten opleveren, terwijl de ontleding van aryldiazoniumtetrafluoroboraten in aromatische oplosmiddelen kan leiden tot ring-arylateerde producten samen met fluorbenzeen.
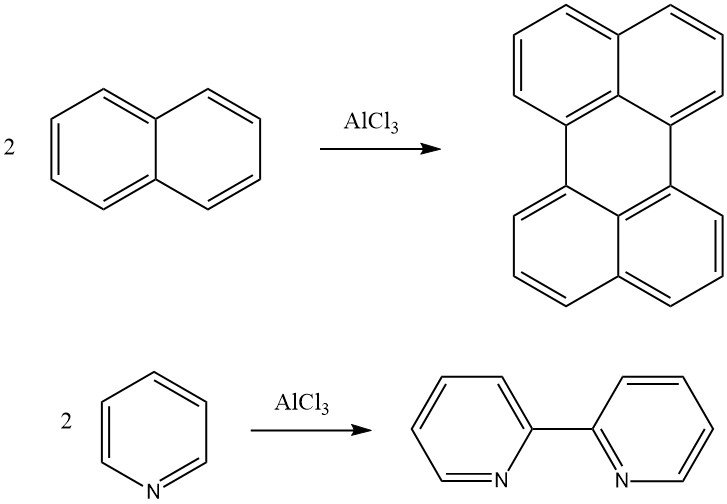
De Scholl-reactie is een dehydrogenerende condensatie van een aromatische verbinding in aanwezigheid van Friedel-Crafts-katalysatoren. Naftaleen kan bijvoorbeeld worden omgezet in peryleen en pyridine kan worden omgezet in 2,2′-dipyridyl via deze reactie. Hoogmoleculaire polygecondenseerde aromatische verbindingen kunnen ook worden gevormd met behulp van de Scholl-reactie.
4. Alkylering van gesubstitueerde benzenen
De alkylering van benzeen leidt doorgaans tot een mengsel van monogealkyleerde, digealkyleerde en polygesubstitueerde verbindingen. De reactiviteit en oriëntatie in de tweede substitutiestap zijn afhankelijk van de elektronische en sterische eigenschappen van de eerste substituent en de grootte van het alkyleringsmiddel.
Digealkyleerde benzenen zijn van groot commercieel belang. Diethylbenzenen worden bijvoorbeeld gebruikt om de octaangetallen van motorbrandstoffen te verbeteren en worden verkregen als bijproducten bij de productie van ethylbenzeen.
Dialkylbenzenen kunnen worden gedehydrogeneerd om divinylbenzenen te produceren, die cruciaal zijn voor het crosslinken van polyolefinen zoals polystyreen bij de productie van ionenuitwisselingsharsen.
Ethylmethylbenzeen, gevormd door ethylering van tolueen, is industrieel waardevol als uitgangsmateriaal voor styrenen met methylsubstituties in de aromatische ring. Een ander voorbeeld is de productie van diisopropylbenzeen door de reactie van propeen met cumeen (alkylering van benzeen met propeen).
4.1. De alkylering van tolueen met propeen
Het industriële proces van het alkyleren van tolueen met propeen om cymeen te produceren wordt uitgevoerd door bedrijven als Sumitomo Chemicals. Het resulterende cymeenmengsel bestaat voornamelijk uit meta- en para-isomeren, die vervolgens worden onderworpen aan oxidatie om aceton en cresolen te verkrijgen.
Deze cresolen bestaan voor ongeveer 39,5% uit meta- en paracresolen en voor 36% uit meta-cresol en dienen als essentiële grondstoffen voor fenolharsen en weekmakers.
Een ander belangrijk aspect betreft de productie van polymethylbenzenen door processen zoals disproportionering van tolueen of methylering van benzeen of tolueen. Deze polymethylbenzenen kunnen oxidatie ondergaan om de overeenkomstige zuren te vormen, die toepassingen vinden in verschillende polymeren zoals polyesters, polyamiden en polyimiden.
4.2. Alkylering van hogere aromatische verbindingen
Het alkyleren van hogere aromatische verbindingen, zoals bifenyl, indaan, tetraline en polynucleaire aromatische verbindingen zoals naftaleen, acenafteen, antraceen, fluoreen en fenantreen, is gedocumenteerd.
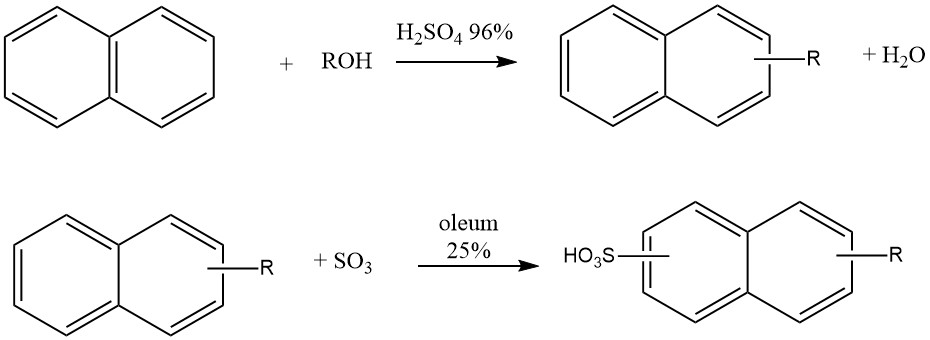
Zo wordt de alkylering van naftaleen met hogere olefinen commercieel gebruikt om fluorescerende middelen te produceren die worden gebruikt in smeeroliën. Bij deze reactie in de vloeistoffase wordt AlCl3 als katalysator gebruikt bij temperaturen tot 180 °C.
Een andere industriële toepassing van naftaleenalkylering is de productie van ‘Nekal’-type detergenten (BASF), die alkylnaftaleensulfonaten zijn. Deze verbindingen behoorden tot de eerste synthetische detergenten en worden nog steeds gebruikt als oppervlakteactieve stoffen in de textielindustrie.
De synthese van deze alkylnaftaleensulfonaten omvat een one-potproces waarbij naftaleen reageert met butanol, hexanol of mengsels van propanol-butanol in aanwezigheid van 96% zwavelzuur bij 50 °C. Na alkylering wordt 25% oleum toegevoegd voor sulfonering.
Bovendien omvat het Hock-proces de oxidatie van 2-isopropylnaftaleen, wat resulteert in 2-naftol. Om 2-isopropylnaftaleen te verkrijgen, kan een reactie tussen naftaleen en propeen worden uitgevoerd met ZnCl2 of aluminiumsilicaten als katalysatoren bij 150 – 200 °C, waarbij ook kleine hoeveelheden van het 1-isopropylisomeer worden verkregen.
Bovendien hebben 2,6-dialkylnaftalenen aanzienlijke interesse gewekt vanwege hun omzetting in 2,6-naftaleendicarbonzuur, dat wordt gebruikt bij de productie van hoogwaardig plastic poly(ethyleen-2,6-naftaleendicarboxylaat) (polyethyleennaftenaat, PEN).
Verschillende vormselectieve katalysatoren, waaronder mordeniet, zijn bestudeerd voor het alkyleren van naftalenen. Als alternatief commercialiseerde Amoco in 1995 een andere route met een capaciteit van ongeveer 40.000 t/a. Ze alkyleren o-xyleen met butadieen over een sterk basische katalysator, wat o-tolylpenteen oplevert, dat vervolgens cyclisatie, dehydrogenering en isomerisatie ondergaat.
5. Alkylering van fenolen
De alkylering van fenolen is een zeer belangrijke industriële reactie, die resulteert in de productie van alkylfenolen die uitgebreid worden gebruikt in verschillende toepassingen, zoals antioxidanten, herbiciden, insecticiden en polymeren.
Vanwege de verhoogde elektronendichtheid in de aromatische ring geassocieerd met de nucleofiele hydroxylgroep, vindt alkylering plaats onder mildere omstandigheden vergeleken met aromatische koolwaterstoffen.
Verschillende factoren, waaronder reactieomstandigheden, katalysatoren en alkyleringsmiddelen, beïnvloeden de vorming van voornamelijk ortho- of para-monogealkyleerde, 2,4- of 2,6-digealkyleerde en 2,4,6-trigealkyleerde fenolen.
Hogere temperaturen leiden tot thermodynamisch stabielere meta-isomeren vanwege secundaire reacties. Bovendien kunnen lage temperaturen en katalysatorconcentraties aanzienlijke hoeveelheden alkylarylethers opleveren, terwijl hogere temperaturen, katalysatorconcentraties en zuursterkte de overheersende vorming van alkylfenolen bevorderen.
Alkyleringsmiddelen zoals olefinen, alcoholen en alkylhalogeniden worden gebruikt in het alkyleringsproces. Er zijn drie hoofdtypen industriële processen voor fenolalkylering ontwikkeld:
- Vloeistoffase-alkylering omvat het toevoegen van het alkyleringsmiddel aan een oplossing of suspensie van de katalysator in de fenol. Na de reactie wordt de katalysator gescheiden en wordt eventuele resterende katalysator ontleed door neutralisatie.
- Vaste-bed-vloeistoffaseprocessen werken met de reactanten die over de katalysator gaan in buisvormige reactoren bij verhoogde druk, die extern worden gekoeld.
- Dampfase-alkylering houdt in dat fenol en het alkyleringsmiddel, zoals methanol of een olefine, naar een reactor met vast bed worden gestuurd die werkt bij 300 – 400 °C, met efficiënte verwijdering van de reactiewarmte.
Productterugwinning omvat destillatie, waarbij niet-omgezette fenolen en alkyleringsmiddelen worden gerecycled en verschillende mono-, di- en trialkyleerde fenolen worden gescheiden. Volledige verwijdering van zure katalysatorsporen is cruciaal om nevenreacties tijdens destillatie te voorkomen, zoals isomerisatie, transalkylering en disproportionering.
Vloeistoffaseprocessen maken gebruik van Lewis-zuurkatalysatoren zoals AlCl3, BF3 of Al(C6H5O)3, protonzuren zoals HF, H2SO4, H3PO4 of p-tolylsulfonzuur, of zure ionenuitwisselingsharsen, zoals Nafion-harsen of gesulfoneerde polystyrenen.
Dampfaseprocessen vereisen katalysatoren met een hoge thermische stabiliteit, zoals montmorillonieten, zeolieten zoals faujasiet en metaaloxiden zoals γ-Al2O3, MgO, CaO en Fe2O3 – CrO3.
Regioselectiviteit kan worden gecontroleerd met behulp van verschillende katalysatoren. Bijvoorbeeld, HF, BF3, Al2O3•SiO2 of zure ionenuitwisselingsharsen bevorderen voornamelijk p-gesubstitueerde producten bij het alkyleren van fenolen met olefinen.
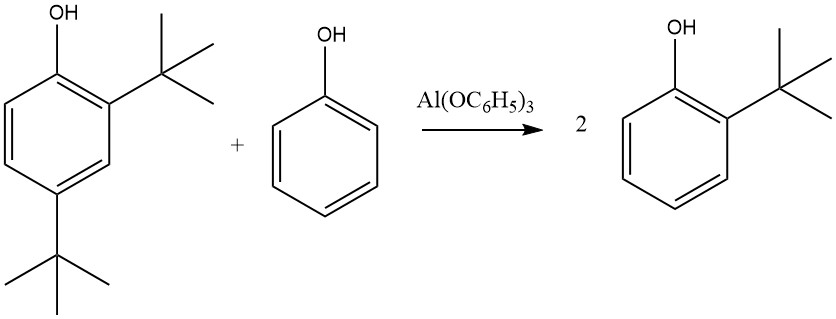
Aan de andere kant leidt Al(C6H5O)3, gevormd uit fenol en metallisch aluminium, met name in de aanwezigheid van sporenkwikzouten, bijna uitsluitend tot 2-gealkyleerde en 2,6-dialkyleerde producten. Deze selectiviteit voor ortho-alkylering wordt toegeschreven aan een zesledige overgangstoestand waarbij aluminiumfenolaat en een olefine betrokken zijn.
Andere metaalzouten van fenol, waaronder die van zink, magnesium en calcium, kunnen deze reactie ook activeren, die niet beperkt is tot fenol; 2-naftol, 2-cresol of 4-cresol kunnen ook worden gealkyleerd door ethyleen, propeen, de butenen, cyclohexeen of andere olefinen, met variërende reactiviteit, waarbij isobuteen de hoogste reactiviteit vertoont en ethyleen de laagste.
In aanwezigheid van γ-Al2O3 als katalysator kan een hoge selectiviteit voor monogealkyleerde o-fenolen worden bereikt. Dit proces werkt bij verhoogde temperaturen van 200 – 350 °C in de vloeibare fase bij drukken van 20 – 200 bar en is geschikt voor continue vaste-bedbewerking.
Wat betreft de alkylfenolproducten, worden alkylfenolen vaak geproduceerd in batchbewerkingen, wat een hogere flexibiliteit biedt. Voor verbindingen die in grote hoeveelheden worden geproduceerd, zoals cresolen, 2,6-xylenol, 2-sec-butylfenol, 4-tert-butylfenol, octylfenol, nonylfenol, dodecylfenol, thymol of 2,6-di-tert-butyl-4-methylfenol, zijn echter continue processen met capaciteiten tot 25.000 t/a elk geïntroduceerd.
5.1. Alkylering van fenol met methanol
Alkylering van fenol met methanol onder verhoogde temperaturen en met een katalysator levert voornamelijk 2-cresol op (60 – 70% bij 50% fenolconversie en 300 °C) en 2,6-xylenol, vergezeld door kleine hoeveelheden 4-cresolen, 2,4- en 2,3-xylenolen en een kleine hoeveelheid 3-cresol.
De reactie kan worden uitgevoerd in de vloeibare of dampfase. Bij dampfaseprocessen worden de reactanten bij atmosferische of licht verhoogde druk in een buisreactor met een vastbedkatalysator bij temperaturen van 300 tot 450 °C gebracht.
Het gebruik van geactiveerde Al2O3 bij 300 °C en MgO en CeO2 bij respectievelijk 540 en 450 °C resulteert in een hoge selectiviteit voor 2-cresol en 2,6-xylenol. Het gebruik van zeer zure katalysatoren zoals aluminiumoxide, aluminiumsilicaten, zeolieten en aluminiumfosfaat, vooral bij hogere temperaturen, leidt echter tot transalkylerings-isomerisatie, wat resulteert in een verhoogde productie van 3-cresol en 4-cresol.
Vloeistoffaseprocessen maken gebruik van katalysatoren zoals Al2O3, Al(OMe)3, Al(OC6H5)3 of ZnCl2 – HCl bij verhoogde druk. In alle gevallen neemt de xylenol:cresolverhouding toe met de methanol:fenolverhouding, temperatuur en druk.
5.2. Alkylering van fenolen met olefinen
Alkylering van fenol met methanol wordt uitgevoerd bij verhoogde temperaturen, doorgaans tussen 320 en 340 °C, in aanwezigheid van 1 – 2% Al(C6H5O)3 en bij 200 bar, wat resulteert in de vorming van 2-ethylfenol.
Aan de andere kant kan de alkylering van fenol met propeen om 2-isopropylfenol te produceren worden bereikt bij lagere temperaturen van 280 – 300 °C met behulp van γ-Al2O3 als katalysator.
Daarnaast wordt propylering van cresolen om thymol of carvacol te produceren uitgevoerd in continue vloeistoffaseprocessen met behulp van γ-Al2O3, aluminiumsilicaten of zeolieten. Onder vergelijkbare omstandigheden kan 2-sec-butylfenol worden geproduceerd uit fenol en n-butenen.
De productie van 2-tert-butylfenol en 2,6-di-tert-butylfenol kan worden bereikt bij 100 °C onder drukken tot 20 bar in aanwezigheid van Al(C6H5O)3, waarbij gebruik wordt gemaakt van de hoge reactiviteit van isobuteen.
Als alternatief kan 4-tert-butylfenol worden bereid bij atmosferische druk en temperaturen variërend van 80 tot 140 °C met behulp van H2SO4, H3PO4, BF3 of bij voorkeur zure kationenuitwisselingsharsen.
De belangrijke antioxidant 2,6-di-tert-butyl-4-methylfenol wordt geproduceerd uit 4-cresol en isobuteen bij 70 °C met behulp van H2SO4 als katalysator. Op dezelfde manier resulteert alkylering van fenol met 2-methylbutenen bij 100 – 120 °C in aanwezigheid van BF3 of H3PO4 in 4-tert-amylfenol, en met een overmaat aan 2-methylbutenen wordt 2,4-di-tert-amylfenol gevormd.
Een belangrijk commercieel proces omvat alkylering van fenol met lineaire of vertakte olefinen met 6 – 20 koolstofatomen, wat leidt tot alkylfenolen, die na ethoxylering en sulfering een brede toepassing vinden als anionische detergentia.
Di-isobuteen, tripropeen en tetrapropeen zijn de voorkeursalkyleringsmiddelen, en de reactie wordt gekatalyseerd onder milde omstandigheden (50 – 85 °C) met behulp van BF3 in continue-batch- of buisreactoren. Zure kationenuitwisselingsharsen, zoals macroreticulair gesulfoneerd polystyreen, zijn ook uitstekende katalysatoren die de katalysatorscheiding vergemakkelijken.
Om een betere temperatuurcontrole te bereiken, kan de reactie in twee fasen worden uitgevoerd, waarbij in de eerste fase een katalysator met een verlaagde zuurgraad wordt gebruikt. Chemische Werke H€uls (nu Degussa-H€uls) in Duitsland gebruikt een dergelijk proces om nonylfenol te produceren.
In de eerste fase van dit vastbedproces stijgt de temperatuur van 80 tot 120 °C en in de tweede fase stijgt deze van 110 tot 130 °C. Geactiveerde aluminiumsilicaten kunnen ook als katalysator dienen, maar vereisen hogere reactietemperaturen en langere reactietijden.
De industriële productie van alkylfenolen, haloalkylfenolen en verwante verbindingen is uitgebreid en deze verbindingen worden veel gebruikt als oxidatieremmers, detergenten, bactericiden, fungiciden, insecticiden en ontsmettingsmiddelen.
6. Alkylering van aromatische aminen
Vanwege de basiciteit van aromatische aminen zijn zure katalysatoren niet goed geschikt voor hun alkylering. Bijvoorbeeld, het gebruik van de Friedel-Crafts katalysator AlCl3 in de reactie van ethyleen met aniline levert voornamelijk ongeïdentificeerde harsachtige producten op met slechts kleine hoeveelheden 2-ethylaniline.
Echter, aluminiumanilide, Al(C6H5NH)3, gevormd in situ door verhitting van aluminiumpoeder in aniline met waterstofontwikkeling, blijkt een effectieve katalysator voor deze reactie te zijn. Onder omstandigheden van 300 – 340 °C en 200 bar wordt 2,6-diethylaniline verkregen na 2 – 3 uur, terwijl kortere reactietijden leiden tot de vorming van 2-ethylaniline.
De katalytische activiteit van aluminiumanilide wordt verder versterkt door de toevoeging van Friedel-Crafts-katalysatoren zoals AlCl3, SnCl4, TiCl4, SiCl4, BF3 of ZnCl2. Alkalimetaal- en AlCl3-mengsels in aniline vertonen ook activiteit, wat selectief leidt tot N-alkylering.
Deze reactie is uitgebreid naar verschillende gesubstitueerde anilinen, waaronder 2-, 3- en 4-toluidine, 2,6-, 2,4- en 2,5-xylidine, 2-propylaniline, 2- en 3-chlooraniline en α-naftylamine. Bovendien kunnen diaminen zoals m-fenyleendiamine of 2,4-toluyleendiamine, evenals secundaire aminen zoals difenylamine, ook alkylering ondergaan.
In het alkyleringsproces met olefinen neemt de reactiviteit af in de volgorde van ethyleen > propeen > 1-buteen > isobuteen, wat tegengesteld is aan de reactiviteitsvolgorde die wordt waargenomen bij fenolalkylering met Al(OC6H5)3-katalysator.
Met name isobuteen vertoont activiteit met Friedel-Crafts-katalysatoren zoals AlCl3, BF3 of montmorilloniet, zelfs bij 200 – 250 °C, maar met aluminiumanilide verloopt de reactie langzaam. Wanneer montmorilloniet wordt gebruikt, vindt selectieve vorming van 4-tert-butylaniline plaats, terwijl BF3– of AlCl3-katalysatoren mengsels van de 2- en 4-isomeren opleveren.
Bij de alkylering van anilinen met methanol fungeren moleculaire zeven als katalysatoren, wat resulteert in een complex mengsel dat 2-toluidine, 2,6- en 2,4-xylidine en 2,4,6-trimethylaniline bevat. Industrieel worden 2,6-dialkylanilines, zoals 2-ethyl-6-methylaniline, geproduceerd als tussenproducten voor herbiciden en kleurstoffen.
7. Alkylering van heteroaromatische verbindingen en verwante substraten
Verschillende heterocyclische aromatische verbindingen, waaronder furanen, thiofenen en N-heterocycli, kunnen worden onderworpen aan alkyleringsreacties, hoewel er beperkte informatie beschikbaar is over hun commerciële toepassingen.
Cyclopentadienylderivaten ondergaan ook Friedel-Crafts-alkylering op een manier die vergelijkbaar is met andere aromatische verbindingen.
7.1. Furaan
Furan vertoont een hogere reactiviteit in Friedel-Crafts-alkyleringen vergeleken met benzeen. Furanen ondergaan echter de neiging om snelle verharsing te ondergaan in aanwezigheid van zuren, wat de productscheiding kan compliceren.
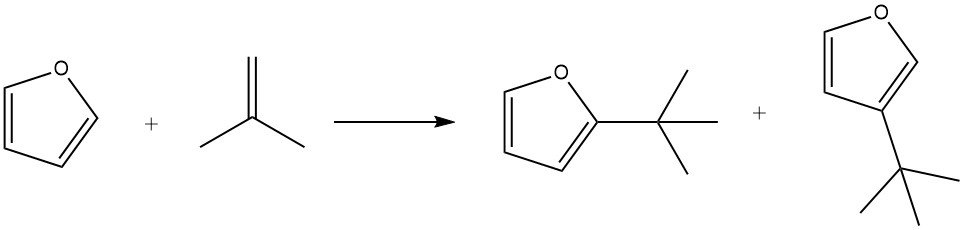
Door fosforzuur op kiezelgoer als katalysator te gebruiken, kan furaan efficiënt worden gealkyleerd met isobuteen bij 100 °C binnen 3 uur, wat resulteert in een opbrengst van 85% van de alkylaten, samen met kleine hoeveelheden iso-octeen.
Onder milde omstandigheden (bijv. 50 °C gedurende 1 uur) wordt substitutie in de 2-positie begunstigd. Langere reactietijden (7 uur), hogere temperaturen (150 °C) en hogere katalysatorconcentraties bevorderen echter de vorming van producten die in de 3-positie worden gesubstitueerd. Bovendien is de vorming van 2,5-di-tert-butylfuraan ook waargenomen tijdens het proces.
7.2. Thiofeen
Thiofeen vertoont een aanzienlijk hogere reactiviteit in Friedel-Crafts-reacties vergeleken met aromatische koolwaterstoffen, waardoor het kan worden gealkyleerd met verschillende olefinen, waaronder propeen, 1-buteen, 2-methylbutenen, cyclohexeen en alcoholen zoals isopropylalcohol en tert-butylalcohol.
Succesvolle resultaten zijn verkregen met behulp van zure katalysatoren zoals fosforzuur bij 60 °C of alumina-silica bij 200 °C. Het gebruik van H2SO4, HF, BF3•OMe2 en AlCl3 resulteerde echter in nevenreacties. In alle gevallen werd het thiofeen gesubstitueerd op de 2-positie en werden ook producten met een hoger kookpunt, zoals dialkylverbindingen, geproduceerd.
Bovendien is de verwijdering van thiofeen uit gekraakte benzine tijdens het raffineren met koud geconcentreerd zwavelzuur waarschijnlijk een alkyleringsreactie. De olefinen die in de benzine aanwezig zijn, fungeren als alkylerende middelen, wat leidt tot de vorming van hoogkokende alkylthiofenen, die als residu achterblijven bij destillatie.
7.3. N-Heterocyclische verbindingen
N-Heterocyclische verbindingen kunnen alkylering ondergaan in aanwezigheid van aluminiumamiden als katalysatoren. Terwijl heterocyclische verbindingen zoals carbazool en indool traag reageren met aluminiummetaal om het amide te vormen, dient aluminiumanilide als een effectieve katalysator.
Wanneer carbazol bijvoorbeeld reageert met ethyleen in aanwezigheid van aniline en aluminiumpoeder, produceert het 1-ethylcarbazool. Deze reactie vindt plaats in een autoclaaf bij 280 °C en 200 bar.
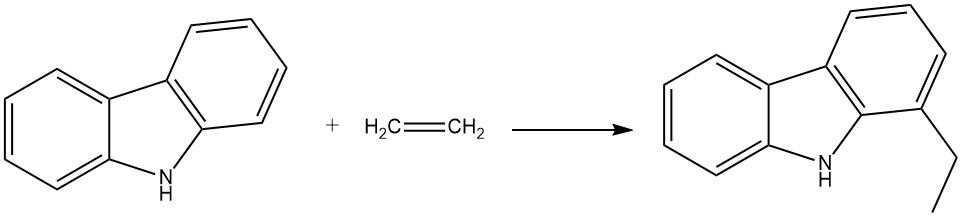
Propeen kan ook reageren onder vergelijkbare omstandigheden om 1-isopropylcarbazool te produceren, hoewel met een iets lagere opbrengst.
De combinatie van carbazol en propeen met AlCl3 als katalysator bij 90 – 100 °C resulteert in de vorming van diisopropylcarbazool. Een andere reactie over een aluminiumsilicaatkatalysator bij 180 – 200 °C geeft tetra- en pentaisopropylcarbazool. Bovendien kan de ethylering van pyrrool worden bereikt met behulp van een aluminiumsilicaatkatalysator bij 200 – 370 °C.
7.4. Niet-benzenoïde aromatische verbindingen
Niet-benzenoïde aromatische verbindingen, zoals ferrocenen, fulvenen, azulenen, pseudoazulenen, indolizines en cyclazines, delen chemische overeenkomsten niet alleen met benzenoïde systemen maar ook met olefinen.
Hun elektrofiele substitutiereacties vinden doorgaans plaats onder mildere omstandigheden vergeleken met benzeenderivaten. Vanwege hun relatief lage stabiliteit is echter een zorgvuldige selectie van katalysatoren en reactieomstandigheden essentieel.
Ferroceen kan alkylering ondergaan in aanwezigheid van Lewis-zuren, zoals AlCl3, met verschillende substraten, waaronder methanol, ethyl, isopropyl, butyl en benzylhalogeniden, 1,2-dichloorethaan, ethyleen, propeen en isobuteen.
De reactie leidt vaak tot complexe mengsels van homoannulaire en heteroannulaire producten (waarbij beide ringen gealkyleerd zijn), omdat het systeem reactiever wordt na de eerste alkyleringsstap.
Alkylering van ferroceen met olefinen lijkt gunstiger te zijn, zoals de reactie met isobuteen, die zelfs bij kamertemperatuur plaatsvindt. Bij hogere temperaturen (100 – 150 °C) wordt heteroannulair tri-tert-butylferroceen verkregen in een opbrengst van 44%, samen met wat tetra-tert-butylferroceen. Sterische hindering voorkomt de hechting van meer dan twee tert-butylsubstituenten aan dezelfde cyclopentadienylring.
8. Diverse alkyleringsreacties
De alkylering van aromatische verbindingen met behulp van bi- of polyfunctionele reagentia resulteert in de vorming van een divers scala aan waardevolle mono-, di- of polynucleaire producten met significante commerciële toepassingen.
8.1. Haloalkyleringen
Onder geschikte reactieomstandigheden kunnen haloalkyleringen van aromatische verbindingen met bi- of polyfunctionele alkyleringsmiddelen primaire haloalkyleringsproducten produceren, terwijl ongewenste cycloalkylering of koppeling van meerdere kernen wordt vermeden.
Veelvoorkomende haloalkylerende middelen zijn onder andere aldehyde-waterstofhalide, haloalkylethers, haloalcoholen en vergelijkbare verbindingen. Dit proces maakt halomethylering, haloethylering, hogere haloalkylering en bis- en polyalkylering mogelijk.
De reactie wordt vaak gekatalyseerd door zinkchloride, maar andere katalysatoren zoals zure haliden (bijv. ZnCl2 – AlCl3, SnCl4, AlCl3–ketonen, AlCl3 – pyridine) of protonzuren (HCl, H2SO4, H3PO4, p-tolueensulfonzuur) kunnen ook worden gebruikt.
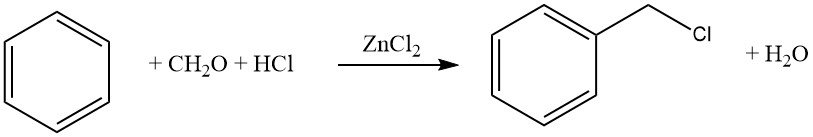
Een veelvoorkomend voorbeeld van deze reactie is de chloormethylering met behulp van formaldehyde-HCl (Blanc-reactie). Hoewel deze reactie synthetisch waardevol is, moet voorzichtigheid worden betracht vanwege de vorming van reactieve tussenproducten, met name chloormethylethers, die zeer kankerverwekkend zijn.
8.2. Hydroxyalkylering
Hydroxyalkylering van aromatische verbindingen met behulp van aldehyden en ketonen in aanwezigheid van zuren is van aanzienlijk industrieel belang. De elektrofielen die de aromatische kern aanvallen, worden gevormd door de reactie van aldehyden of ketonen met Lewis- of protonzuren (waarbij R, R0 = H, alkyl, aryl).
De reactie resulteert in de vorming van een gesubstitueerde benzylalcohol. Onder zure omstandigheden reageert deze alcohol met een ander molecuul van de aromatische verbinding om een gesubstitueerde diarylmethaan te produceren.
Een opmerkelijk voorbeeld van deze reactie is de hydroxyalkylering van fenol met aceton, wat 2,2-bis-(4-hydroxyfenyl)propaan oplevert, algemeen bekend als bisfenol A. Deze verbinding wordt industrieel geproduceerd in continue processen met behulp van H2SO4 (of droge HCl in het Hooker-proces) als katalysator en methylmercaptaan als promotor, wat resulteert in bijna kwantitatieve opbrengsten bij 50 °C.
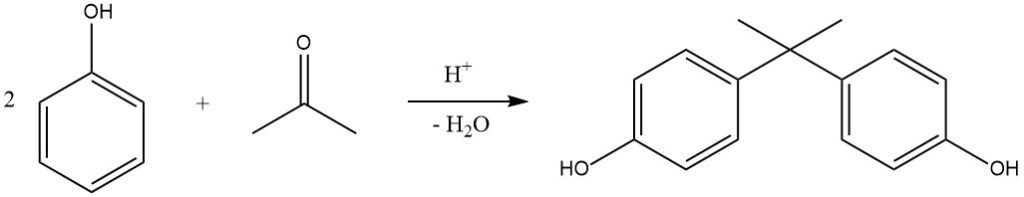
Kationenuitwisselingsharsen worden ook steeds vaker gebruikt als katalysatoren vanwege hun vereenvoudigde scheidingsproces. Bisfenol A wordt voornamelijk gebruikt voor de productie van epoxy- en polycarbonaatharsen.
Hydroxyalkyleringen zijn zeer veelzijdig, waardoor talrijke alkyl- en aryl-gesubstitueerde aldehyden en ketonen kunnen reageren met verschillende aromatische verbindingen. Zo wordt bijvoorbeeld het insecticide DDT geproduceerd uit chloraal en chloorbenzeen. De reactie van fenol met formaldehyde leidt tot hydroxymethylfenolen, die verder kunnen condenseren om fenolharsen te vormen bij verhoogde temperaturen.
Wanneer oxiranen (epoxiden) worden gebruikt als alkyleringsmiddelen, worden β-hydroxyalkyl aromatische verbindingen verkregen. Zo leidt de reactie van benzeen met ethyleenoxide in aanwezigheid van een stoichiometrische hoeveelheid AlCl3 tot een aluminiumalkoxide, dat bij hydrolyse β-fenylethanol oplevert.
8.3. Amidomethylering
Amidomethylering, ook bekend als de Tscherniac-Einhorn-reactie, is een proces waarbij N-hydroxymethylamiden of de overeenkomstige imiden reageren met aromatische verbindingen onder milde omstandigheden in de aanwezigheid van zwavelzuur. Deze reactie zorgt voor de introductie van een amidomethylgroep in de aromatische kern.
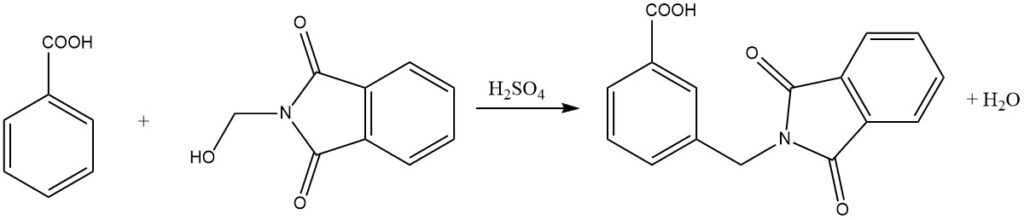
Bovendien kunnen minder reactieve aromatische verbindingen, zoals benzoëzuren, ook amidoalkylering ondergaan via dit proces. Opmerkelijk genoeg kunnen zelfs nitro-gesubstitueerde aromatische verbindingen worden gealkyleerd met behulp van N-chloormethylcarbonzuuramiden in de aanwezigheid van AlCl3 als katalysator.
Referentie
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185