1. Alchilazione di Friedel-Crafts
L’alchilazione di Friedel-Crafts dei composti aromatici comporta una sostituzione elettrofila acido-catalizzata, in cui un gruppo alchilico sostituisce un idrogeno aromatico. Una vasta gamma di agenti alchilanti, come olefine, alogenuri alchilici e alcoli, è comunemente impiegata a questo scopo.
Questa reazione può essere applicata a vari substrati aromatici, inclusi composti eteroaromatici e persino composti come il ferrocene. Queste reazioni sono in genere rapide ed esotermiche e sono spesso condotte in condizioni miti nella fase liquida.
Tuttavia, in alcuni casi, vengono utilizzati processi in fase di vapore con condizioni più severe per determinati substrati. Quando olefine, alogenuri alchilici e alcoli vengono utilizzati come agenti alchilanti, le reazioni complessive procedono come segue:
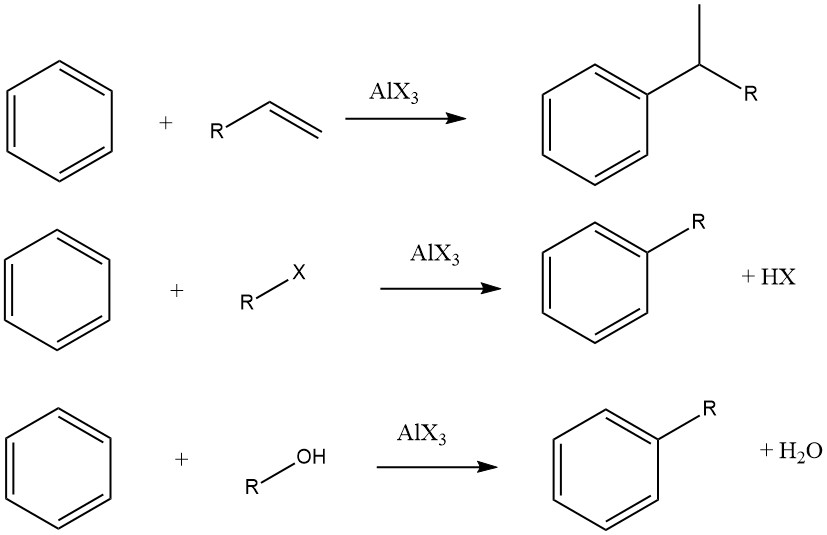
Sommario
Il grado di isomerizzazione della frazione alchilica e l’aderenza alla regola di Markovnikov durante il processo di aggiunta variano a seconda dell’acidità del catalizzatore.
1.1. Catalizzatori per l’alchilazione di Friedel-Crafts
I catalizzatori utilizzati nel processo di alchilazione di Friedel-Crafts sono acidi e la loro efficacia dipende da vari fattori, tra cui le condizioni di reazione, gli agenti alchilanti e i substrati aromatici. Sia gli acidi di Lewis che gli acidi di Brønsted possono agire come catalizzatori attivi e i catalizzatori utilizzati di frequente sono classificati in base alle loro strutture chimiche.
| Gruppo | Esempi | Tipo di acido |
|---|---|---|
| Alogenuri acidi | AlCl3, AlBr3, SnCl4, SbCl5, FeCl3 | Acidi di Lewis |
| Alchili metallici e alcolossidi | AlR3, BR3, ZnR2, Al(OPh)3 | Acidi di Lewis |
| Acidi protonici | HCl, HCl – AlCl3, H2SO4, HF, H3PO4 | Acido di Brønsted |
| Ossidi acidi e derivati | zeoliti, ossidi misti e superacidi solidi, argille, eteropoliacidi | Acido di Brønsted/Lewis |
| Acidi supportati | H3PO4 – SiO2, BF3 – Al2O3 | Acido di Brønsted/Lewis |
| Resine a scambio cationico | Permutit Q, Amberlite IR 112, Dowex 50, Nafion – silice, Deloxan | Acido di Brønsted |
Tradizionalmente, alogenuri acidi come AlCl3 o AlBr3 e acidi protonici come HCl, HF o H2SO4, supportati su terra di diatomee, sono stati ampiamente impiegati. Tuttavia, si sta verificando un cambiamento verso la sostituzione di questi catalizzatori con zeoliti e ossidi inorganici a causa della loro ecocompatibilità, facilità di gestione e minori implicazioni di costo nella progettazione del processo.
La presenza di basi, in particolare composti organici di azoto, riduce l’acidità e l’efficienza del catalizzatore. L’ossigeno, anche a concentrazioni basse come 20 ppm, può portare alla formazione di materiali resinosi pesanti sul catalizzatore. Dieni come il butadiene in un’alimentazione di butene contribuiscono anche alla produzione di sostanze resinose o catramose sul catalizzatore.
È interessante notare che tracce di umidità o altri fornitori di protoni possono migliorare l’attività catalitica, in particolare per gli acidi di Lewis. Tuttavia, quantità maggiori di questi composti sono dannose per le prestazioni del catalizzatore.
In alcuni casi, veleni catalizzatori blandi, come i composti nitro organici, vengono utilizzati intenzionalmente per abbassare l’acidità del catalizzatore e prevenire reazioni collaterali come l’isomerizzazione. Questi composti nitro organici formano complessi stechiometrici con gli acidi di Lewis, con conseguenti processi di alchilazione più puliti con rese moderate.
Inoltre, alcuni addotti come BF3·OEt2 o BF3·C6H5OH agiscono come catalizzatori di Friedel-Crafts blandi. Le impurità nei catalizzatori, come la presenza di cloruro ferrico nel cloruro di alluminio, possono ridurre significativamente la resa del prodotto e influenzare il corso della reazione catalizzata dagli acidi di Lewis.
1.2. Isomerizzazione degli agenti alchilanti
A causa della natura acida delle condizioni di reazione nell’alchilazione di Friedel-Crafts, i reagenti alchilanti spesso subiscono riarrangiamenti e tendono a trasformarsi nell’isomero più altamente ramificato possibile. Ciò è dimostrato nelle reazioni di benzene con cloruro di propile, dove l’isopropilbenzene è il prodotto principale, e con cloruro di n-butile, che porta alla formazione di sec-butilbenzene.
In questi casi, l’isomerizzazione dell’agente alchilante è avviata dalla migrazione di un atomo di idrogeno piuttosto che da riarrangiamenti diretti del carbonio. La forza trainante dietro questa isomerizzazione è la formazione del carbocatione più stabile, seguendo la solita tendenza: primario < secondario < terziario.
Ad esempio, quando il benzene viene alchilato con 1-olefine lineari a catena lunga, la reazione porta non solo alla formazione di 2-alchilbenzene ma anche a una distribuzione casuale del sostituente fenilico lungo la catena alchilica nella maggior parte dei casi.
Questo effetto potrebbe anche essere attribuito all’isomerizzazione dei prodotti di reazione alchilati, poiché l’n-butilbenzene viene trasformato in sec-butilbenzene in presenza di un catalizzatore di Friedel-Crafts come AlCl3.
In determinate condizioni di reazione, l’alchilazione del benzene con alogenuri alchilici terziari può portare alla formazione di alchilbenzeni secondari anziché di alchilbenzeni terziari.
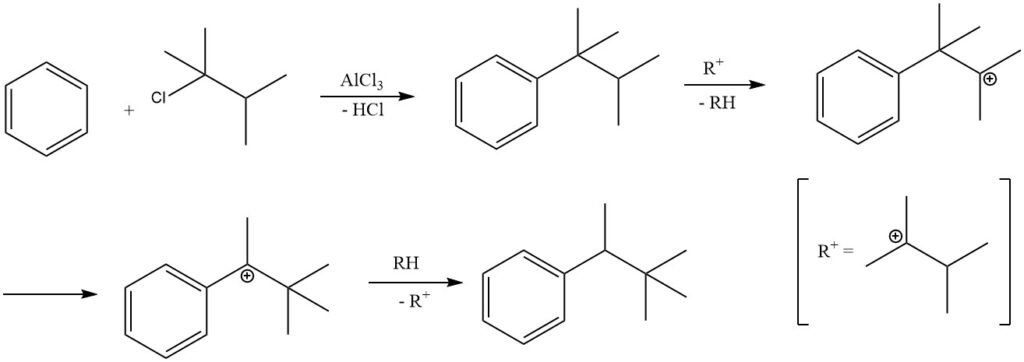
Ad esempio, l’alchilazione del benzene con 2-cloro-2,3-dimetilbutano produce prevalentemente 2,2-dimetil-3-fenilbutano a causa dell’isomerizzazione del prodotto primario tert-esilbenzene. L’isolamento del prodotto primario, tert-esilbenzene, è possibile solo quando vengono impiegati catalizzatori meno attivi, come il cloruro ferrico.
1.3. Reattività dei substrati aromatici
La sostituzione elettrofila dei composti aromatici nell’alchilazione di Friedel-Crafts è influenzata dalla presenza di sostituenti sul substrato aromatico. I sostituenti donatori di elettroni come alchile, NR2 o OR (dove R è un gruppo alchilico) aumentano la reattività, facendo sì che il nuovo sostituente entri preferibilmente in posizione orto o para.
Di conseguenza, quando il benzene viene alchilato con olefine, si forma benzene monosostituito. Tuttavia, questo benzene monosostituito reagisce più velocemente con un’altra molecola di olefina rispetto al benzene stesso, dando origine a una miscela complessa di benzeni mono- e polialchilati.
Il grado di polisostituzione è influenzato dalle condizioni di reazione ed è ridotto dall’impedimento sterico dei gruppi alchilici voluminosi. Le olefine voluminose come il cicloesene o le olefine lineari C6 – C18 consentono buone rese di monoalchilazione nel benzene.
L’etilene o il propene possono essere monoalchilati tramite il riciclaggio dei prodotti polialchilati e un’attenta scelta delle condizioni di reazione, come si vede nella sintesi industriale di etilbenzene e cumene.
Nell’alchilazione dei benzeni monosostituiti, inizialmente predominano gli isomeri orto e para. Tuttavia, la successiva isomerizzazione spesso determina una miscela di equilibrio più ricca del prodotto meta.
La sostituzione orto è favorita solo se stericamente impedita. Ad esempio, la reazione di benzene e 4-metilcicloesene catalizzata da HF produce il 75% di derivato monoalchilico e il 25% di derivato dialchilico, con il 75% che è l’isomero para e solo il 25% l’isomero meta.
Allo stesso modo, l’alchilazione del cumene mediante 2-butene su BF3 – H3PO4 produce il 91% di prodotto para, e la dialchilazione del benzene con propene su silice – allumina produce preferibilmente p-diisopropilbenzene, adatto per la sintesi di acido tereftalico e idrochinone.
La sostituzione del benzene con alogenuri disattiva la reazione. I fenoli o gli eteri fenilici reagiscono molto più velocemente del benzene nell’alchilazione a causa della densità elettronica notevolmente aumentata nelle posizioni orto e para.
Nei materiali microporosi, reattività, selettività del prodotto e preferenze isomeriche dipendono in larga misura dal tipo, dal numero e dalla forza dei siti acidi e dalla geometria dei pori della zeolite. L’alchilazione mediante catalizzatori solidi richiede generalmente temperature più elevate, con l’eccezione di acidi solidi molto forti, come i superacidi solidi.
1.4. Dealchilazione e transalchilazione
Molti dei catalizzatori utilizzati per l’alchilazione dei composti aromatici possono anche promuovere la reazione inversa dell’alchilazione, specialmente a temperature più elevate. Ad esempio, quando gli alchilbenzeni vengono riscaldati con AlCl3, si formano miscele di benzene e benzeni polialchilati tramite alchilazione inversa.
La tendenza dei composti alchilaromatici a subire la disproporzione dipende anche dalla struttura del sostituente alchilico, seguendo l’ordine: tert-C4H9 > iso-C3H7 > n-C3H7 > C2H5 > CH3.
La disproporzione e la transalchilazione dei metilbenzeni avvengono a 300 – 450 °C in presenza di catalizzatori acidi solidi come SiO2 – Al2O3, mentre la disproporzione e la transalchilazione degli etilbenzeni e degli isopropilbenzeni avvengono al di sotto dei 100 °C con i tipici catalizzatori di Friedel-Crafts.
Il trasferimento del gruppo alchilico intermolecolare (transalchilazione) è utilizzato in vari processi industriali. Ad esempio, nella sintesi dell’etilbenzene, il prodotto di dialchilazione indesiderato reagisce con un eccesso di benzene fresco per ottenere un’elevata conversione dell’etilene in etilbenzene.
In presenza di un eccesso di BF3–HF, la disproporzione dei monoalchilbenzeni produce prevalentemente l’isomero meta. Ciò è dovuto all’elevata stabilità del complesso [m-Et2C6H5]+[BF4]−. Un tipo simile di complesso è utilizzato commercialmente per estrarre selettivamente l’m-xilene da miscele di composti aromatici C8.
L’equilibrio tra reazioni di alchilazione e dealchilazione spiega la distribuzione del prodotto nell’alchilazione di composti aromatici sostituiti. Inizialmente, si formano isomeri orto e para che possono essere isolati con tempi di reazione brevi (controllo cinetico). Tuttavia, con tempi di reazione prolungati, questi isomeri si isomerizzano negli isomeri meta più stabili (controllo termodinamico).
Commercialmente, i processi di dealchilazione vengono utilizzati per convertire il toluene in benzene, isomerizzare l’m-xilene nei derivati orto e para desiderati e sproporzionare il toluene in benzene e xileni. Questi processi sfruttano il comportamento di equilibrio del composto alchilaromatico.
2. Alchilazione del benzene
L’alchilazione del benzene trova tre principali applicazioni commerciali:
- Alchilazione con etilene per produrre etilbenzene, che funge da intermedio per la produzione di stirene. La capacità di produzione globale di etilbenzene era di circa 20 milioni di tonnellate metriche all’anno nel 1991.
- Alchilazione con propene per produrre cumene, che è un intermedio per la produzione di fenolo, con acetone come sottoprodotto. La capacità di produzione globale di cumene era di circa 7,5 milioni di tonnellate metriche all’anno nel 1992.
- Alchilazione con olefine a catena lunga contenenti 10-18 atomi di carbonio per produrre alchilbenzeni, che vengono poi solfonati per produrre composti tensioattivi. La capacità di produzione di alchilbenzenesolfonati lineari nel 1992 era di circa 180.000 tonnellate metriche all’anno.
2.1. Alchilazione del benzene con etilene
L’alchilazione del benzene con etilene porta alla formazione di etilbenzene, una reazione rapida ed esotermica.
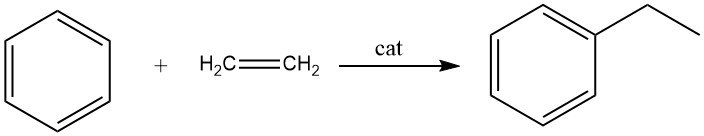
Durante questo processo, vengono prodotte quantità significative di polietilbenzeni come prodotti secondari. L’alchilazione può essere eseguita sia in fase liquida che in fase di vapore.
Nei processi in fase liquida, AlCl3 è il catalizzatore più comunemente utilizzato, ma vengono utilizzati anche altri catalizzatori come BF3, FeCl3, ZrCl4, SnCl4, H3PO4 e fosfati alcalino-terrosi. La reazione viene in genere condotta a pressione atmosferica e temperature comprese tra 85 e 95 °C.
L’alchilazione in fase di vapore del benzene è ampiamente praticata, soprattutto negli Stati Uniti. Di solito viene eseguita a circa 300 °C e 40-65 bar utilizzando catalizzatori eterogenei acidi come Al2O3-SiO2 o H3PO4-SiO2.
Per migliorare la selettività alla monoalchilazione, viene utilizzato un basso rapporto etilene-benzene (0,2:1,0). Il processo Alkar, sviluppato da Universal Oil Products, è impiegato commercialmente in diversi impianti e utilizza trifluoruro di boro supportato su allumina anidra modificata come catalizzatore non corrosivo.
Il processo Alkar consente un’ampia gamma di concentrazioni di etilene (5-95%) nel gas di alimentazione, consentendo l’uso di gas di scarico da cracking catalitico o testa del demetanizzatore, o etilene ad alta purezza. Le condizioni di processo in genere comportano temperature di circa 300 °C e pressioni di circa 60 bar, che portano alla conversione completa dell’etilene.
La distribuzione degli isomeri ottenuta utilizzando il catalizzatore Alkar per l’alchilazione del benzene con etilene è la seguente:
Dietilbenzeni:
1,2- (26%);
1,3- (49%); e
1,4- (25%).
Trietilbenzeni:
1,2,3- (3%);
1,2,4- (35%); e
1,3,5- (62%).
I catalizzatori a zeolite hanno suscitato notevole interesse per l’etilazione del benzene. Mobil Oil e Badger hanno introdotto un processo in fase vapore a letto fisso utilizzando zeoliti ZSM-5 proprietarie, condotto a 420-430 °C e 15-20 bar.
L’etilene puro o diluito può essere utilizzato come materia prima dopo la purificazione. I polialchilbenzeni possono essere riciclati per la transalchilazione, con conseguente elevata resa finale di etilbenzene (98-99 moli %). I catalizzatori a base di zeolite presentano vantaggi rispetto ai catalizzatori liquidi Brønsted o Lewis acid, essendo non corrosivi e rispettosi dell’ambiente, semplificando la costruzione, la gestione e lo smaltimento.
Un altro processo a base di zeolite denominato EBMax Process, che utilizza il catalizzatore a zeolite MCM-22 proprietario di Mobil, opera in fase liquida. Inoltre, un catalizzatore a base di zeolite sviluppato da Unocal è impiegato in una tecnologia di alchilazione a letto fisso in fase liquida con licenza Lummus/Unocal/UOP.
2.2. Alchilazione del benzene con propene
L’alchilazione del benzene con propene porta alla produzione di cumene, che è una reazione esotermica. Il cumene è un composto essenziale utilizzato principalmente nella sintesi del fenolo con acetone come coprodotto. Una piccola porzione di cumene è utilizzata anche nella produzione di α-metilstirene.
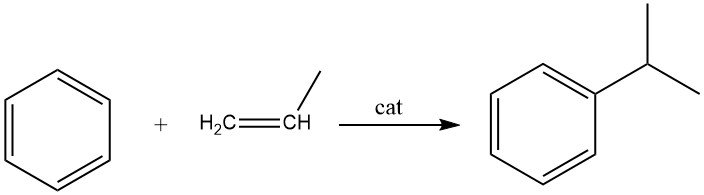
Sia i processi in fase liquida che quelli in fase vapore sono impiegati commercialmente per la sintesi del cumene. Il processo in fase liquida ampiamente utilizzato da Universal Oil Products utilizza un catalizzatore di acido fosforico solido supportato su terra di diatomee.
La reazione viene condotta a 15-35 bar e temperature di 200-250 °C. Per prevenire la polialchilazione e ottenere un’elevata conversione del propene (circa il 94%), è richiesto un rapporto molare tra benzene e propene di 5:1. La conversione diminuisce al 70% quando viene utilizzato un rapporto di alimentazione benzene-propene di 4:1.
L’aumento di pressione e temperatura migliora la conversione piuttosto che le rese di cumene. Oltre al catalizzatore SPA, per la produzione di cumene vengono utilizzati anche acido solforico e AlCl3.
Nuove tecnologie di produzione di cumene basate su catalizzatori di zeolite sono state sviluppate da varie aziende come Mobil/Raytheon, UOP, CDTech, Dow/Kellogg ed Enichem. Questi processi in genere coinvolgono due reattori e un’unità di distillazione.
Il primo reattore esegue l’alchilazione, mentre il secondo reattore transalchila le estremità pesanti (tri- e poliisopropilbenzeni) con benzene fresco.
La zeolite MCM-22 di Mobil, la zeolite proprietaria di UOP nel processo QMax, la zeolite mordenite altamente dealluminata di Dow e il catalizzatore BEA-zeolite di Enichem sono esempi di zeoliti utilizzate in questi processi.
Inoltre, il cumene può essere ulteriormente alchilato con propene utilizzando un catalizzatore di silicato di alluminio pretrattato nella fase liquida sotto pressione a 150 – 250 °C. Ciò porta alla produzione principalmente di p-diisopropilbenzene e m-diisopropilbenzene, con solo tracce dell’isomero orto.
Gli isomeri possono essere separati per distillazione e la miscela di m-diisopropilbenzene e o-diisopropilbenzene può essere isomerizzata per produrre ulteriormente p-diisopropilbenzene mediante transalchilazione con benzene. I diisopropilbenzeni sono anche importanti intermedi nella produzione di idrochinone o resorcinolo.
2.3. Alchilazione del benzene con olefine superiori
I monoalchilbenzeni con 10 – 14 atomi di carbonio nella catena alchilica, come il dodecilbenzene, svolgono un ruolo importante come intermedi nella produzione di alchilbenzenesolfonati, ampiamente utilizzati nei prodotti detergenti commerciali anionici (tensioattivi).
Fino al 1965 circa, l’olefina primaria utilizzata per questa reazione era il tetramero di propene. Tuttavia, a causa di preoccupazioni ambientali legate alla biodegradabilità dei detergenti basati sul tetramero di propene, l’industria si è spostata verso gli alchilbenzenesolfonati lineari.
Le olefine lineari con 10-14 atomi di carbonio sono ora utilizzate come materia prima per la produzione di alchilbenzenesolfonati. La reazione è in genere catalizzata da HF liquido, H2SO4 o AlCl3 e le condizioni di reazione idonee sono le seguenti:
- HF: 0-10 °C, rapporto molare benzene/alchene di 4-10 e 2-3 kg di alchene per chilogrammo di HF.
- H2SO4: 10-30 °C, rapporto molare benzene/alchene di 4-5 e 2 volumi di alchene per volume di 96-98% H2SO4.
- AlCl3: 55 – 60 °C, rapporto molare benzene/olefina di 3 – 4 e 25 moli di alchene per mole di AlCl3.
Il processo HF è considerato il più economico in termini di consumo di catalizzatore. Viene eseguito in fase liquida a pressione atmosferica e 10 °C. Sono necessarie un’agitazione e un raffreddamento efficaci per controllare la reazione esotermica e determinare i tempi di reazione.
Il prodotto viene separato dall’acido in un sedimentatore, lavato e quindi distillato a pressione atmosferica per recuperare il benzene e a pressione ridotta per isolare gli alchilbenzeni.
Di recente, alcuni catalizzatori di alchilazione solidi sono stati descritti in letteratura, ma a causa della diminuzione della domanda di alchilbenzeni lineari nelle regioni industrializzate, solo il processo Detal di UOP ha commercializzato una nuova tecnologia che utilizza un catalizzatore non corrosivo per sostituire HF. Questo processo utilizza un catalizzatore di silice-allumina fluorurata e funziona in fase liquida a circa 130 °C, ottenendo elevata linearità e conversione.
Le proprietà detergenti degli alchilbenzensolfonati sono influenzate dal grado di ramificazione nella catena laterale alchilica, con tre o cinque gruppi metilici nel dodecilbenzene che sono ottimali. Anche la posizione del gruppo fenilico sulla catena alchilica influisce sulle proprietà detergenti.
L’alchilazione di Friedel-Crafts porta a una miscela di prodotti in equilibrio con una distribuzione casuale del fenile sulla catena alchilica. La composizione del prodotto è influenzata dalla natura del catalizzatore, con diversi catalizzatori che favoriscono diversi isomeri di monoalchilbenzeni.
Gli acidi di Lewis come AlCl3 sono in grado di isomerizzare i fenilalcani formati, mentre gli acidi protonici isomerizzano solo le olefine prima dell’alchilazione finale del benzene.
2.4. Alchilazione del benzene con cloruri alchilici
Commercialmente, l’alchilazione del benzene con cloruri alchilici è un altro metodo utilizzato per produrre alchilati detergenti. Il cloruro alchilico, ottenuto dalla clorurazione delle paraffine, contiene circa il 70% di paraffina. Questa miscela viene fatta reagire con un grande eccesso di benzene in una torre di alchilazione smaltata, utilizzando AlCl3 come catalizzatore, a 80 °C.
Durante la reazione, si forma acido cloridrico in quantità stechiometriche, che assicura una miscelazione completa dei reagenti e viene separato nella parte superiore del reattore.
I prodotti vengono quindi separati dal catalizzatore in un sedimentatore, neutralizzati, lavati e distillati per recuperare benzene e paraffina, che vengono riciclati. Gli alchilati vengono ulteriormente purificati tramite distillazione a pressione ridotta.
Una sfida con questo processo è la formazione di notevoli quantità di derivati di indano e tetralina come sottoprodotti a causa della presenza di impurità di dicloroalcano nel cloruro di alchile.
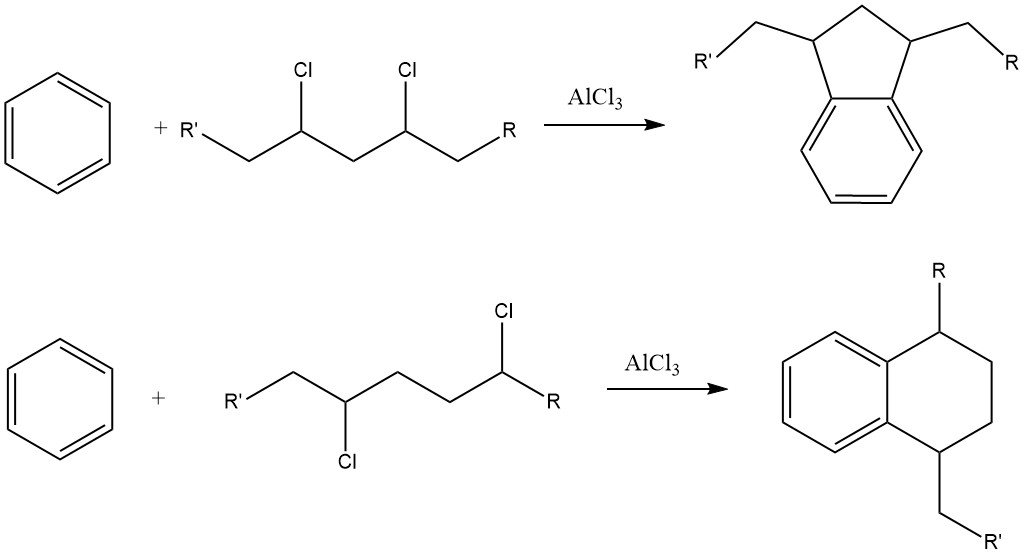
Gli alchilbenzeni con più di 15 atomi di carbonio nella catena laterale portano ad alchilbenzenesolfonati che sono quasi insolubili in acqua ma altamente solubili in mezzi organici, come gli oli minerali.
Queste soluzioni in olio minerale trovano impiego nell’industria metalmeccanica come fluidi di perforazione e taglio o nell’industria tessile come fluidi di filatura o di lotti. Inoltre, gli alchilbenzenesolfonati di questo tipo sono sempre più utilizzati come agenti di allagamento nei processi di recupero avanzato del petrolio.
2.5. Alchilazioni varie del benzene
Il benzene può subire alchilazione con un’ampia gamma di composti, tra cui varie olefine lineari, ramificate, cicliche, ariliche o altrimenti sostituite, alogenuri alchilici, alcoli, eteri, alchini e dieni.
Alcune di queste reazioni sono state commercializzate con successo, come la sintesi di terz-butilbenzene da benzene e isobutene. Il terz-butilbenzene trova applicazione nella produzione di profumi.
3. Cicloalchilazione
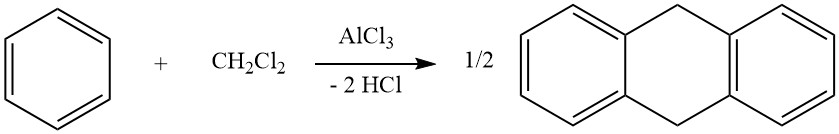
Un esempio di cicloalchilazione intermolecolare riguarda la reazione di diclorometano e benzene, che porta alla formazione di 9,10-diidroantracene insieme a un po’ di difenilmetano. In questa reazione vengono prodotti anche derivati dell’antracene.
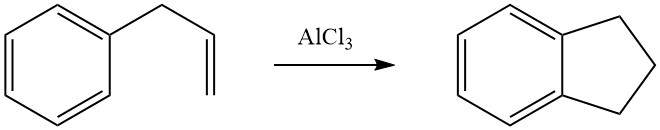
La cicloalchilazione intramolecolare è possibile per composti aromatici alchilati che portano un doppio legame o un gruppo funzionale, come un gruppo alogeno o idrossi, nella loro catena laterale. Ad esempio, il 3-fenil-1-propene subisce isomerizzazione in presenza di AlCl3 per formare indano.
BASF ha sviluppato una sintesi per l’antrachinone basata sulla cicloalchilazione. Ciò comporta la dimerizzazione dello stirene nella fase liquida a 1-metil-3-fenilindano, utilizzando acido fosforico come catalizzatore. Il composto risultante viene quindi sottoposto a ossidazione catalitica in fase vapore per produrre antrachinone.
3.1. Arilazione di composti aromatici
L’arilazione di composti aromatici può essere ottenuta utilizzando vari metodi, tra cui la reazione con alogenuri arilici, la reazione con alogenuri di diazonio e la condensazione deidrogenante.
Gli alogenuri arilici, come fluorobenzene, clorobenzene e bromobenzene, possono essere utilizzati come agenti arilanti nelle arilazioni di Friedel-Crafts. Tuttavia, la loro reattività è relativamente bassa, con il fluorobenzene che è il più reattivo seguito da clorobenzene e bromobenzene.
L’arilazione con fluorobenzene può produrre bifenili come prodotti, mentre la decomposizione di tetrafluoroborati di arildiazonio in solventi aromatici può portare a prodotti arilati ad anello insieme al fluorobenzene.
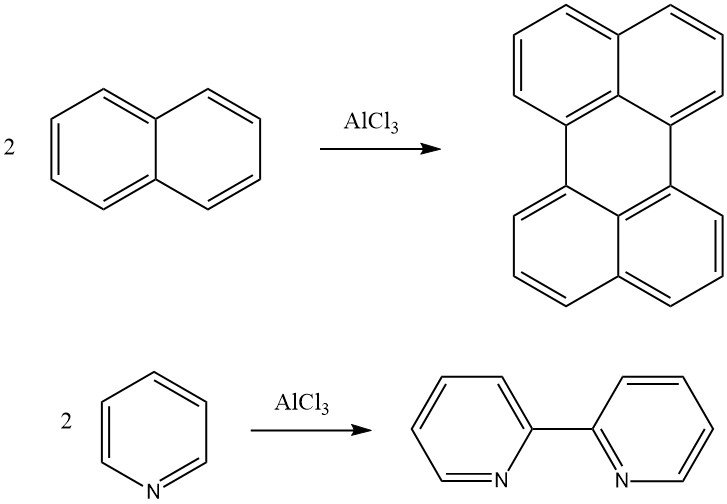
La reazione di Scholl è una condensazione deidrogenante di un composto aromatico in presenza di catalizzatori di Friedel-Crafts. Ad esempio, il naftalene può essere convertito in perilene e la piridina può essere convertita in 2,2′-dipiridile attraverso questa reazione. Anche i composti aromatici policondensati ad alto peso molecolare possono essere formati utilizzando la reazione di Scholl.
4. Alchilazione di benzeni sostituiti
L’alchilazione del benzene in genere porta a una miscela di composti monoalchilati, dialchilati e polisostituiti. La reattività e l’orientamento nel secondo passaggio di sostituzione dipendono dalle proprietà elettroniche e steriche del primo sostituente e dalle dimensioni dell’agente alchilante.
I benzeni dialchilati hanno un’importanza commerciale significativa. Ad esempio, i dietilbenzeni vengono utilizzati per aumentare i valori di ottano dei carburanti per motori e sono ottenuti come sottoprodotti nella produzione di etilbenzene.
I dialchilbenzeni possono essere deidrogenati per produrre divinilbenzeni, che sono essenziali per la reticolazione di poliolefine come il polistirene nella produzione di resine a scambio ionico.
L’etilmetilbenzene, formato dall’etilazione del toluene, è industrialmente prezioso come materiale di partenza per stireni che hanno sostituzioni metiliche nell’anello aromatico. Un altro esempio è la produzione di diisopropilbenzene tramite la reazione di propene con cumene (alchilazione di benzene con propene).
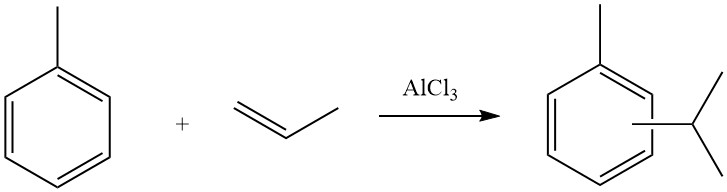
4.1. Alchilazione di toluene con propene
Il processo industriale di alchilazione di toluene con propene per produrre cimene è eseguito da aziende come Sumitomo Chemicals. La miscela di cimene risultante è composta principalmente da isomeri meta e para, che viene poi sottoposta a ossidazione per produrre acetone e cresoli.
Questi cresoli comprendono circa il 39,5% di meta e para-cresoli e il 36% di meta-cresolo e servono come materie prime essenziali per resine fenoliche e plastificanti.
Un altro aspetto significativo riguarda la produzione di benzeni polimetilati mediante processi come la disproporzione del toluene o la metilazione del benzene o del toluene. Questi benzeni polimetilati possono subire ossidazione per formare gli acidi corrispondenti, che trovano applicazioni in vari polimeri come poliesteri, poliammidi e poliimmidi.
4.2. Alchilazione di composti aromatici superiori
È stata documentata l’alchilazione di composti aromatici superiori, come bifenile, indano, tetralina e composti aromatici polinucleari come naftalene, acenaftene, antracene, fluorene e fenantrene.
Ad esempio, l’alchilazione del naftalene con olefine superiori è impiegata commercialmente per produrre agenti fluorescenti utilizzati negli oli lubrificanti. Questa reazione in fase liquida utilizza AlCl3 come catalizzatore a temperature fino a 180 °C.
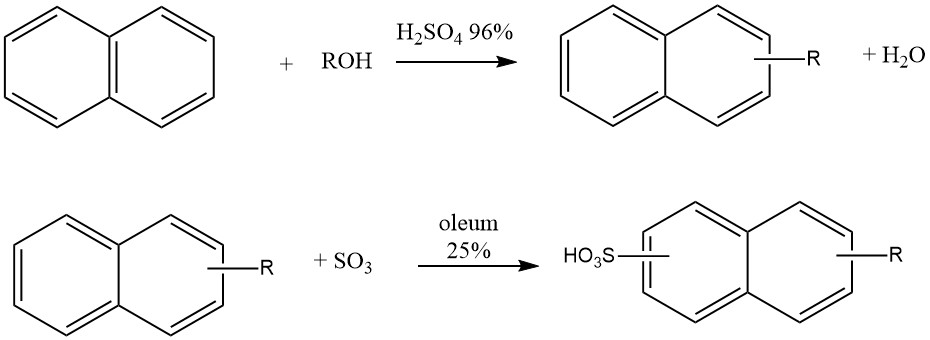
Un’altra applicazione industriale dell’alchilazione del naftalene è la produzione di detergenti di tipo “Nekal” (BASF), che sono alchilnaftalensolfonati. Questi composti sono stati tra i primi detergenti sintetici e continuano a essere utilizzati come tensioattivi nell’industria tessile.
La sintesi di questi alchilnaftalensolfonati comporta un processo one-pot in cui il naftalene reagisce con butanolo, esanolo o miscele di propanolo-butanolo in presenza di acido solforico al 96% a 50 °C. Dopo l’alchilazione, viene aggiunto il 25% di oleum per la solfonazione.
Inoltre, il processo Hock comporta l’ossidazione del 2-isopropilnaftalene, con conseguente produzione di 2-naftolo. Per ottenere il 2-isopropilnaftalene, è possibile effettuare una reazione tra naftalene e propene utilizzando ZnCl2 o silicati di alluminio come catalizzatori a 150-200 °C, producendo anche piccole quantità dell’isomero 1-isopropile.
Inoltre, i 2,6-dialchilnaftaleni hanno suscitato notevole interesse a causa della loro conversione in acido 2,6-naftalendicarbossilico, utilizzato nella produzione di poli(etilene-2,6-naftalene dicarbossilato) plastico ad alte prestazioni (polietilenenaftenato, PEN).
Sono stati studiati vari catalizzatori selettivi di forma, tra cui la mordenite, per l’alchilazione dei naftaleni. In alternativa, Amoco ha commercializzato un altro percorso nel 1995 con una capacità di circa 40.000 t/a. Alchilano l’o-xilene con butadiene su un catalizzatore fortemente basico, producendo o-tolilpentene, che poi subisce ciclizzazione, deidrogenazione e isomerizzazione.
5. Alchilazione dei fenoli
L’alchilazione dei fenoli è una reazione industriale altamente significativa, che porta alla produzione di alchilfenoli ampiamente utilizzati in varie applicazioni, come antiossidanti, erbicidi, insetticidi e polimeri.
A causa dell’aumentata densità elettronica nell’anello aromatico associato al gruppo idrossilico nucleofilo, l’alchilazione avviene in condizioni più miti rispetto agli idrocarburi aromatici.
Vari fattori, tra cui condizioni di reazione, catalizzatori e agenti alchilanti, influenzano la formazione di fenoli prevalentemente orto- o para-monoalchilati, 2,4- o 2,6-dialchilati e 2,4,6-trialchilati.
Temperature più elevate portano a meta isomeri termodinamicamente più stabili a causa di reazioni secondarie. Inoltre, basse temperature e concentrazioni di catalizzatore possono produrre quantità significative di eteri alchilarilici, mentre temperature più elevate, concentrazioni di catalizzatore e forza acida favoriscono la formazione predominante di alchilfenoli.
Nel processo di alchilazione vengono impiegati agenti alchilanti come olefine, alcoli e alogenuri alchilici. Sono stati sviluppati tre tipi principali di processi industriali per l’alchilazione del fenolo:
- L’alchilazione in fase liquida comporta l’aggiunta dell’agente alchilante a una soluzione o sospensione del catalizzatore nel fenolo. Dopo la reazione, il catalizzatore viene separato e qualsiasi catalizzatore residuo viene decomposto tramite neutralizzazione.
- I processi in fase liquida a letto fisso operano con i reagenti che passano sopra il catalizzatore in reattori tubolari a pressioni elevate, che vengono raffreddati esternamente.
- L’alchilazione in fase vapore comporta l’invio di fenolo e dell’agente alchilante, come metanolo o un’olefina, a un reattore a letto fisso che opera a 300-400 °C, con rimozione efficiente del calore di reazione.
Il recupero del prodotto comporta la distillazione, con fenoli non convertiti e agenti alchilanti riciclati e vari fenoli mono-, di- e trialchilati separati. La rimozione completa delle tracce di catalizzatore acido è fondamentale per prevenire reazioni collaterali durante la distillazione, come isomerizzazione, transalchilazione e disproporzione.
I processi in fase liquida utilizzano catalizzatori acidi di Lewis come AlCl3, BF3 o Al(C6H5O)3, acidi protonici come HF, H2SO4, H3PO4 o acido p-tolilsolfonico o resine a scambio ionico acide, come resine Nafion o polistireni solfonati.
I processi in fase vapore richiedono catalizzatori con elevata stabilità termica, come montmorilloniti, zeoliti come faujasite e ossidi metallici come γ-Al2O3, MgO, CaO e Fe2O3 – CrO3.
La regioselettività può essere controllata utilizzando diversi catalizzatori. Ad esempio, HF, BF3, Al2O3•SiO2 o resine a scambio ionico acide promuovono prevalentemente prodotti p-sostituiti quando si alchilano fenoli con olefine.
D’altro canto, Al(C6H5O)3, formato da fenolo e alluminio metallico, specialmente in presenza di tracce di sali di mercurio, porta quasi esclusivamente a prodotti 2-alchilati e 2,6-dialchilati. Questa selettività per l’ortoalchilazione è attribuita a uno stato di transizione a sei elementi che coinvolge fenolato di alluminio e un’olefina.
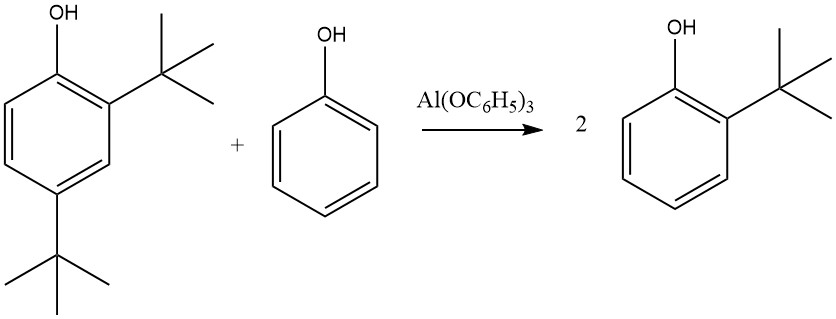
Altri sali metallici del fenolo, tra cui quelli di zinco, magnesio e calcio, possono anche attivare questa reazione, che non è limitata al fenolo; 2-naftolo, 2-cresolo o 4-cresolo possono anche essere alchilati da etilene, propene, buteni, cicloesene o altre olefine, con reattività variabile, dove l’isobutene mostra la reattività più elevata e l’etilene la più bassa.
In presenza di γ-Al2O3 come catalizzatore, è possibile ottenere un’elevata selettività per gli o-fenoli monoalchilati. Questo processo funziona a temperature elevate di 200-350 °C nella fase liquida a pressioni di 20-200 bar ed è adatto per il funzionamento continuo a letto fisso.
Per quanto riguarda i prodotti alchilfenoli, gli alchilfenoli vengono spesso prodotti in operazioni batch, offrendo una maggiore flessibilità. Tuttavia, per composti prodotti in grandi quantità, come cresoli, 2,6-xilenolo, 2-sec-butilfenolo, 4-terz-butilfenolo, ottilfenolo, nonilfenolo, dodecilfenolo, timolo o 2,6-di-terz-butil-4-metilfenolo, sono stati introdotti processi continui con capacità fino a 25.000 t/a ciascuno.
5.1. Alchilazione del fenolo con metanolo
L’alchilazione del fenolo con metanolo a temperature elevate e con un catalizzatore produce principalmente 2-cresolo (60-70% al 50% di conversione del fenolo e 300 °C) e 2,6-xilenolo, accompagnati da piccole quantità di 4-cresoli, 2,4- e 2,3-xilenoli e una piccola quantità di 3-cresolo.
La reazione può essere condotta sia in fase liquida che in fase di vapore. Nei processi in fase di vapore, i reagenti vengono introdotti a pressione atmosferica o leggermente elevata in un reattore tubolare con un catalizzatore a letto fisso a temperature comprese tra 300 e 450 °C.
Utilizzando Al2O3 attivato a 300 °C e MgO e CeO2 rispettivamente a 540 e 450 °C, si ottiene un’elevata selettività per 2-cresolo e 2,6-xilenolo. Tuttavia, utilizzando catalizzatori altamente acidi come ossido di alluminio, silicati di alluminio, zeoliti e fosfato di alluminio, specialmente a temperature più elevate, si ottiene una transalchilazione-isomerizzazione, con conseguente aumento della produzione di 3-cresolo e 4-cresolo.
I processi in fase liquida utilizzano catalizzatori come Al2O3, Al(OMe)3, Al(OC6H5)3 o ZnCl2 – HCl a pressioni elevate. In tutti i casi, il rapporto xilenolo:cresolo aumenta con il rapporto metanolo:fenolo, la temperatura e la pressione.
5.2. Alchilazione di fenoli con olefine
L’alchilazione del fenolo con metanolo viene effettuata a temperature elevate, in genere tra 320 e 340 °C, in presenza di 1-2% di Al(C6H5O)3 e a 200 bar, con conseguente formazione di 2-etilfenolo.
D’altra parte, l’alchilazione del fenolo con propene per produrre 2-isopropilfenolo può essere ottenuta a temperature inferiori di 280-300 °C utilizzando γ-Al2O3 come catalizzatore.
Inoltre, la propilazione dei cresoli per produrre timolo o carvacolo viene effettuata in processi continui in fase liquida utilizzando γ-Al2O3, silicati di alluminio o zeoliti. In condizioni simili, il 2-sec-butilfenolo può essere prodotto da fenolo e n-buteni.
La produzione di 2-terz-butilfenolo e 2,6-di-terz-butilfenolo può essere ottenuta a 100 °C sotto pressioni fino a 20 bar in presenza di Al(C6H5O)3, sfruttando l’elevata reattività dell’isobutene.
In alternativa, il 4-terz-butilfenolo può essere preparato a pressione atmosferica e temperature comprese tra 80 e 140 °C utilizzando H2SO4, H3PO4, BF3 o preferibilmente resine a scambio cationico acide.
L’importante antiossidante 2,6-di-terz-butil-4-metilfenolo è prodotto da 4-cresolo e isobutene a 70 °C utilizzando H2SO4 come catalizzatore. Allo stesso modo, l’alchilazione del fenolo con 2-metilbuteni a 100-120 °C in presenza di BF3 o H3PO4 produce 4-terz-amilfenolo e, con un eccesso di 2-metilbuteni, si forma 2,4-di-terz-amilfenolo.
Un importante processo commerciale comporta l’alchilazione del fenolo con olefine lineari o ramificate contenenti 6-20 atomi di carbonio, che portano ad alchilfenoli, che, dopo etossilazione e solfatazione, trovano ampia applicazione come detergenti anionici.
Diisobutene, tripropen e tetrapropene sono agenti alchilanti preferiti e la reazione è catalizzata in condizioni blande (50-85 °C) utilizzando BF3 in reattori a lotti continui o tubolari. Anche le resine a scambio cationico acide, come il polistirene solfonato macroreticolare, sono ottimi catalizzatori che facilitano la separazione del catalizzatore.
Per ottenere un migliore controllo della temperatura, la reazione può essere eseguita in due fasi, impiegando un catalizzatore di acidità ridotta nella prima fase. Chemische Werke H€uls (ora Degussa-H€uls) in Germania utilizza un processo di questo tipo per produrre nonilfenolo.
Nella prima fase di questo processo a letto fisso, la temperatura aumenta da 80 a 120 °C e nella seconda fase, aumenta da 110 a 130 °C. Anche i silicati di alluminio attivati possono fungere da catalizzatori, ma richiedono temperature di reazione più elevate e tempi di reazione più lunghi.
La produzione industriale di alchilfenoli, aloalchilfenoli e composti correlati è ampia e questi composti sono ampiamente utilizzati come inibitori dell’ossidazione, detergenti, battericidi, fungicidi, insetticidi e disinfettanti.
6. Alchilazione delle ammine aromatiche
A causa della basicità delle ammine aromatiche, i catalizzatori acidi non sono adatti alla loro alchilazione. Ad esempio, l’uso del catalizzatore Friedel-Crafts AlCl3 nella reazione dell’etilene con l’anilina produce prevalentemente prodotti resinosi non identificati con solo piccole quantità di 2-etilanilina.
Tuttavia, l’anilide di alluminio, Al(C6H5NH)3, formato in situ tramite il riscaldamento della polvere di alluminio in anilina con sviluppo di idrogeno, si dimostra un catalizzatore efficace per questa reazione. In condizioni di 300-340 °C e 200 bar, si ottiene la 2,6-dietilanilina dopo 2-3 ore, mentre tempi di reazione più brevi portano alla formazione di 2-etilanilina.
L’attività catalitica dell’anilide di alluminio è ulteriormente potenziata dall’aggiunta di catalizzatori Friedel-Crafts come AlCl3, SnCl4, TiCl4, SiCl4, BF3 o ZnCl2. Anche le miscele di metalli alcalini e AlCl3 nell’anilina mostrano attività, portando selettivamente alla N-alchilazione.
Questa reazione è stata estesa a varie aniline sostituite, tra cui 2-, 3- e 4-toluidina, 2,6-, 2,4- e 2,5-xilidina, 2-propilanilina, 2- e 3-cloroanilina e α-naftilammina. Inoltre, anche le diammine come m-fenilendiammina o 2,4-toluilendiammina, così come le ammine secondarie come la difenilammina, possono subire alchilazione.
Nel processo di alchilazione con olefine, la reattività diminuisce nell’ordine etilene > propene > 1-butene > isobutene, che è opposto all’ordine di reattività osservato nell’alchilazione del fenolo con catalizzatore Al(OC6H5)3.
In particolare, l’isobutene dimostra attività con catalizzatori Friedel-Crafts come AlCl3, BF3 o montmorillonite anche a 200-250 °C, ma con l’anilide di alluminio, la reazione procede lentamente. Quando si utilizza la montmorillonite, si verifica la formazione selettiva di 4-terz-butilanilina, mentre i catalizzatori BF3 o AlCl3 producono miscele degli isomeri 2 e 4.
Nell’alchilazione delle aniline con metanolo, i setacci molecolari agiscono come catalizzatori, dando origine a una miscela complessa contenente 2-toluidina, 2,6- e 2,4-xilidina e 2,4,6-trimetilanilina. A livello industriale, le 2,6-dialchilaniline, come la 2-etil-6-metilanilina, vengono prodotte come intermedi per erbicidi e coloranti.
7. Alchilazione di composti eteroaromatici e substrati correlati
Vari composti aromatici eterociclici, tra cui furani, tiofeni e N-eterocicli, possono essere sottoposti a reazioni di alchilazione, sebbene siano disponibili informazioni limitate sulle loro applicazioni commerciali.
Anche i derivati del ciclopentadienile subiscono l’alchilazione di Friedel-Crafts in modo simile ad altri composti aromatici.
7.1. Furano
Il furano mostra una maggiore reattività nelle alchilazioni di Friedel-Crafts rispetto al benzene. Tuttavia, i furani tendono a subire una rapida resinificazione in presenza di acidi, il che può complicare la separazione del prodotto.
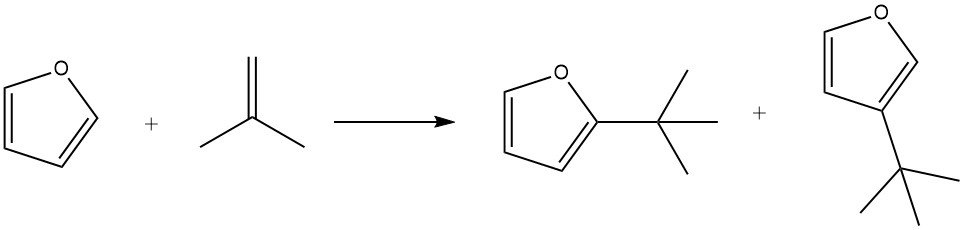
Utilizzando l’acido fosforico su kieselguhr come catalizzatore, il furano può essere efficacemente alchilato con isobutene a 100 °C entro 3 ore, con una resa dell’85% degli alchilati, insieme a piccole quantità di isoottene.
In condizioni miti (ad esempio, 50 °C per 1 ora), la sostituzione in posizione 2 è favorita. Tuttavia, tempi di reazione più lunghi (7 ore), temperature più elevate (150 °C) e maggiori concentrazioni di catalizzatore promuovono la formazione di prodotti sostituiti in posizione 3. Inoltre, durante il processo è stata osservata anche la formazione di 2,5-di-terz-butilfurano.
7.2. Tiofene
Il tiofene mostra una reattività significativamente più elevata nelle reazioni di Friedel-Crafts rispetto agli idrocarburi aromatici, consentendone l’alchilazione con varie olefine, tra cui propene, 1-butene, 2-metilbuteni, cicloesene e alcoli come alcol isopropilico e alcol terz-butilico.
Sono stati ottenuti risultati positivi utilizzando catalizzatori acidi come acido fosforico a 60 °C o silice di allumina a 200 °C. Tuttavia, l’uso di H2SO4, HF, BF3•OMe2 e AlCl3 ha causato reazioni collaterali. In tutti i casi, il tiofene è stato sostituito nella posizione 2 e sono stati prodotti anche prodotti a punto di ebollizione più alto, come composti dialchilati.
Inoltre, la rimozione del tiofene dalla benzina crackizzata durante la raffinazione con acido solforico concentrato a freddo è probabilmente una reazione di alchilazione. Le olefine presenti nella benzina agiscono come agenti alchilanti, portando alla formazione di alchiltiofeni altobollenti, che rimangono come residui durante la distillazione.
7.3. N-eterocicli
Gli N-eterocicli possono subire alchilazione in presenza di ammidi di alluminio come catalizzatori. Mentre i composti eterociclici come il carbazolo e l’indolo reagiscono lentamente con l’alluminio metallico per formare l’ammide, l’anilide di alluminio funge da catalizzatore efficace.
Ad esempio, quando il carbazolo reagisce con l’etilene in presenza di anilina e polvere di alluminio, produce 1-etilcarbazolo. Questa reazione avviene in un’autoclave a 280 °C e 200 bar.
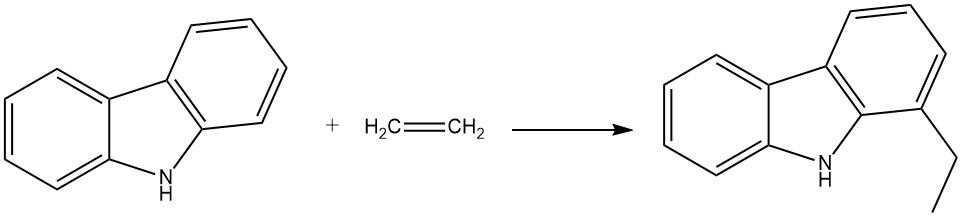
Anche il propene può reagire in condizioni simili per produrre 1-isopropilcarbazolo, sebbene con una resa leggermente inferiore.
La combinazione di carbazolo e propene con AlCl3 come catalizzatore a 90 – 100 °C determina la formazione di diisopropilcarbazolo. Un’altra reazione su un catalizzatore di silicato di alluminio a 180 – 200 °C produce tetra- e pentaisopropilcarbazolo. Inoltre, l’etilazione del pirrolo può essere ottenuta utilizzando un catalizzatore di silicato di alluminio a 200 – 370 °C.
7.4. Composti aromatici non benzenoidi
I composti aromatici non benzenoidi, come ferroceni, fulveni, azuleni, pseudoazuleni, indolizine e ciclazine, condividono somiglianze chimiche non solo con i sistemi benzenoidi ma anche con le olefine.
Le loro reazioni di sostituzione elettrofila si verificano in genere in condizioni più miti rispetto ai derivati del benzene. Tuttavia, a causa della loro stabilità relativamente bassa, è essenziale un’attenta selezione dei catalizzatori e delle condizioni di reazione.
Il ferrocene può subire alchilazione in presenza di acidi di Lewis, come AlCl3, con vari substrati tra cui metanolo, etile, isopropile, butile e alogenuri benzilici, 1,2-dicloroetano, etilene, propene e isobutene.
La reazione spesso porta a miscele complesse di prodotti omoannulari ed eteroannulari (dove entrambi gli anelli sono alchilati), poiché il sistema diventa più reattivo dopo il primo passaggio di alchilazione.
L’alchilazione del ferrocene con olefine sembra essere più favorevole, come la reazione con isobutene, che si verifica anche a temperatura ambiente. A temperature più elevate (100-150 °C), si ottiene il tri-terz-butilferrocene eteroanulare con una resa del 44%, insieme a un po’ di tetra-terz-butilferrocene. L’impedimento sterico impedisce l’attacco di più di due sostituenti terz-butile allo stesso anello ciclopentadienilico.
8. Reazioni di alchilazione varie
L’alchilazione di composti aromatici mediante reagenti bi- o polifunzionali determina la formazione di una vasta gamma di preziosi prodotti mono-, di- o polinucleari con significative applicazioni commerciali.
8.1. Aloalchilazioni
In condizioni di reazione idonee, le aloalchilazioni di composti aromatici con agenti alchilanti bi- o polifunzionali possono produrre prodotti di aloalchilazione primari evitando al contempo cicloalchilazioni indesiderate o legami di più nuclei.
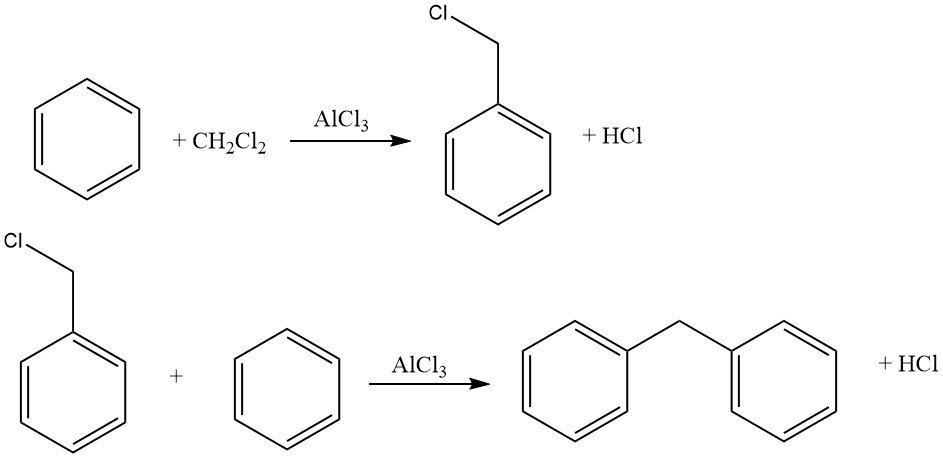
Gli agenti aloalchilanti comuni includono aldeide-alogenuro di idrogeno, eteri aloalchilici, aloalcoli e composti simili. Questo processo consente l’alometilazione, l’aloetilazione, l’aloalchilazione superiore, nonché la bis- e la polialchilazione.
La reazione è spesso catalizzata dal cloruro di zinco, ma possono essere utilizzati anche altri catalizzatori come gli alogenuri acidi (ad esempio, ZnCl2 – AlCl3, SnCl4, AlCl3–chetoni, AlCl3 – piridina) o acidi protonici (HCl, H2SO4, H3PO4, acido p-toluensolfonico).
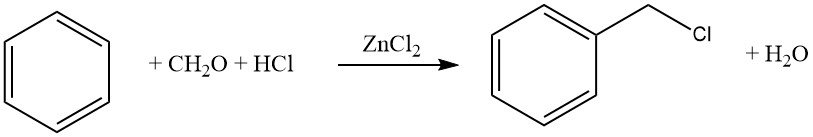
Un esempio comune di questa reazione è la clorometilazione utilizzando formaldeide–HCl (reazione di Blanc). Sebbene questa reazione sia sinteticamente preziosa, è necessario prestare attenzione a causa della formazione di intermedi reattivi, in particolare eteri clorometilici, che sono altamente cancerogeni.
8.2. Idrossialchilazione
L’idrossialchilazione di composti aromatici utilizzando aldeidi e chetoni in presenza di acidi è di notevole importanza industriale. Gli elettrofili che attaccano il nucleo aromatico sono formati dalla reazione di aldeidi o chetoni con acidi di Lewis o protonici (dove R, R0 = H, alchile, arile).
La reazione determina la formazione di un alcol benzilico sostituito. In condizioni acide, questo alcol reagisce con un’altra molecola del composto aromatico per produrre un diarilmetano sostituito.
Un esempio notevole di questa reazione è l’idrossialchilazione del fenolo con acetone, che produce 2,2-bis-(4-idrossifenil)propano, comunemente noto come bisfenolo A. Questo composto è prodotto industrialmente in processi continui utilizzando acido solforico (o HCl secco nel processo Hooker) come catalizzatore e metilmercaptano come promotore, con conseguenti rese quasi quantitative a 50 °C.
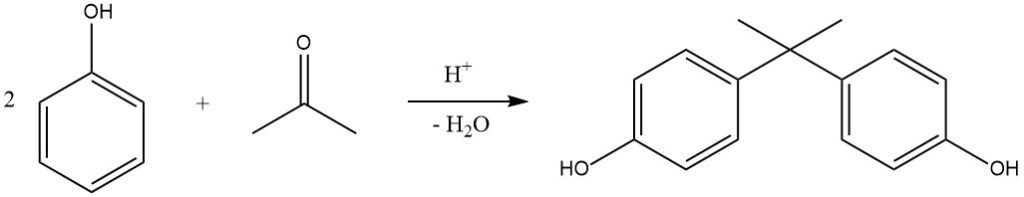
Le resine a scambio cationico sono sempre più utilizzate come catalizzatori grazie al loro processo di separazione semplificato. Il bisfenolo A è utilizzato principalmente per la produzione di resine epossidiche e in policarbonato.
Le idrossialchilazioni sono altamente versatili, consentendo a numerose aldeidi e chetoni sostituiti con alchil e aril di reagire con vari composti aromatici. Ad esempio, l’insetticida DDT è prodotto da cloralio e clorobenzene. La reazione del fenolo con formaldeide porta a idrossimetilfenoli, che possono ulteriormente condensarsi per formare resine fenoliche a temperature elevate.
Quando gli ossirani (epossidi) vengono utilizzati come agenti alchilanti, si ottengono composti aromatici β-idrossialchilici. Ad esempio, la reazione del benzene con ossido di etilene in presenza di una quantità stechiometrica di AlCl3 porta a un alcossido di alluminio che, per idrolisi, produce β-feniletanolo.
8.3. Amidometilazione
L’amidometilazione, nota anche come reazione di Tscherniac-Einhorn, è un processo in cui le N-idrossimetilammidi o le immidi corrispondenti reagiscono con composti aromatici in condizioni blande in presenza di acido solforico. Questa reazione consente l’introduzione di un gruppo amidometilico nel nucleo aromatico.
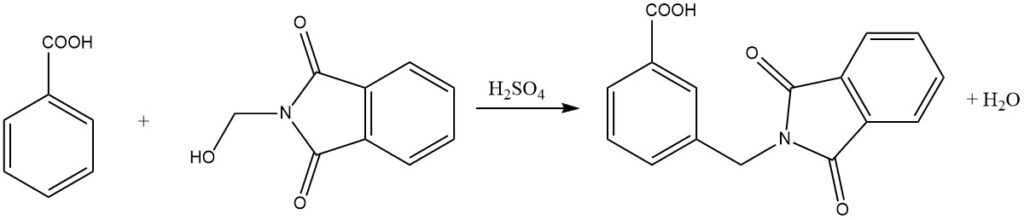
Inoltre, anche i composti aromatici meno reattivi, come gli acidi benzoici, possono subire ammidoalchilazione attraverso questo processo. Sorprendentemente, anche i composti aromatici nitro-sostituiti possono essere alchilati utilizzando ammidi di acido N-clorometilcarbossilico in presenza di AlCl3 come catalizzatore.
Riferimento
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185




