Acroléine : réactions, production et utilisations
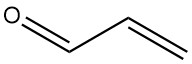
L’acroléine, également appelée propénal ou acrylaldéhyde, est l’aldéhyde insaturé le plus simple. C’est un liquide volatil et incolore avec une forte odeur à la fois toxique et déchirante.
La découverte de l’acroléine, qui tire son nom des mots latins « acer » signifiant âcre et « oléum » signifiant huile, peut être attribuée à Redtenbacher en 1843. Elle a été trouvée dans de la graisse surchauffée.
En 1942, Degussa a établi une méthode de production commerciale d’acroléine par la condensation en phase gazeuse catalysée de manière hétérogène d’acétaldéhyde et de formaldéhyde. Actuellement, l’acroléine est principalement fabriquée à grande échelle par l’oxydation en phase gazeuse catalysée de manière hétérogène du propène.
Table des matières
1. Propriétés physiques de l’acroléine
L’acroléine a une solubilité limitée dans l’eau mais est soluble dans divers solvants organiques, y compris les alcools, les éthers et les hydrocarbures aliphatiques ou aromatiques. Les propriétés physiques essentielles de l’acroléine sont présentées ci-dessous :
| Propriété | Valeur |
|---|---|
| Masse molaire | 56,06 g/mol |
| Point d'ébullition (pb) | 52-53 °C |
| Point de fusion (mp) | -87 °C |
| Densité relative | 0,838 g/cm³ |
| Indice de réfraction | 1.418 |
| Viscosité | 0,40 cP à 25 °C |
| Solubilité dans l'eau | 260 g/kg |
| Pression de vapeur | 29 kPa à 20 °C |
| Température d'auto-inflammation dans l'air | 234 °C |
| Point d'éclair | -26 °C |
2. Réactions chimiques de l’acroléine
L’acroléine présente une réactivité élevée en raison de ses groupes vinyle et aldéhyde conjugués, ce qui lui fait subir des réactions caractéristiques à la fois des composés insaturés et des aldéhydes.
La conjugaison entre la double liaison carbone-carbone et le groupe carbonyle améliore la réactivité des deux groupes, leur permettant de réagir ensemble ou séparément.
Il convient de noter que l’acroléine peut subir une polymérisation spontanée hautement exothermique.
2.1. Réaction de Diels-Alder
L’acroléine agit à la fois comme diène et comme diénophile, permettant la formation d’un dimère cyclique appelé 3,4-dihydro-2H-pyran-2-carboxaldéhyde. Ce dimère est produit par la réaction thermique non catalysée de l’acroléine à environ 190°C (1 heure pour 75% de conversion de l’acroléine), avec la formation de sous-produits polymères.
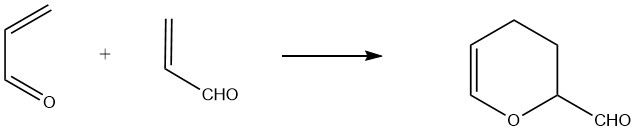
Pour obtenir des rendements élevés, une stabilisation avec de l’hydroquinone ou des composés complexants comme des acides organiques polyvalents est nécessaire.
Le « dimère thermique » résultant est un liquide clair avec une odeur désagréable, bouillant à 151,3°C à 101,3 kPa et ayant une densité relative de 1,0775. L’hydrolyse acide du dimère donne du 2-hydroxyadipaldéhyde, qui peut être encore hydrogéné pour former du 1,2,6-hexanetriol.
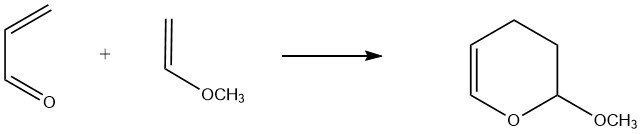
L’acroléine agit comme un 1,3-diène dans les réactions avec des diénophiles où la densité électronique de la double liaison carbone-carbone est augmentée par des substituants libérant des électrons. Par exemple, l’acroléine réagit facilement avec les éthers vinyliques et les vinylamines pour former des dihydropyranes.
Un exemple commercial significatif est la réaction entre l’éther méthylvinylique et l’acroléine, conduisant à la formation de 3,4-dihydro-2-méthoxy-2H-pyrane. Les rendements rapportés pour cette réaction à des températures de 160 à 190°C vont de 80 % à 90 %.
2.2. Ajout à la double liaison carbone-carbone
L’atome de carbone β de l’acroléine, polarisé par le groupe carbonyle, agit comme un électrophile. Par conséquent, des réactifs nucléophiles tels que des alcools, des thiols, de l’eau, des amines, des composés méthylène actifs et des acides inorganiques et organiques peuvent s’ajouter à la double liaison carbone-carbone en présence de catalyseurs acides ou basiques.
Des conditions soigneusement contrôlées sont essentielles pour minimiser les réactions secondaires indésirables. L’ajout d’eau dans des conditions légèrement acides conduit à la formation de 3-hydroxypropionaldéhyde (HPA) avec une sélectivité élevée.
Des solutions tampons avec un pH de 4-5 ou des résines échangeuses d’ions faiblement acides sont souvent utilisées comme catalyseurs. Une hydrogénation supplémentaire des solutions aqueuses donne du 1,3-propanediol.
Les catalyseurs de métaux précieux facilitent l’oxydation directe de solutions aqueuses de HPA à pH 3, produisant de l’acide 3-hydroxypropionique. Au-dessus de pH 7, l’anion malonate se forme avec un rendement élevé.
L’acroléine réagit rapidement avec le chlorure d’hydrogène ou le bromure d’hydrogène pour donner du 3-chloropropionaldéhyde ou du 3-bromopropionaldéhyde. Cependant, ces produits polymérisent facilement en trimères et tétramères en présence d’acides. Pour obtenir des acétals de 3-halopropionaldéhyde, un procédé simultané d’addition d’halogénure d’hydrogène et d’acétalisation est préféré, ce qui donne des rendements en acétal d’environ 90 %.
Le chlore et le brome peuvent s’ajouter à l’acroléine en solution aqueuse diluée, formant des 2,3-dihalopropionaldéhydes avec des rendements d’environ 85 %. Ces dihalopropionaldéhydes peuvent être déshydrohalogénés pour produire des 2-haloacroléines.
Les 2-haloacroléines sont connues pour être de puissants mutagènes et peuvent être davantage halogénées pour donner des 2,2,3-trihalopropionaldéhydes, qui sont des intermédiaires précieux dans la synthèse de l’acide folique.
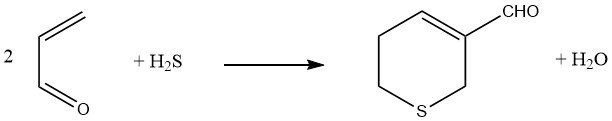
Le sulfure d’hydrogène, lorsqu’il est ajouté à deux équivalents d’acroléine suivi d’une réaction d’aldolisation, entraîne la formation de 3-formyl-5,6-dihydrothiopyrane.
Le méthanethiol subit une addition catalysée par une base à l’acroléine, conduisant à la formation de 3-(méthylthio)propionaldéhyde, qui est une réaction importante utilisée dans la synthèse de l’acide aminé essentiel D,L-méthionine.
2.3. Réactions du groupe aldéhyde
La sélectivité de l’acétalisation catalysée par un acide dépend de la nature de l’alcool utilisé et des catalyseurs employés. Des réactions secondaires peuvent produire des 3-alcoxypropionaldéhydes et des 3-alcoxypropionaldéhydes acétals correspondants.
Les acétals cycliques, en particulier ceux formés avec des diols ramifiés comme le 2-méthyl-1,3-propanediol, sont plus faciles à obtenir que les acétals acycliques d’alcools inférieurs. Divers procédés continus sont connus pour la préparation d’acétals cycliques, avec des rendements de plus de 90 % réalisables grâce à des procédés spéciaux en combinaison avec l’extraction.
Les acétals d’acroléine servent d’intermédiaires précieux et ont suscité un intérêt en tant que formes plus sûres pour le transport de l’acroléine, en particulier du 2-vinyl-1,3-dioxolane. Ces acétals peuvent être facilement clivés en acroléine dans des solutions aqueuses acides, qui trouvent une utilité dans l’utilisation de l’acroléine comme herbicide aquatique et comme piégeur de sulfure d’hydrogène dans les eaux des champs pétrolifères.
Spiro diacétal, diallylidène pentaérythritol, préparé en condensant du pentaérythritol avec deux moles d’acroléine, peut être polymérisé avec du vinyle ou d’autres monomères pour former des résines de spirane.
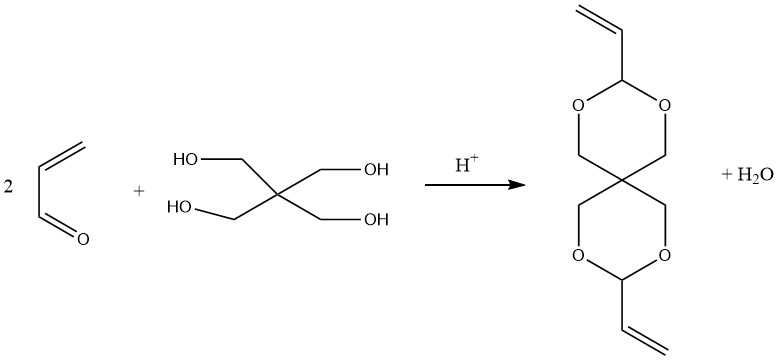
L’hydroformylation des acétals d’acroléine, en particulier des acétals cycliques, conduit aux monoacétals du 1,4-butanedial. L’hydrolyse et l’hydrogénation ultérieures de ce produit d’hydroformylation conduisent à la production de 1,4-butanediol.
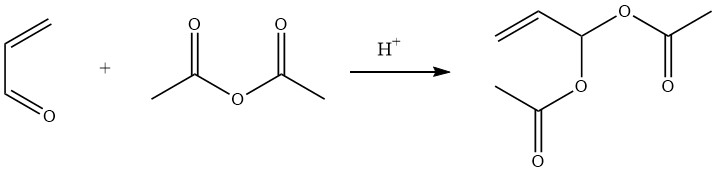
Le diacétate d’acroléine, également connu sous le nom de diacétate de 2-propène-1,1-diol, est facilement préparé avec un rendement de 90% par la réaction catalysée par un acide de l’anhydride acétique avec l’acroléine.
Lorsque du cyanure d’hydrogène est ajouté à l’acroléine en présence de catalyseurs alcalins doux, la cyanohydrine d’acroléine se forme avec des rendements supérieurs à 90 %. L’acétate de cyanohydrine d’acroléine, obtenu par sa réaction avec l’anhydride acétique, sert d’intermédiaire précieux dans la synthèse de substances pharmaceutiquement et biologiquement actives.
2.4. Réaction simultanée des groupes aldéhyde et vinyle
Bien que l’acroléine et la méthacroléine soient reconnues comme intermédiaires dans la synthèse Skraup des quinoléines à partir d’amines aromatiques et de glycérol, leur utilisation commerciale comme matières premières pour cette réaction reste limitée.
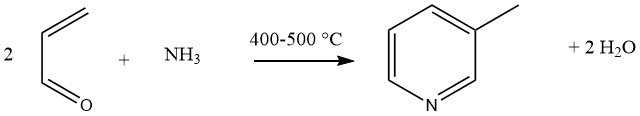
La condensation en phase gazeuse de l’acroléine et de l’ammoniac, catalysée par des catalyseurs multicomposants Al2O3 ou SiO2-Al2O3, donne 45 % de 3-méthylpyridine et 20 à 25 % de pyridine comme sous-produit. Cette réaction a été généralisée comme une synthèse universelle pour les pyridines substituées.
L’acroléine réagit avec l’acide isocyanurique pour former un produit d’addition utile comme agent de réticulation. La réactivité bifonctionnelle de l’acroléine a été exploitée dans diverses synthèses d’hétérocycles, telles que les réactions avec des phénols pour donner des chromènes ou des chromanes substitués, et la réaction avec des 2-aminophénols pour produire des 8-quinoléinols.
Lorsque l’acroléine est mise à réagir avec un excès de phénol dans des conditions acides, un mélange de polyphénols est obtenu, avec le 1,1,3-tris(4-hydroxyphényl)propane comme produit primaire.
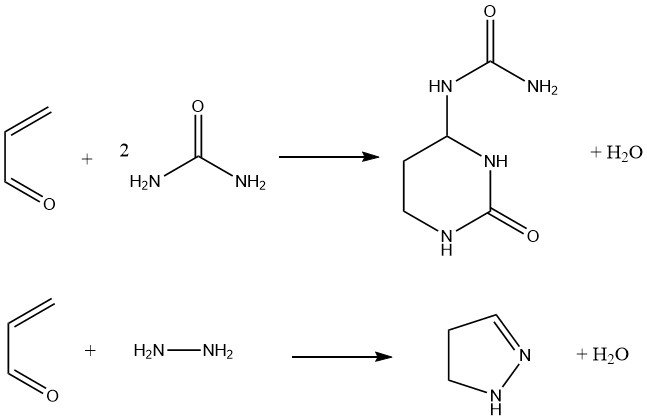
De plus, l’acroléine réagit avec l’urée pour donner de l’urée hexahydro-2-oxo-4-pyrimidinyle, qui a été proposée comme engrais. La condensation de l’acroléine avec l’hydrazine et les hydrazines substituées donne des pyrazolines avec un rendement de 80 %.
L’acroléine peut être mise à réagir avec du formaldéhyde dans des conditions alcalines pour produire du pentaérythritol. Cependant, les rendements sont inférieurs par rapport à la synthèse commerciale du pentaérythritol via l’acétaldéhyde et le formaldéhyde.
Le bisulfite de sodium réagit avec l’acroléine pour former un adduit stable appelé sel disodique de l’acide 1-hydroxypropane-1,3-disulfonique. Cette réaction trouve une application commode pour la désodorisation de l’acroléine déversée.
2.5. Réduction
La réduction sélective de l’acroléine en alcool allylique avec des rendements élevés (90%) peut être obtenue par transfert d’hydrogène à partir d’alcools secondaires, tels que le 2-propanol, dans une réaction de Meerwein-Ponndorf en phase liquide.
En phase gazeuse, le transfert d’hydrogène de l’éthanol ou du 2-propanol sur des catalyseurs à base d’oxyde de magnésium ou d’oxyde de terre rare à des températures allant de 300 à 500°C conduit également à la production d’alcool allylique.
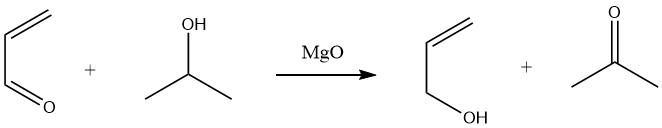
Cependant, l’hydrogénation catalytique de l’acroléine est moins sélective ou seulement sélective à de très faibles conversions.
2.6. Oxydation
En faisant réagir l’acroléine avec du peroxyde d’hydrogène aqueux à pH 8-8,5, le glycidaldéhyde peut être obtenu avec des rendements de 80 à 90 % :
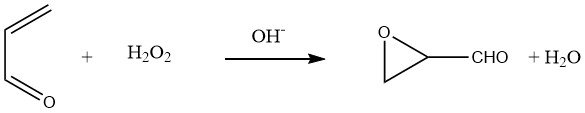
L’hydratation du groupe oxirane dans le glycidaldéhyde conduit à une solution aqueuse de D,L-glycéraldéhyde.
L’acide acrylique est produit commercialement par oxydation de l’acroléine avec de l’oxygène moléculaire.
2.7. Polymérisation
L’acroléine polymérise facilement lorsqu’elle est chauffée, exposée à la lumière ou en présence de divers initiateurs. Les propriétés du polymère d’acroléine résultant dépendent des conditions de polymérisation, telles que le type d’initiateur, le solvant et la température de réaction.
Les groupes fonctionnels de l’acroléine (vinyle et aldéhyde) peuvent polymériser séparément ou ensemble. La polymérisation radicalaire se produit exclusivement au niveau du groupe vinyle, ce qui donne des polymères avec des groupes aldéhyde qui forment facilement des structures de tétrahydropyrane. La polymérisation ionique donne principalement des polymères avec des groupes vinyle, ainsi que des polymères contenant à la fois des groupes aldéhyde et vinyle.
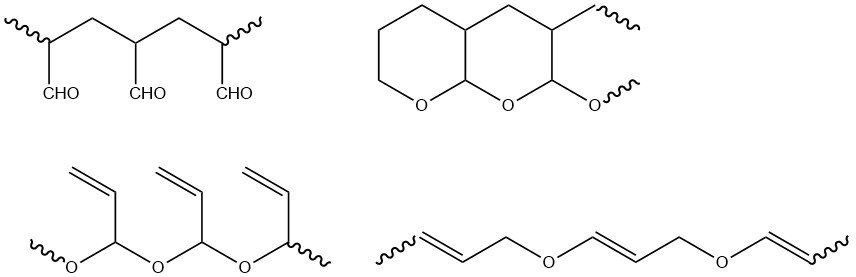
Les polymères radicalaires sont infusibles et insolubles dans les solvants courants, tandis que les produits d’initiation anionique sont solubles dans de nombreux solvants organiques. Outre les homopolymères, des copolymères avec divers comonomères vinyliques et acryliques ont été synthétisés.
Les groupes carbonyle de la polyacroléine peuvent être modifiés chimiquement dans des conditions douces. De nombreux dérivés de polyacroléine sont solubles dans les solvants organiques ou même dans l’eau. Ces polymères ont suscité l’intérêt en raison de leur activité biocide, car l’acroléine en est lentement libérée.
La méthode photochimique (laser) a été utilisée pour synthétiser des particules ultrafines à partir de mélanges gazeux d’acroléine et de certains composés organosiliciés. Les particules de polyacroléine sont explorées pour leurs applications potentielles en nanotechnologie.
3. Production d’acroléine
3.1. Acroléine par oxydation du propène
Le premier procédé commercial de production d’acroléine a été développé par Degussa en 1942. Il impliquait la condensation en phase vapeur d’acétaldéhyde et de formaldéhyde, catalysée par du silicate de sodium sur des supports de silice à des températures de 300 à 320°C.
Cette méthode a été utilisée jusqu’en 1959 lorsque Shell a introduit un nouveau procédé basé sur l’oxydation en phase vapeur du propène sur un catalyseur d’oxyde cuivreux. Cependant, les performances du catalyseur dans ce procédé étaient médiocres.
En 1957, Standard Oil of Ohio (Sohio) a découvert le système de catalyseur au molybdate de bismuth, qui présentait une sélectivité améliorée mais avait toujours une faible conversion du propène.
L’oxydation du propène en acroléine a pris de l’ampleur avec la découverte du système molybdate de bismuth-phosphomolybdate de bismuth (Bi9PMo12O52 sur un support SiO2) par Sohio. Les catalyseurs commerciaux comprennent également des oxydes de bismuth-molybdène.
La catalyse de l’oxydation du propène en acroléine implique deux cycles de réaction : un cycle de réduction du catalyseur (formation sélective de produits) et un cycle de réoxydation du catalyseur (régénération réseau-oxygène). Les sites actifs des catalyseurs sont des interfaces entre Fe2(MoO4)3 et β-CoMoO4, le molybdate de bismuth étant responsable de la sélectivité.
Les catalyseurs modernes pour la production d’acroléine sont des systèmes d’oxydes métalliques à plusieurs composants.
L’optimisation de ces systèmes catalytiques est un défi permanent, diverses entreprises chimiques travaillant en permanence à l’amélioration des compositions catalytiques et des techniques de préparation. Des oxydes métalliques supplémentaires tels que Co, Ni, P, Sb, W ou K sont ajoutés pour équilibrer les propriétés redox du catalyseur et améliorer ses performances.
Dans les processus de production actuels, le propène est mélangé avec de l’air et de la vapeur et introduit dans un réacteur à lit fixe multitubulaire fonctionnant à des températures de 300 à 400°C. L’effluent du réacteur est ensuite trempé et le gaz est lavé avec de l’eau ou des mélanges eau/solvant pour éliminer les sous-produits.
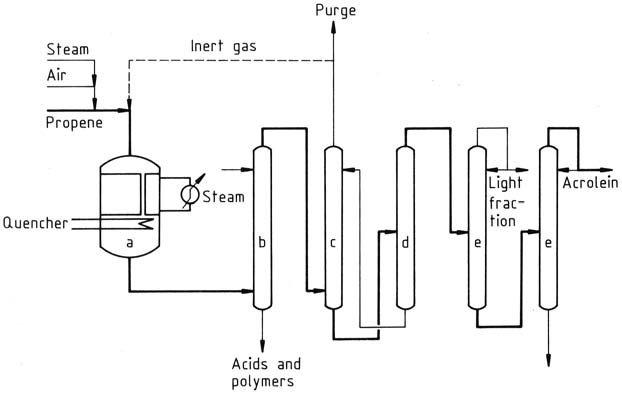
L’acroléine est obtenue en absorbant le gaz dans de l’eau froide dans un absorbeur. La solution aqueuse d’acroléine est ensuite traitée dans une colonne de désorption pour obtenir de l’acroléine brute, qui est ensuite distillée pour purifier le produit.
Les nouveaux développements dans la production d’acroléine se concentrent sur l’amélioration de la sélectivité et du rendement du catalyseur tout en réduisant la consommation d’énergie et les émissions de CO2.
Des voies alternatives à l’acroléine à partir du propane sont à l’étude, et la combinaison de la déshydrogénation du propane et de l’oxydation sélective du propène en acroléine est à l’étude.
Le procédé du méthanol en propène (MTP), utilisant le méthanol comme matière première pour la production de propène, gagne également en importance dans l’industrie chimique.
4. Utilisations de l’acroléine
L’acroléine a une large gamme d’utilisations en tant qu’intermédiaire chimique dans diverses industries. Certaines des principales utilisations de l’acroléine comprennent :
1. Biocide : L’acroléine est utilisée comme biocide à large spectre très efficace à de faibles concentrations, autour de 10 ppm. Il est utilisé pour contrôler la croissance des mauvaises herbes aquatiques, des algues, des mollusques et comme désinfectant dans les systèmes d’eau. Il est également utilisé dans les eaux des champs pétrolifères pour éliminer le sulfure d’hydrogène malodorant.
2. Production de méthionine : L’acroléine est principalement utilisée dans la production de méthionine, qui est un acide aminé essentiel et un complément alimentaire pour animaux. L’acroléine est également utilisée pour produire l’hydroxyanalogue de la méthionine, qui est un complément alimentaire dont la bioefficacité est légèrement inférieure à celle de la méthionine.
3. Acide acrylique : L’acroléine est un précurseur pour la production d’acide acrylique, qui est un produit chimique important utilisé pour fabriquer des acrylates. L’acide acrylique est largement utilisé dans la fabrication de revêtements, d’adhésifs, de textiles et de divers polymères.
4. 1,3-propanediol : L’acroléine peut être utilisée pour produire du 1,3-propanediol par un processus d’hydrolyse et d’hydrogénation. Le 1,3-propanediol trouve des applications dans la production de matériaux composites, d’adhésifs, de solvants et d’antigel.
5. Glutaraldéhyde : L’acroléine est utilisée dans la production de glutaraldéhyde, qui est un dialdéhyde polyvalent. Le glutaraldéhyde est utilisé dans le tannage du cuir, le traitement de l’eau, les applications pétrolières et comme désinfectant et stérilisateur pour les équipements médicaux.
6. Pyridines : L’acroléine peut être utilisée pour synthétiser divers dérivés de pyridine, notamment la 3-méthylpyridine et d’autres pyridines substituées, qui ont des applications dans les industries pharmaceutique, des pesticides et des parfums.
7. Tétrahydrobenzaldéhyde : L’acroléine peut être utilisée dans la production de tétrahydrobenzaldéhyde, qui est utilisé dans la synthèse de produits pharmaceutiques, de fongicides et de parfums.
8. Arômes et parfums : L’acroléine et ses dérivés sont utilisés dans la production d’une large gamme d’arômes et de parfums, y compris des composés comme le lyral, le myrac aldéhyde et le 5-norbornène-2-carbaldéhyde.
9. Herbicides : L’acétate de cyanohydrine d’acroléine est utilisé comme intermédiaire dans la production de phosphinotrycine, un herbicide non sélectif utilisé dans la protection des cultures.
10. Autres applications : L’acroléine a été utilisée dans le passé pour la production d’alcool allylique et de glycérol, mais ces procédés ont été abandonnés. Il peut également être utilisé pour produire du D,L-glycéraldéhyde, qui a des applications dans le tannage du cuir et diverses synthèses. Les polymères d’acroléine, tels que le poly(acide aldéhyde carboxylique), ont des applications industrielles en tant qu’agents séquestrants, traitements textiles, renforcement du papier et biocides.
Ce ne sont là que quelques-unes des principales utilisations de l’acroléine, et sa polyvalence en tant qu’intermédiaire chimique permet des applications potentielles dans diverses industries.
Référence
- Acrolein and Methacrolein; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_149.pub2
FAQ: Acrolein
L’acroléine est un composé organique volatil (COV) qui est un liquide incolore avec une odeur piquante. C’est un aldéhyde insaturé de formule chimique C3H4O.
L’acroléine a diverses applications industrielles. Il est principalement utilisé comme intermédiaire chimique pour la production de méthionine, d’acide acrylique, de 1,3-propanediol, de glutaraldéhyde, de pyridines, d’arômes et de parfums. Il est également utilisé comme biocide dans le traitement de l’eau, les applications pétrolières et comme désinfectant pour les équipements médicaux.
L’acroléine est formée par la condensation en phase vapeur d’acétaldéhyde et de formaldéhyde, catalysée par du silicate de sodium sur des supports de silice. Il peut également être produit par l’oxydation en phase vapeur du propène sur un catalyseur d’oxyde cuivreux.
Oui, l’acroléine est toxique. Il est considéré comme un composé hautement irritant et corrosif. L’inhalation ou l’exposition à l’acroléine peut provoquer une irritation des voies respiratoires, une irritation des yeux, des brûlures de la peau et d’autres effets sur la santé. Il est important de manipuler l’acroléine avec les précautions de sécurité appropriées et dans des zones bien ventilées.
Lorsque vous travaillez avec de l’acroléine, il est essentiel de porter un équipement de protection individuelle (EPI) approprié. Cela comprend généralement des gants résistants aux produits chimiques, des lunettes ou un écran facial, une blouse de laboratoire ou des vêtements résistants aux produits chimiques et des chaussures fermées. Un respirateur peut être nécessaire selon la concentration et la durée de l’exposition.
L’acroléine peut être trouvée dans diverses sources, à la fois naturelles et anthropiques. Il peut se former lors de la combustion de matières organiques, telles que la fumée de tabac, les gaz d’échappement des véhicules et les émissions industrielles. Il est également produit par certaines plantes comme mécanisme de défense. De plus, l’acroléine peut être présente dans certains aliments, en particulier lors du chauffage ou de la friture des graisses et des huiles.
