
Les aminophénols ont acquis une importance commerciale significative, à la fois en tant que substances autonomes et en tant que composants cruciaux dans les secteurs de la chimie et des colorants.
Ces composés possèdent des propriétés amphotères présentant des caractéristiques d’acides faibles ou de bases faibles, la nature basique prédominant généralement.
Notamment, le 2-aminophénol et le 4-aminophénol peuvent facilement subir une oxydation, une caractéristique qui contribue à leurs applications principales en tant que révélateurs photographiques. Cependant, le 3-aminophénol reste relativement stable lorsqu’il est exposé à l’air et ne s’oxyde pas.
Table des matières
1. Propriétés physiques des aminophénols
Les structures de base des aminophénols existent dans trois configurations isomères distinctes, déterminées par la disposition spatiale des groupes hydroxyle et amino adjacents au cycle benzénique. Ces composés se solidifient généralement en structures cristallines à température ambiante normale.
Les composés aminophénols disponibles sur le marché sont généralement impurs en raison d’une contamination potentielle par des sous-produits d’oxydation. En conséquence, ils peuvent présenter des teintes allant du jaune-brun au rose-violet, les 2- et 4-aminophénols étant plus vulnérables à cette altération de couleur que l’isomère 3.
1.1. Propriétés physiques du 2-aminophénol
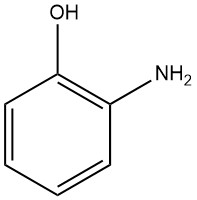
Le 2-aminophénol, également connu sous le nom de 2-hydroxyaniline ou 2-amino-1-hydroxybenzène, a la formule chimique C6H7NO, une masse molaire de 109,13 g/mol. Lorsqu’il est cristallisé dans l’eau ou le benzène, il forme des aiguilles bipyramidales orthorhombiques blanches.
Le point de fusion de ces cristaux est de 174°C et leur densité est d’environ 1,328 g/cm3 (1,29 g/cm3 est également mentionné dans certaines sources). Sous pression réduite (1,47 kPa), le 2-aminophénol se sublime rapidement à 153°C sans décomposition.
Concernant ses propriétés acido-basiques, les constantes de dissociation sont les suivantes : pK1 est de 4,72 à 21°C dans l’eau, et de 4,66 à 25°C dans une solution à 1% d’éthanol dans l’eau ; Le pK2 est de 9,66 à 15°C et de 9,71 à 22°C dans l’eau.
Le composé peut former divers sels, y compris le sel de chlorhydrate, qui apparaît sous forme d’aiguilles et a un point de fusion de 207°C ; le formiate qui fond à 120°C ; le sel d’oxalate, qui se décompose à 167,5°C ; et le sel d’acétate, qui fond à 150°C.
Le 2-aminophénol est très soluble dans l’acétone, l’acétonitrile, le diméthylsulfoxyde, l’éthanol et l’acétate d’éthyle, soluble dans l’eau chaude et l’éther diéthylique et légèrement soluble dans le chloroforme, le benzène, le toluène et l’eau froide.
1.2. Propriétés physiques du 3-aminophénol

Le 3-aminophénol, également appelé 3-hydroxyaniline ou 3-amino-1-hydroxybenzène, a la formule chimique C6H7NO avec une masse molaire de 109,13 g/mol. Ce composé forme des prismes blancs lors de la cristallisation dans l’eau ou le toluène, et son point de fusion se situe entre 122 et 123°C.
Les cristaux orthorhombiques présentent un arrangement tétramoléculaire et possèdent une densité d’environ 1,195 g/cm3 (des valeurs alternatives de 1,206 et 1,269 ont également été rapportées). Lorsqu’il est soumis à une pression réduite (1,47 kPa), le 3-aminophénol bout à 164°C avec une légère décomposition.
Concernant ses propriétés acido-basiques, les constantes de dissociation sont les suivantes : pK1 est de 4,17 à 21°C dans l’eau, et de 4,31 à 25°C dans une solution contenant 1% d’éthanol aqueux ; pK2 est de 9,87 à 22°C dans l’eau.
Le 3-aminophénol peut former divers sels, dont le sel chlorhydrate, qui prend la forme de prismes et fond à 229°C ; le sel de bromhydrate, également prismatique, avec un point de fusion de 224°C ; le sel d’iodhydrate, également prismatique, de point de fusion 209°C ; le sel de sulfate se présentant sous forme de plaques ou d’aiguilles et fondant à 152°C ; et le sel d’oxalate, avec un point de fusion de 275°C.
Le 3-aminophénol est très soluble dans l’acétone, l’acétonitrile, le diméthylsulfoxyde, l’éthanol, l’acétate d’éthyle et l’eau chaude, soluble dans l’eau froide et l’éther diéthylique et légèrement soluble dans le chloroforme, le benzène et le toluène.
1.3. Propriétés physiques du 4-aminophénol
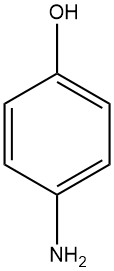
Le 4-aminophénol, connu sous le nom de 4-hydroxyaniline ou 4-amino-1-hydroxybenzène, a une formule chimique C6H7NO avec un poids moléculaire de 109,13 g/mol. Il prend la forme de plaques blanches lors de la cristallisation dans l’eau et a une plage de fusion de 189 à 190°C (la décomposition se produit).
Les cristaux existent sous deux formes distinctes. La forme « α » plus stable (obtenue à partir d’alcool, d’eau ou d’acétate d’éthyle) a une structure pyramidale orthorhombique avec quatre molécules dans chaque cellule unitaire. Il a une densité d’environ 1,290 g/cm3 (alternativement, 1,305 g/cm3 est rapporté).
La forme « β » moins stable (cristallisation à partir d’acétone) se présente sous forme de cristaux aciculaires, qui se transforment en forme « α » avec le temps. Les cristaux de la forme « β » sont orthorhombiques bipyramidal ou pyramidal et présentent un arrangement hexamoléculaire.
A pression réduite (40 Pa), le 4-aminophénol se sublime à 110°C avec une légère décomposition. Les points d’ébullition sous diverses pressions sont les suivants : 284 °C (101,3 kPa), 174 °C (1,47 kPa), 167 °C (1,07 kPa), 150 °C (0,4 kPa) et 130,2 °C (0,04 kPa). avec une décomposition qui se produit généralement.
Les constantes de dissociation acide-base pour ce composé sont les suivantes : pK1 est de 5,50 à 21°C dans l’eau, 4,86 à 30°C dans l’eau et 5,48 dans une solution contenant 1 % d’éthanol aqueux à 25°C ; pK2 est de 10,30 à 22°C dans l’eau et de 10,60 à 30°C dans l’eau.
Divers sels de 4-aminophénol peuvent se former, y compris le sel de chlorhydrate, qui se présente sous forme de prismes et subit une décomposition en atteignant 306°C ; le sel hydrosulfate, se présentant sous forme d’aiguilles avec un point de fusion de 272°C ; le sel d’oxalate, qui fond à 183°C ; le sel acétate fondant à 183°C; le sel de chloroacétate forme des aiguilles avec un point de fusion de 148°C ; et le sel de trichloroacétate, sous forme d’aiguilles avec un point de fusion de 166°C.
Le 4-aminophénol est très soluble dans le diméthylsulfoxyde, soluble dans l’acétone, l’acétonitrile, l’acétate d’éthyle et l’eau chaude et l’éther diéthylique, légèrement soluble dans l’éthanol, l’éther diéthylique, le toluène et l’eau froide et insoluble dans le benzène et le chloroforme.
2. Réactions chimiques des aminophénols
Des discussions détaillées concernant les attributs chimiques et les réponses des aminophénols sont largement documentées dans les références établies du domaine. Un aperçu concis est fourni ici.
La présence d’un groupe amino dans le cycle benzénique supprime l’acidité des phénols, le 4-aminophénol présentant l’effet le plus prononcé. Les aminophénols agissent comme des bases faibles, formant des sels avec des acides organiques et inorganiques.
Les aminophénols sont des ampholytes sans structure zwitterionique. Ils existent sous forme de molécules neutres, de cations ammonium ou d’anions phénolates selon le pH de la solution.

Cependant, des écarts par rapport aux courbes théoriques de titrage acido-basique ont conduit à l’hypothèse de cations complexes demi-sel B2+, formés par l’association d’un cation ammonium, B+, avec une molécule neutre, B. Ce phénomène est particulièrement visible dans le 4-aminophénol et est également démontré par d’autres isomères.
Les aminophénols sont chimiquement réactifs, participant à des réactions impliquant à la fois le groupe amino aromatique et la fraction hydroxyle phénolique, ainsi qu’à la substitution du cycle benzénique.
L’oxydation conduit au développement de structures quinoïdes polymères aux couleurs vives. Le 2-aminophénol subit une série de réactions de cyclisation.
2.1. Alkylation des Aminophénols
Tous les aminophénols mono-, di- et triméthylés peuvent être formés. La monoalkylation se produit lors du chauffage de l’aminophénol avec un halogénure d’alkyle approprié, un alcool en présence de nickel de Raney, ou des aldéhydes et des cétones comme alternatives à l’alcool.
L’alkylation directe du groupe hydroxyle pour produire des méthoxyanilines (anisidines) ou des éthoxyanilines (phénétidines) est complexe en raison de la réactivité du groupe amino, donnant souvent des produits alkylés mixtes.
La méthylation du 3-aminophénol dans des conditions alcalines donne la 3-méthoxyaniline, bien qu’une approche plus courante implique la protection du groupe amino suivie de la méthylation des 3-acétylanilines et de l’hydrolyse ultérieure.
D’autres anisidines et phénétidines sont généralement produites indirectement par réduction d’analogues nitro :

2.2. Acylation des aminophénols
L’acylation d’aminophénols, en utilisant de l’anhydride acétique dans un alcali ou de la pyridine, du chlorure d’acétyle et de la pyridine dans du toluène, ou du cétène dans de l’éthanol, donne généralement des produits N-acylés. L’utilisation excessive de réactifs, en particulier avec le 2-aminophénol, conduit à des produits O,N-diacylés.
Les aminophénylcarboxylates (aminophénols O-acylés) sont généralement produits via la réduction des carboxylates de nitrophényle correspondants, un processus particulièrement important pour les dérivés de 4-aminophénol.
La migration du groupe acyle des positions O à N est observée dans les produits acylés à la fois 2- et 4-aminophénols.
Un exemple de réarrangement est la formation de carbamate de 2-hydroxyphényle en traitant lentement le carbonate de 2-aminophényléthyle dans un acide dilué. Les dérivées para ne montrent aucune transformation.

2.3. Formation de sel de diazonium
Les groupes amino aromatiques des aminophénols peuvent être convertis en sels de diazonium par traitement avec du nitrite de sodium dans des conditions aqueuses acides. Des problèmes peuvent survenir avec des aminophénols facilement oxydables ou peu solubles.
Les sels de diazonium cristallins sont isolés à l’aide de formes chlorhydrate ou sulfate de l’aminophénol concerné dans des conditions anhydres. Ces dérivés diazoïques sont largement utilisés dans l’industrie des colorants.
2.4. Réactions de cyclisation des aminophénols
En raison de la proximité étroite des groupes amino et hydroxyle dans le 2-aminophénol, cet isomère est particulièrement sensible aux réactions de cyclisation et de condensation. L’oxydation par le chlorure de fer (III), les enzymes, la lumière ou l’auto-oxydation sur des plaques à couche mince de silice donne la 2-aminophénoxazine-3-one (4).
Une oxydation ultérieure avec du cyanure de fer (III) ou un chauffage avec de l’hydroxyde de potassium dans de l’éthanol génère une structure à cinq cycles, la triphénoxdioxazine (benzoxazinophénoxazine) (5).

Le 2-aminophénol et ses dérivés servent de matières premières précieuses pour la synthèse des phénoxazones, des phénoxazines, des benzoxazoles et des thiobenzoxazoles, la plupart de ces réactions impliquant un chauffage à 200 – 300 ° C avec un catalyseur approprié.
2.5. Réactions de condensation
Les diphénylamines ou diphényléthers substitués sont obtenus à partir d’aminophénols par élimination d’ammoniac ou de chlorure d’hydrogène.
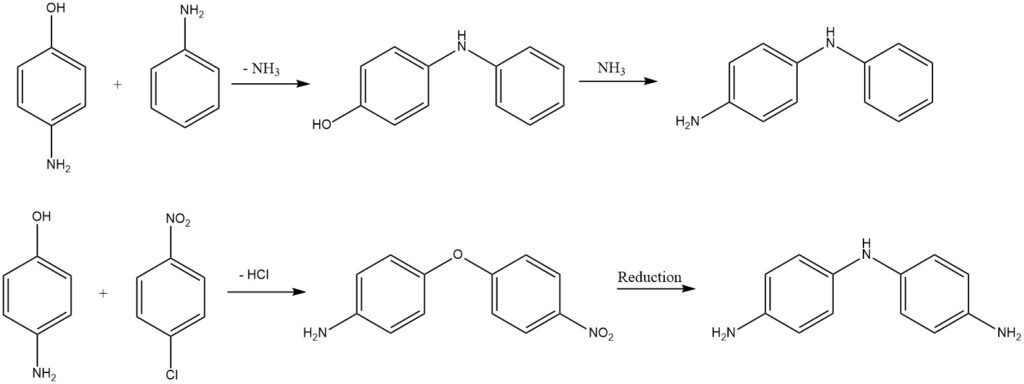
2.6. Réactions de l’anneau de benzène
Les groupes amino et hydroxyle fonctionnent comme des fragments donneurs d’électrons, conduisant à la formation de divers dérivés substitués. Les interactions contrôlées entre les amino-phénols et le chlore ou le brome dans l’acide acétique glacial donnent un spectre de produits halogénés.
L’acide sulfurique concentré ou l’oléum, avec ou sans chaleur, génère des acides sulfoniques aromatiques. Le groupe acide sulfonique entre principalement en position ortho ou para par rapport au groupe hydroxyle. Un traitement supplémentaire avec de l’oléum donne des composés disulfonés.
La carboxylation du m-aminophénol donne l’acide p-aminosalicylique.
3. Production d’aminophénols
Les aminophénols sont synthétisés par deux voies principales : la réduction des nitrophénols ou les réactions de substitution. La réduction peut être obtenue en utilisant du fer ou de l’hydrogène en présence d’un catalyseur. Aujourd’hui, cette dernière méthode est le choix préféré pour la production de 2- et 4-aminophénols.
3.1. Réduction des composés nitrés
3.1.1. Réduction du fer
La réduction des nitrophénols à l’aide de copeaux de fer se produit dans une solution ou une suspension légèrement acide. Après réduction, la boue d’oxyde de fer-fer est séparée de la solution. Pour améliorer la solubilité dans l’eau, de l’hydroxyde de sodium est ajouté, produisant de l’aminophénolate de sodium.
En raison de la sensibilité à l’oxydation en solution aqueuse, diverses méthodes de purification sont conseillées. Par la suite, les aminophénols sont précipités à partir de solutions acides par neutralisation basique, tandis que des agents réducteurs sont souvent incorporés.
Néanmoins, la réduction du 2-nitrophénol avec du fer génère des laques colorées insolubles comme sous-produits, ce qui diminue le rendement. En conséquence, l’importance industrielle de la réduction du fer pour le 2-nitrophénol est limitée.
3.1.2. Réduction catalytique
La réduction catalytique se produit principalement en solution, en émulsion ou en suspension dans des autoclaves ou des récipients sous pression. Après l’addition du catalyseur, de l’hydrogène sous pression est introduit dans le récipient. Les solvants préférés englobent l’eau et le méthanol, l’eau étant additionnée d’hydroxyde alcalin, de carbonate alcalin ou d’acide.
On utilise des catalyseurs tels que le nickel – en particulier le nickel de Raney – ou des métaux précieux supportés tels que le platine ou le palladium sur charbon actif, ou leurs oxydes.
L’ajout de solvants organiques non miscibles à l’eau peut prolonger la durée de vie du catalyseur, réduire la consommation et améliorer la qualité du produit.
Typiquement, une pression d’hydrogène de 2 MPa est optimale, bien que des pressions atmosphériques ou supérieures jusqu’à 6 MPa puissent être utilisées. Les températures de réaction restent inférieures à 100 – 110 °C.
3.1.3. Réduction du nitrobenzène
La réduction en milieu acide du nitrobenzène donne du 2- et du 4-aminophénol par réarrangement de la phénylhydroxylamine intermédiaire. Le produit principal est le 4-aminophénol, aux côtés des sous-produits 2-aminophénol, aniline et 4,4′-diaminodiphényléther.
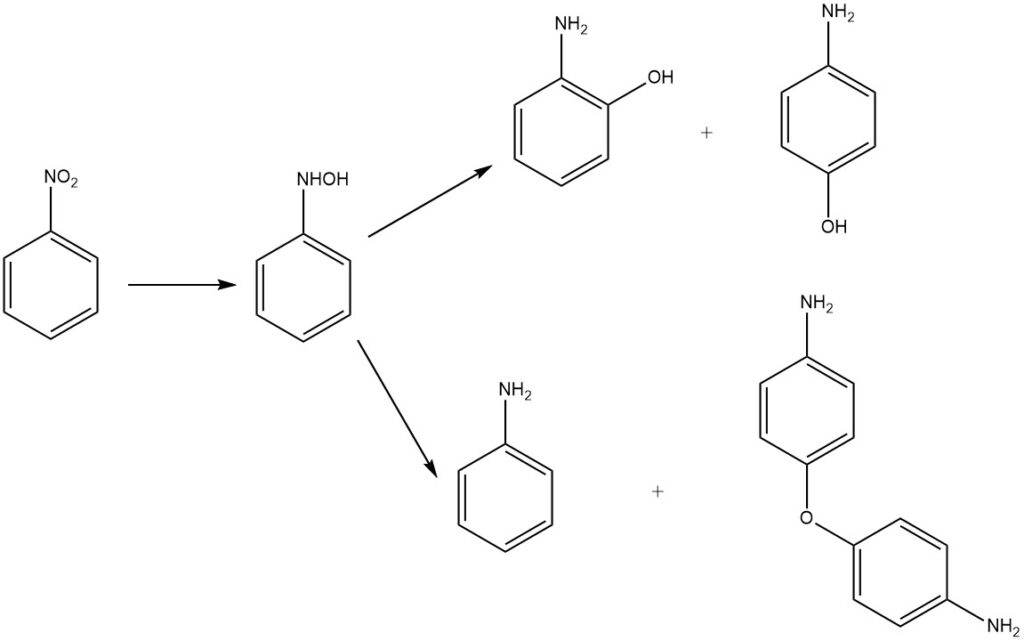
Historiquement, les métaux dans l’acide sulfurique dilué servaient d’agents réducteurs. Actuellement, des catalyseurs à base d’hydrogène et de métaux précieux tels que le palladium ou le platine sont utilisés. Les catalyseurs supplémentaires comprennent le sulfure de molybdène et de platine et un catalyseur mixte platine-ruthénium, souvent sous forme d’oxyde ou supporté sur du charbon actif.
Un acide minéral aqueux dilué agit comme milieu de réaction, et un procédé en deux étapes impliquant le cuivre de Raney réduit sélectivement le nitrobenzène en phénylhydroxylamine, qui se réorganise en 4-aminophénol lors de l’ajout d’acide sulfurique dilué.
Les agents mouillants, en particulier les sels d’ammonium quaternaire avec des groupes alkyle importants, augmentent le rendement en aminophénol. Typiquement, la réaction se produit en dessous de 100 °C et peut utiliser une pression atmosphérique ou supérieure. L’ajout d’hydrogène se produit au fur et à mesure de la consommation et les solvants organiques inertes peuvent augmenter les rendements.
Dans une méthode alternative, la réduction du nitrobenzène s’arrête à 88%, créant un mélange à deux phases contenant du nitrobenzène n’ayant pas réagi et le catalyseur de métal précieux. La séparation des phases suffit pour le traitement, la phase nitrobenzène étant recyclée.
La phase aqueuse d’acide sulfurique contient du 4-aminophénol et de l’aniline qui est strippée après neutralisation. La purification et la cristallisation donnent le 4-aminophénol.
3.1.4. Réduction électrolytique
La réduction électrolytique offre une alternative moins polluante aux systèmes métal-acide, mais la mise en œuvre industrielle reste limitée. L’électrolyse du nitrobenzène, de la phénylhydroxylamine ou de l’azoxybenzène dans des solutions acides donne spécifiquement du 4-aminophénol.
3.2. Substitution
La substitution de groupes amino ou hydroxyle à la place de divers autres groupes n’a pas d’importance industrielle significative pour la production de 2- et 4-aminophénols. Cependant, ce type de réaction trouve une utilité dans la synthèse de dérivés de 2- et 4-aminophénols.
Inversement, la voie de réduction directe ne donne pas facilement le 3-aminophénol. Sa production implique principalement la réaction entre l’acide 3-aminobenzènesulfonique et l’hydroxyde de sodium ou la réaction du résorcinol avec l’ammoniac.
La substitution du groupe acide sulfonique dans l’acide 3-aminobenzènesulfonique est réalisée par un procédé de fusion à la soude caustique (d’une durée de 5 à 6 heures à 240 à 245 ° C), suivi d’une distillation sous vide pour purifier le produit.
Une méthode alternative implique la réaction du résorcinol avec de l’ammoniac, potentiellement en présence de phosphate diammonique et de pentoxyde d’arsenic ou de sulfite d’ammonium, entraînant la formation de 3-aminophénol.
De plus, le 3-aminophénol peut être obtenu par l’hydrolyse de la 3-aminoaniline.
3.3. Purification des Aminophénols
Les aminophénols sont purifiés par sublimation à des températures élevées et à pression réduite.
Pour le 3-aminophénol, la distillation sous vide est une méthode de purification appropriée, où l’ajout de dioxyde de soufre pendant la distillation ou la collecte du distillat sous une couche d’un liquide inerte de plus faible densité, tel que l’eau, permet d’obtenir un produit incolore.
Une autre approche de purification consiste à traiter les solutions aqueuses d’aminophénols avec du charbon actif. Au cours de ce processus, l’inclusion de substances telles que le sulfite de sodium, le dithionite de sodium ou l’éthylènediaminotétraacétate disodique sert à améliorer la qualité et la stabilité des produits tout en chélatant les ions de métaux lourds qui pourraient faciliter l’oxydation.
L’ajout de dithionite de sodium, d’hydrazine ou d’hydrosulfite de sodium est également recommandé lors de la précipitation ou de la cristallisation des aminophénols.
Pour les aminophénols, en particulier le 4-aminophénol produit par réduction catalytique, les contaminants peuvent souvent être diminués ou éliminés en employant diverses procédures. Ces méthodes comprennent le traitement avec du 2-propanol, des cétones aliphatiques, cycloaliphatiques ou aromatiques, des amines aromatiques, du toluène ou des acétates d’alkyle de faible poids moléculaire, ainsi que l’utilisation d’acide phosphorique, d’acide hydroxyacétique, d’acide hydroxypropionique ou d’acide citrique.
L’extraction avec du chlorure de méthylène, du chloroforme ou du nitrobenzène peut également être efficace pour atténuer ou éliminer les contaminants.
4. Utilisations des aminophénols
Le 2-aminophénol et le 4-aminophénol sont de puissants agents réducteurs, ce qui les rend précieux en tant que révélateurs photographiques, reconnus par des noms commerciaux tels que Atomal et Ortol pour le 2-aminophénol, et Activol, Azol, Certinal, Citol, Paranol, Rodinal, Unal et Ursol P pour 4-aminophénol.
Ces substances trouvent une application soit individuellement, soit en conjonction avec l’hydroquinone. La forme oxalate du 4-aminophénol est commercialisée sous le nom commercial Kodelon.
La polyvalence des aminophénols en fait des intermédiaires essentiels dans la synthèse de presque tous les types de teintures et de colorants. De plus, le 2-aminophénol est spécifiquement utilisé pour rehausser les teintes du cuir, de la fourrure et des cheveux, allant des nuances grises et brunes aux tons brun jaunâtre.
À diverses fins, le 3-aminophénol sert de colorant capillaire et d’agent de couplage dans les formulations de teintures capillaires. Pendant ce temps, le 4-aminophénol fait partie intégrante de la synthèse pharmaceutique, contribuant à la production de teintures à bois qui confèrent une teinte rose au bois et agissant comme agent de teinture pour la fourrure et les plumes.
Compte tenu de la proximité des groupes amino et hydroxyle sur le cycle benzénique, ainsi que de leur prédisposition à la condensation avec des réactifs appropriés, le 2-aminophénol est un précurseur clé dans la synthèse de systèmes hétérocycliques comme les oxyquinolines, les phénoxamines et les benzoxazoles qui sont utilisés comme inflammation. inhibiteurs.
En ce qui concerne le 3-aminophénol, ses applications englobent la stabilisation des thermoplastiques chlorés bien que son rôle principal soit d’être un intermédiaire pour la production de l’acide 4-amino-2-hydroxybenzoïque, un agent tuberculostatique.
De même, les dérivés de 4-aminophénols azotés sont reconnus depuis longtemps pour leurs propriétés antipyrétiques et analgésiques, contribuant de manière significative à l’utilisation du 4-aminophénol.
5. Toxicologie des Aminophénols
Les aminophénols sont classés comme irritants. Leur cote de toxicité varie de légère à modérée; cependant, une exposition prolongée ou répétée peut entraîner divers effets indésirables, notamment des démangeaisons générales, une sensibilisation cutanée, une dermatite et des réactions allergiques.
L’exposition aux 2- et 4-aminophénols peut conduire à la production spontanée de conjugués immunogènes. Une autre préoccupation potentielle est la formation de méthémoglobine, entraînant une cyanose.
L’inhalation de 4-aminophénol peut déclencher cette réaction et également conduire à l’asthme bronchique. Notamment, le 3-aminophénol présente un moindre danger par rapport aux autres isomères. L’irritation causée par les dérivés sulfonés est plus douce que celle des composés non sulfonés.
Le 2-aminophénol a des propriétés neuroactives, induisant des décharges de pointe lorsqu’il est introduit dans le cérébroventricule des rats. En revanche, le 4-aminophénol est néphrotoxique et inhibe significativement la fonction tubulaire proximale.
Dans les mitochondries rénales du rat, la respiration, la phosphorylation oxydative et l’activité ATPase sont inhibées par le 4-aminophénol. Bien que le 3-aminophénol ne soit pas aussi dangereux, le 2-aminophénol et le 4-aminophénol présentent des effets tératogènes chez les hamsters.
L’impact du 4-aminophénol s’étend à l’inhibition de la synthèse de l’ADN et à l’altération de la structure de l’ADN dans les lymphoblastes humains. De plus, les aminophénols ont été identifiés comme des agents génotoxiques, comme en témoignent l’induction d’échanges de chromatides sœurs et les tests de micronoyau.
De toute évidence, une manipulation prudente de ces composés est essentielle et une exposition prolongée doit être minimisée. Le retrait rapide des vêtements contaminés et le lavage soigneux de la zone affectée avec de l’eau courante pendant au moins 10 minutes sont des procédures recommandées.
Références
- Aminophenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099
- Aminophenols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0113091413092003.a01.pub2


