Table des matières
4-(N-méthylamino)phénol

Le 4-(N-méthylamino)phénol, de formule chimique C7H9NO et d’un poids moléculaire de 123,15 g/mol, présente des structures cristallines aciculaires lorsqu’il est précipité à partir de benzène.
Son point de fusion est de 87 °C et il a une plage d’ébullition de 168 à 169 °C à une pression de 2 kPa. Cette substance a une faible solubilité dans l’alcool et reste insoluble dans l’éther.
La synthèse industrielle du 4-(N-méthylamino)phénol implique le processus de décarboxylation de la N-(4-hydroxyphényl)glycine à des températures élevées, en utilisant des solvants comme le chlorobenzène-cyclohexanone.
Une voie de synthèse alternative est la méthylation du 4-aminophénol ou la réaction de la méthylamine avec le 4-chlorophénol et le sulfate de cuivre en solution aqueuse à 135 °C, ou avec l’hydroquinone en solution alcoolique à 200 à 250 °C.
Principalement, le 4-(N-méthylamino)phénol sert de composant crucial dans les révélateurs photographiques. En raison de sa sensibilité à la dégradation en présence d’air et de lumière, il est généralement commercialisé sous le nom de sel de sulfate, connu sous le nom de Metol, qui a une température de décomposition de 260 °C.
De plus, il trouve une application en tant que composé intermédiaire dans la production de teintures pour fourrure et cheveux et peut agir comme inhibiteur de corrosion pour l’acier dans des conditions spécifiques.
Une exposition prolongée au 4-(N-méthylamino)phénol a été associée au développement de dermatites et de réactions allergiques.
4-(N,N-Diméthylamino)phénol
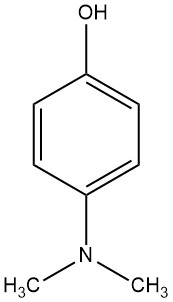
Le 4-(N,N-diméthylamino)phénol, se caractérise par ses gros cristaux rhombiques, qui peuvent être obtenus à partir de mélanges de cristallisation soit éther-hexane, soit éther-ligroïne. Ils ont un point de fusion de 75 à 76 ° C et une plage de points d’ébullition de 101 à 103 ° C à 66,7 Pa.
Le composé forme facilement un sel avec l’acide sulfurique qui affiche une plage de fusion de 208 à 210 ° C.
La synthèse du 4-(N,N-diméthylamino)phénol implique la méthylation du 4-aminophénol à l’aide d’un halogénure de méthyle sous pression.
Une approche alternative implique la désalkylation de la 4-méthoxydiméthylaniline par reflux avec de l’acide iodhydrique pendant 10 heures.
Une autre méthode de production est la photodécomposition du tétrafluoroborate de 4-diméthylaminobenzènediazonium.
Le 4-(N,N-diméthylamino)phénol sert d’intermédiaire dans diverses réactions de synthèse et a récemment pris de l’importance dans les études expérimentales de toxicité impliquant des animaux. Il a été démontré qu’il induit la méthémoglobinémie.
4-Hydroxyacétanilide
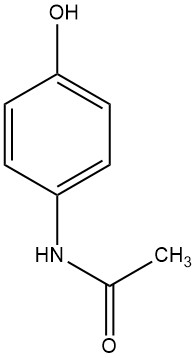
Le 4-hydroxyacétanilide, identifié par ses noms chimiques 4-acétamidophénol, acétaminophène ou paracétamol, forme de grands prismes monocliniques blancs lorsqu’il est précipité de l’eau, affichant une plage de fusion de 169 à 171 ° C. C’est un composé inodore au goût amer.
Il est insoluble dans l’éther de pétrole, le pentane et le benzène ; légèrement soluble dans l’éther et l’eau froide; et solubilité dans l’eau chaude, les alcools, le diméthylformamide, le 1,2-dichloroéthane, l’acétone et l’acétate d’éthyle.
La valeur de pKa du composé est de 9,5 à 25 °C.
La production de 4-hydroxyacétanilide implique l’acétylation du 4-aminophénol. Ceci peut être réalisé par diverses méthodes, telles que l’utilisation d’acide acétique et d’anhydride acétique à 80 ° C, d’anhydride acétique dans de la pyridine à 100 ° C, de chlorure d’acétyle et de pyridine dans du toluène à 60 ° C, ou la réaction avec du cétène dans une suspension alcoolique. .
Une voie de synthèse alternative est la transformation directe à partir du 4-nitrophénol. Les approches de réduction-acétylation comprennent l’étain avec de l’acide acétique, l’hydrogénation sur Pd-C dans l’anhydride acétique et l’hydrogénation sur le platine dans l’acide acétique.
D’autres voies comprennent le réarrangement de la 4-hydroxyacétophénone hydrazone avec du nitrite de sodium dans l’acide sulfurique et l’hydroxylation électrolytique de l’acétanilide.
Au-delà de son rôle d’intermédiaire dans la production de colorants azoïques et de produits chimiques photographiques, le 4-hydroxyacétanilide possède des propriétés antipyrétiques et analgésiques, trouvant une utilisation intensive dans les applications médicales. Sa DL50 orale chez le rat est enregistrée à 3,7 g/kg.
4-Méthoxyaniline

La 4-méthoxyaniline a une formule moléculaire C7H9NO et un poids moléculaire de 123,55 g/mol, un point de fusion de 58,5 °C et une plage de points d’ébullition de 123,2 à 123,5 °C à une pression de 1,9 kPa.
Il possède un moment dipolaire de 1,8 Debye (benzène). Son indice de réfraction est de 1,5559 à 67 °C et sa densité de 1,092 à 55 °C. Le composé présente une viscosité de 3,215 millipascals secondes (mPa·s) à 55 °C.
Pour sa production industrielle, la 4-Méthoxyaniline est synthétisée par la réduction du 4-nitroanisole à l’aide de sulfure de sodium ou d’hydrogène en présence de catalyseurs de métaux précieux ou de nickel de Raney.
4-éthoxyaniline

La 4-éthoxyaniline a la formule moléculaire C8H11NO et un poids moléculaire de 137,18 g/mol, présente un point de fusion de 2,4 °C et un point d’ébullition de 249,9 °C à une pression de 101,3 kPa.
À température ambiante lorsqu’il est pur, il apparaît incolore, mais il vire au brun lorsqu’il est exposé à la lumière ou à l’air. La 4-éthoxyaniline possède une légère solubilité dans l’eau.
La synthèse industrielle de la 4-éthoxyaniline implique la réduction du 4-nitrophénétole à l’aide de fer ou d’hydrogène sous pression en présence d’un catalyseur.
Alternativement, un procédé qui utilise le chauffage du 4-chlorophénétole avec de l’ammoniac aqueux en présence d’oxyde de cuivre (I) à 225 ° C, donne 85% de la 4-éthoxyaniline souhaitée.
4-éthoxyacétanilide
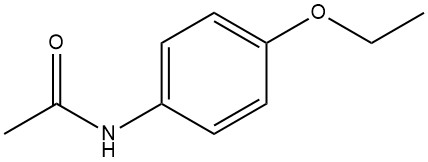
Le 4-éthoxyacétanilide, communément appelé phénacétine, p-acétophénétidine ou 4-acétamidophénétole, a la formule chimique C10H13NO2 avec un poids moléculaire de 179,21 g/mol. Ce composé est une poudre cristalline blanche et a un point de fusion compris entre 134 et 135 °C.
C’est un composé inodore avec un goût légèrement amer. Bien qu’il ait une solubilité limitée dans l’eau froide, il est plus soluble dans l’eau chaude, l’alcool, l’éther et le chloroforme. À des humidités relatives comprises entre 15 et 90 %, la teneur en humidité d’équilibre est d’environ 2 % à 25 °C.
La principale méthode employée pour la production de 4-éthoxyacétanilide est la réduction catalytique du 4-nitrophénétole à l’aide d’hydrogène, suivie d’une acétylation avec de l’anhydride acétique.
Une autre voie de synthèse est l’éthylation du 4-nitrophénol à l’aide de sulfate d’éthyle dans un environnement alcalin, la réduction ultérieure du groupe nitro en un groupe amino par l’utilisation de fer dans des conditions acides et l’acétylation finale par ébullition avec de l’acide acétique glacial.
Alternativement, le 4-aminophénol peut subir une éthylation en utilisant de l’iodure d’éthyle dans une solution alcaline alcoolique, donnant de la 4-phénétidine, qui est ensuite soumise à une acétylation. L’ordre des réactions peut également être inversé, l’acétylation précédant l’éthylation.
Au-delà de ses propriétés structurales, le 4-éthoxyacétanilide possède à la fois des propriétés antipyrétiques et analgésiques. Cependant, son efficacité est limitée dans la prise en charge des douleurs sévères.
L’utilisation prolongée de ce produit doit être exercée avec prudence en raison de la néphrotoxicité potentielle associée à l’un de ses métabolites mineurs, la 2-hydroxyphénétidine, qui peut contribuer à l’apparition de la méthémoglobinémie.
Dans des études en laboratoire sur des rats, la DL50 orale du 4-éthoxyacétanilide est de 1,65 g/kg.
Acide 5-aminosalicylique
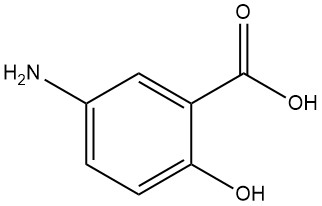
L’acide 5-aminosalicylique, également connu sous le nom d’acide 5-amino-2-hydroxybenzoïque, a la formule moléculaire C7H7NO3 avec un poids moléculaire de 153,13 g/mol.
Il forme des cristaux incolores qui subissent une transformation en une teinte brune lorsqu’ils sont soumis à des températures dépassant 250 à 260 °C et finissent par fondre à 283 °C avec décomposition.
Ces cristaux sont insolubles dans l’éthanol et l’eau froide alors qu’ils présentent une solubilité limitée dans l’eau chaude.
L’acide 5-aminosalicylique est produit par la réduction de l’acide 3-nitrobenzoïque à des températures allant de 115 à 145 °C et à une pression de 3,5 MPa dans une solution diluée d’acide sulfurique et de platine comme catalyseur. Dans ces conditions, le dérivé intermédiaire d’hydroxylamine subit un réarrangement conduisant à la formation d’acide 5-aminosalicylique.

En variante, un autre procédé est la réduction de l’acide 5-nitrosalicylique, dans lequel le zinc dans l’acide chlorhydrique sert d’agent réducteur.
N-(4-Hydroxyphenyl)glycine
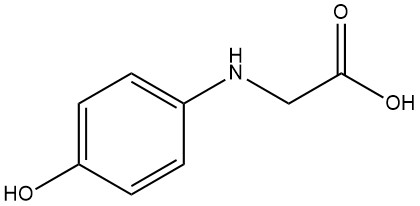
La N-(4-hydroxyphényl)glycine, également appelée acide 4-hydroxyphénylaminoacétique, acide 4-oxyanilinoacétique ou photoglycine a une formule moléculaire C8H9NO3 et un poids moléculaire de 167,16 g/mol. C’est un agrégat de sphères ou de folioles brillantes lorsqu’il est précipité de l’eau.
Lors du chauffage, sa couleur vire au brun à 200 °C, commence à fondre vers 220 °C et finit par fondre complètement avec décomposition dans la plage de 245 à 247 °C.
La N-(4-hydroxyphényl)glycine se dissout dans les acides alcalins et minéraux, avec une solubilité limitée observée dans l’eau, l’acide acétique glacial, l’acétate d’éthyle, l’alcool, l’éther, l’acétone, le chloroforme et le benzène.
La synthèse de la N-(4-hydroxyphényl)glycine peut être réalisée par des méthodes telles que la réaction du 4-aminophénol avec l’acide chloroacétique ou en soumettant le nitrile correspondant à une hydrolyse alcaline suivie de l’élimination de l’ammoniac.
La N-(4-hydroxyphényl)glycine est utilisée comme révélateur photographique sous des noms commerciaux tels que Glycine, Iconyl et Monazol. Il trouve également une application comme résine photosensible dans l’industrie des colorants et fonctionne comme intermédiaire dans la production de 4-(N-méthylamino)phénol (Metol) par la libération de CO2.
De plus, ce composé a une utilité en chimie analytique pour déterminer les concentrations de fer, de phosphore et de silicium, et il sert d’indicateur d’acide en bactériologie.
Une exposition prolongée à ce composé peut entraîner des lésions rénales.
4-Amino-2,6-dichlorophénol

Le 4-amino-2,6-dichlorophénol a la formule chimique C6H5Cl2NO et un poids moléculaire de 178,03 g/mol. il peut subir une sublimation et fond à 167 °C.
Le composé est soluble dans l’éthanol, l’éther diéthylique, l’acétone et l’acide acétique et il a une solubilité limitée dans le benzène et est presque insoluble dans l’eau.
Référence
- Aminophenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099


