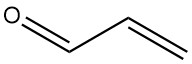
Wat is acroleïne?
Acroleïne, ook bekend als propenal of acrylaldehyde, is de eenvoudigste onverzadigde aldehyde met de formule C3H4O. Het is een vluchtige, kleurloze vloeistof met een sterke geur die zowel giftig als traanverwekkend is.
De ontdekking van acroleïne, dat zijn naam ontleent aan de Latijnse woorden “acer” wat scherp betekent en “oleum” wat olie betekent, kan worden toegeschreven aan Redtenbacher in 1843. Het werd gevonden in oververhit vet.
In 1942 ontwikkelde Degussa een methode voor de commerciële productie van acroleïne door de heterogeen gekatalyseerde gasfasecondensatie van aceetaldehyde en formaldehyde. Momenteel wordt acroleïne voornamelijk op grote schaal geproduceerd door de heterogeen gekatalyseerde gasfase-oxidatie van propeen.
Inhoudsopgave
1. Fysieke eigenschappen van acroleïne
Acroleïne is beperkt oplosbaar in water, maar is oplosbaar in verschillende organische oplosmiddelen, waaronder alcoholen, ethers en alifatische of aromatische koolwaterstoffen. De essentiële fysische eigenschappen van acroleïne worden hieronder gepresenteerd:
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 56,06 g/mol |
| Kookpunt | 52-53°C |
| Smeltpunt | -87°C |
| Relatieve dichtheid | 0,838 g/cm³ |
| Breukindex | 1,418 |
| Viscositeit | 0,40 cP bij 25°C |
| Oplosbaarheid in water | 260 g/kg |
| Dampspanning | 29 kPa bij 20°C |
| Zelfontbrandingstemperatuur in lucht | 234 °C |
| Vlampunt | -26 °C |
2. Chemische reacties van acroleïne
Acroleïne vertoont een hoge reactiviteit vanwege de geconjugeerde vinyl- en aldehydegroepen, waardoor het reacties ondergaat die kenmerkend zijn voor zowel onverzadigde verbindingen als aldehyden.
De conjugatie tussen de koolstof-koolstof dubbele binding en de carbonylgroep verbetert de reactiviteit van beide groepen, waardoor ze samen of afzonderlijk kunnen reageren.
Het is vermeldenswaard dat acroleïne spontane, zeer exotherme polymerisatie kan ondergaan.
2.1. Diels-Alder-reactie
Acroleïne fungeert zowel als een dieen als een diënofiel, waardoor de vorming van een cyclisch dimeer genaamd 3,4-dihydro-2H-pyran-2-carboxaldehyde mogelijk wordt. Dit dimeer wordt geproduceerd door de ongekatalyseerde thermische reactie van acroleïne bij ongeveer 190 °C (1 uur voor 75% acroleïneconversie), samen met de vorming van polymere bijproducten.
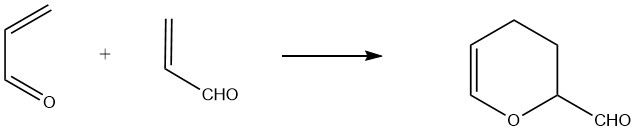
Om hoge opbrengsten te behalen, is stabilisatie met hydrochinon of complexerende verbindingen zoals polyvalente organische zuren noodzakelijk.
Het resulterende “thermische dimeer” is een heldere vloeistof met een onaangename geur, kookt bij 151,3 °C bij 101,3 kPa en heeft een relatieve dichtheid van 1,0775. Zure hydrolyse van het dimeer levert 2-hydroxyadipaldehyde op, dat verder kan worden gehydrogeneerd om 1,2,6-hexanetriol te vormen.
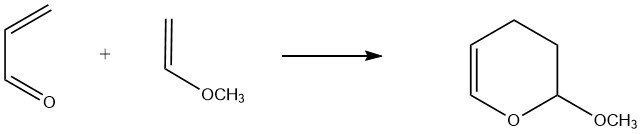
Acroleïne fungeert als een 1,3-dieen in reacties met dienofielen waarbij de elektronendichtheid van de koolstof-koolstof dubbele binding wordt verhoogd door elektronen-afgevende substituenten. Acroleïne reageert bijvoorbeeld gemakkelijk met vinylethers en vinylaminen om dihydropyranen te vormen.
Een belangrijk commercieel voorbeeld is de reactie tussen methylvinylether en acroleïne, wat leidt tot de vorming van 3,4-dihydro-2-methoxy-2H-pyran. De gerapporteerde opbrengsten voor deze reactie bij temperaturen van 160-190 °C variëren van 80% tot 90%.
2.2. Additie aan de koolstof-koolstof dubbele binding
Het β-koolstofatoom van acroleïne, gepolariseerd door de carbonylgroep, fungeert als een elektrofiel. Bijgevolg kunnen nucleofiele reagentia zoals alcoholen, thiolen, water, aminen, actieve methyleenverbindingen en anorganische en organische zuren adderen aan de koolstof-koolstof dubbele binding in de aanwezigheid van zure of basische katalysatoren.
Zorgvuldig gecontroleerde omstandigheden zijn essentieel om ongewenste nevenreacties te minimaliseren. De toevoeging van water onder mild zure omstandigheden leidt tot de vorming van 3-hydroxypropionaldehyde (HPA) met een hoge selectiviteit.
Bufferoplossingen met een pH van 4-5 of zwak zure ionenuitwisselingsharsen worden vaak gebruikt als katalysatoren. Verdere hydrogenering van de waterige oplossingen resulteert in 1,3-propaanediol.
Edelmetaalkatalysatoren vergemakkelijken de directe oxidatie van waterige oplossingen van HPA bij pH 3, waardoor 3-hydroxypropionzuur ontstaat. Boven pH 7 wordt het malonaatanion in hoge opbrengst gevormd.
Acroleïne reageert snel met waterstofchloride of waterstofbromide om 3-chloorpropionaldehyde of 3-broompropionaldehyde te verkrijgen. Deze producten polymeriseren echter gemakkelijk in trimeren en tetrameren in aanwezigheid van zuren. Om 3-halopropionaldehydeacetalen te verkrijgen, wordt de voorkeur gegeven aan een gelijktijdig waterstofhalogenide-additie- en acetalisatieproces, wat resulteert in acetaalopbrengsten van ongeveer 90%.
Chloor en broom kunnen worden toegevoegd aan acroleïne in verdunde waterige oplossing, waardoor 2,3-dihalopropionaldehyden worden gevormd met opbrengsten van ongeveer 85%. Deze dihalopropionaldehyden kunnen worden gedehydrohalogeneerd om 2-haloacroleïnen te produceren. De 2-haloacroleïnen staan bekend als krachtige mutagenen en kunnen verder worden gehalogeneerd om 2,2,3-trihalopropionaldehyden te produceren, die waardevolle tussenproducten zijn bij de synthese van foliumzuur.
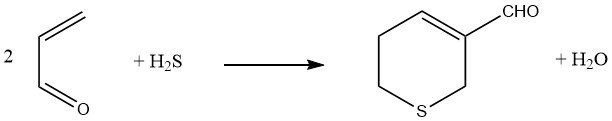
Waterstofsulfide resulteert, wanneer toegevoegd aan twee equivalenten acroleïne gevolgd door een aldolreactie, in de vorming van 3-formyl-5,6-dihydrothiopyran.
Methaanthiol ondergaat base-gekatalyseerde additie aan acroleïne, wat leidt tot de vorming van 3-(methylthio)propionaldehyde, een belangrijke reactie die wordt gebruikt bij de synthese van het essentiële aminozuur D,L-methionine.
2.3. Reacties van de aldehydegroep
De selectiviteit van zuur-gekatalyseerde acetalisering hangt af van de aard van de gebruikte alcohol en de gebruikte katalysatoren. Nevenreacties kunnen overeenkomstige 3-alkoxypropionaldehyden en 3-alkoxypropionaldehydeacetalen produceren.
Cyclische acetalen, met name die gevormd met vertakte diolen zoals 2-methyl-1,3-propaandiol, zijn gemakkelijker te verkrijgen in vergelijking met acyclische acetalen van lagere alcoholen. Er zijn verschillende continue processen bekend voor de bereiding van cyclische acetalen, met opbrengsten van meer dan 90% die haalbaar zijn door speciale processen in combinatie met extractie.
Acroleïneacetalen dienen als waardevolle tussenproducten en hebben interesse gekregen als veiligere vormen voor het transport van acroleïne, met name 2-vinyl-1,3-dioxolaan. Deze acetalen kunnen eenvoudig worden teruggesplitst in acroleïne in waterige zure oplossingen, die bruikbaar zijn bij het gebruik van acroleïne als een aquatisch herbicide en als een waterstofsulfidevanger in olieveldwateren.
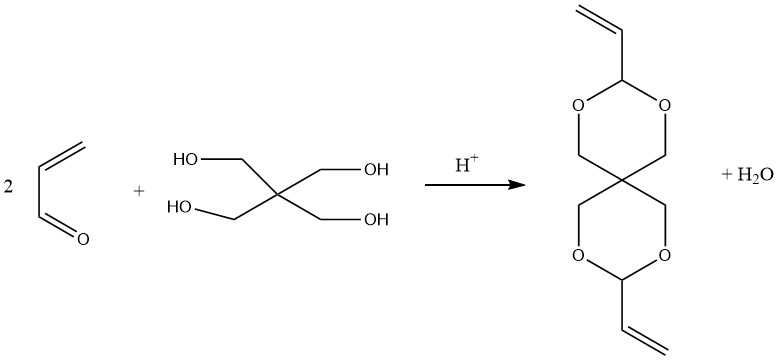
Spirodiacetaal, diallylideenpentaerythritol, bereid door het condenseren van pentaerythritol met twee mol acroleïne, kan worden gepolymeriseerd met vinyl of andere monomeren om spiraanharsen te vormen.
Hydroformylering van acroleïneacetalen, met name cyclische acetalen, leidt tot de monoacetalen van 1,4-butaandiol. Vervolgens hydrolyse en hydrogenering van dit hydroformyleringsproduct resulteren in de productie van 1,4-butaandiol.
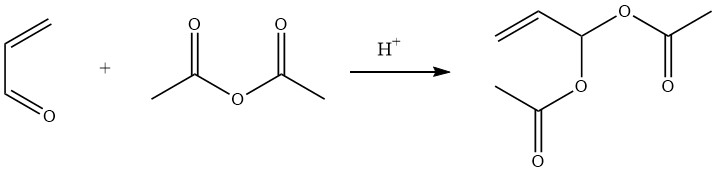
Acroleïnediacetaat, ook bekend als 2-propeen-1,1-dioldiacetaat, wordt eenvoudig bereid in een opbrengst van 90% door de zuurgekatalyseerde reactie van azijnzuuranhydride met acroleïne.
Wanneer waterstofcyanide wordt toegevoegd aan acroleïne in aanwezigheid van milde alkalische katalysatoren, wordt acroleïnecyaanhydrine gevormd met opbrengsten van meer dan 90%. Acroleïnecyaanhydrineacetaat, verkregen door de reactie met azijnzuuranhydride, dient als een waardevol tussenproduct in de synthese van farmaceutisch en biologisch actieve stoffen.
2.4. Gelijktijdige reactie van de aldehyde- en vinylgroepen
Hoewel acroleïne en methacroleïne worden erkend als tussenproducten in de Skraup-synthese van chinolines uit aromatische aminen en glycerol, blijft hun commerciële gebruik als uitgangsmateriaal voor deze reactie beperkt.
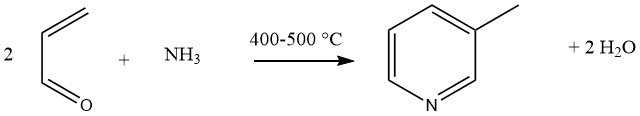
De gasfasecondensatie van acroleïne en ammoniak, gekatalyseerd door multicomponent Al2O3 of SiO2-Al2O3 katalysatoren, levert 45% 3-methylpyridine en 20-25% pyridine als bijproduct op. Deze reactie is gegeneraliseerd als een universele synthese voor gesubstitueerde pyridines.
Acroleïne reageert met isocyanuurzuur om een adduct te vormen dat bruikbaar is als cross-linking agent. De bifunctionele reactiviteit van acroleïne is benut in verschillende syntheses van heterocyclische verbindingen, zoals de reacties met fenolen om gesubstitueerde chromenen of chromanen te produceren, en de reactie met 2-aminofenolen om 8-chinolinolen te produceren.
Wanneer acroleïne reageert met overmaat fenol onder zure omstandigheden, wordt een mengsel van polyfenolen verkregen, met 1,1,3-tris(4-hydroxyfenyl)propaan als het primaire product.
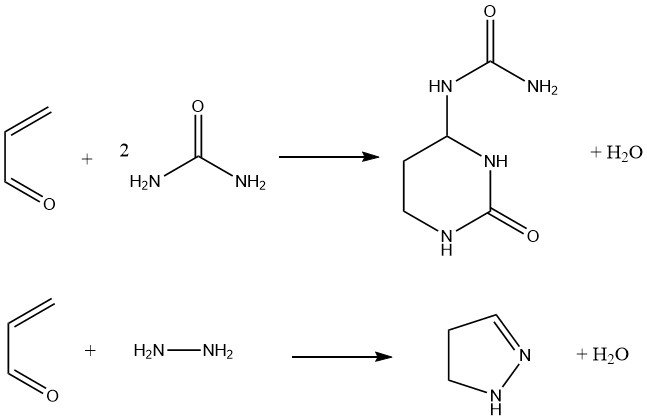
Bovendien reageert acroleïne met ureum om hexahydro-2-oxo-4-pyrimidinylureum te produceren, dat is voorgesteld als meststof. De condensatie van acroleïne met hydrazine en gesubstitueerde hydrazines levert pyrazolines op met een opbrengst van 80%.
Acroleïne kan worden omgezet met formaldehyde onder alkalische omstandigheden om pentaerythritol te produceren. De opbrengsten zijn echter lager vergeleken met de commerciële synthese van pentaerythritol via acetaldehyde en formaldehyde.
Natriumbisulfiet reageert met acroleïne om een stabiel adduct te vormen, het dinatriumzout van 1-hydroxypropaan-1,3-disulfonzuur. Deze reactie vindt een handige toepassing voor de desodorisatie van gemorst acroleïne.
2.5. Reductie
Selectieve reductie van acroleïne tot allylalcohol in hoge opbrengsten (90%) kan worden bereikt door waterstofoverdracht van secundaire alcoholen, zoals 2-propanol, in een Meerwein-Ponndorf-reactie in de vloeibare fase.
In de gasfase leidt waterstofoverdracht van ethanol of 2-propanol over magnesiumoxidekatalysatoren of zeldzame aardoxidekatalysatoren bij temperaturen variërend van 300 tot 500 °C ook tot de productie van allylalcohol.
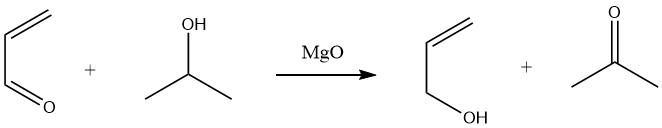
Katalytische hydrogenering van acroleïne is echter minder selectief of alleen selectief bij zeer lage conversies.
2.6. Oxidatie
Door acroleïne te laten reageren met waterige waterstofperoxide bij pH 8-8,5, kan glycidaldehyde worden verkregen in opbrengsten van 80-90%:
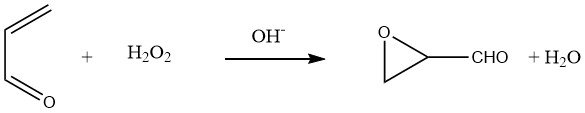
Hydratatie van de oxiraangroep in glycidaldehyde leidt tot een waterige oplossing van D,L-glyceraldehyde.
Acrylzuur wordt commercieel geproduceerd door de oxidatie van acroleïne met moleculaire zuurstof.
2.7. Polymerisatie
Acroleïne polymeriseert gemakkelijk wanneer het wordt verhit, blootgesteld aan licht of in de aanwezigheid van verschillende initiatoren. De eigenschappen van het resulterende acroleïnepolymeer zijn afhankelijk van de polymerisatieomstandigheden, zoals het type initiator, oplosmiddel en reactietemperatuur.
De functionele groepen van acroleïne (vinyl en aldehyde) kunnen afzonderlijk of samen polymeriseren. Door radicalen geïnitieerde polymerisatie vindt uitsluitend plaats bij de vinylgroep, wat resulteert in polymeren met aldehydegroepen die gemakkelijk tetrahydropyraanstructuren vormen. Ionische polymerisatie levert voornamelijk polymeren op met vinylgroepen, naast polymeren die zowel aldehyde- als vinylgroepen bevatten.
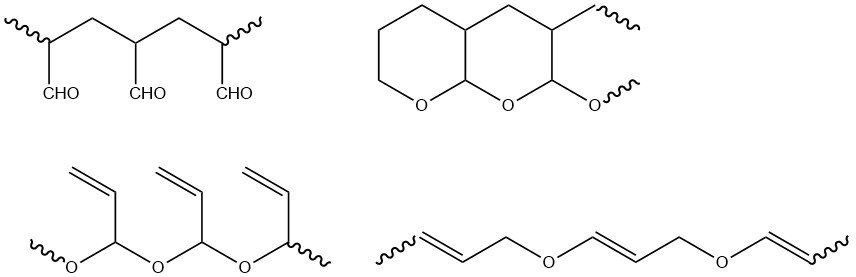
Radicale polymeren zijn infuseerbaar en onoplosbaar in gangbare oplosmiddelen, terwijl producten van anionische initiatie oplosbaar zijn in veel organische oplosmiddelen. Naast homopolymeren zijn er copolymeren met verschillende vinylische en acrylische comonomeren gesynthetiseerd.
De carbonylgroepen van polyacroleïne kunnen chemisch worden gemodificeerd onder milde omstandigheden. Veel polyacroleïnederivaten zijn oplosbaar in organische oplosmiddelen of zelfs in water. Deze polymeren hebben interesse gewekt vanwege hun biocide activiteit, aangezien acroleïne langzaam uit hen vrijkomt.
De fotochemische (laser)methode is gebruikt om ultrafijne deeltjes te synthetiseren uit gasvormige mengsels van acroleïne en bepaalde organosiliciumverbindingen. Polyacroleïnedeeltjes worden onderzocht op hun potentiële toepassingen in nanotechnologie.
3. Productie van acroleïne
3.1. Productie van acroleïne door propeenoxidatie
Het eerste commerciële proces voor de productie van acroleïne werd in 1942 ontwikkeld door Degussa. Het omvatte de dampfasecondensatie van acetaldehyde en formaldehyde, gekatalyseerd door natriumsilicaat op silicadragers bij temperaturen van 300-320 °C.
Deze methode werd gebruikt tot 1959 toen Shell een nieuw proces introduceerde op basis van de dampfaseoxidatie van propeen over een koperoxidekatalysator. De katalysatorprestaties in dit proces waren echter slecht.
In 1957 ontdekte Standard Oil of Ohio (Sohio) het bismutmolybdaatkatalysatorsysteem, dat een verbeterde selectiviteit liet zien, maar nog steeds een lage propeenconversie had.
De oxidatie van propeen tot acroleïne kreeg momentum met de ontdekking van het bismutmolybdaat-bismutfosfomolybdaatsysteem (Bi9PMo12O52 op een SiO2-drager) door Sohio. Commerciële katalysatoren omvatten ook bismut-molybdeenoxiden.
De katalyse van propeenoxidatie tot acroleïne omvat twee reactiecycli: een katalysatorreductiecyclus (selectieve productvorming) en een katalysatorreoxidatiecyclus (rooster-zuurstofregeneratie). De actieve plaatsen van de katalysatoren zijn interfaces tussen Fe2(MoO4)3 en β-CoMoO4, waarbij bismutmolybdaat verantwoordelijk is voor de selectiviteit.
Moderne katalysatoren voor acroleïneproductie zijn multicomponent metaaloxidesystemen.
De optimalisatie van deze katalysatorsystemen is een voortdurende uitdaging, waarbij verschillende chemische bedrijven voortdurend werken aan het verbeteren van katalysatorsamenstellingen en bereidingstechnieken. Extra metaaloxiden zoals Co, Ni, P, Sb, W of K worden toegevoegd om de redoxeigenschappen van de katalysator in evenwicht te brengen en de prestaties ervan te verbeteren.
In de huidige productieprocessen wordt propeen gemengd met lucht en stoom en gevoed aan een multi-tubulaire vastebedreactor die wordt bedreven bij temperaturen van 300-400 °C. Het reactoreffluent wordt vervolgens geblust en het gas wordt gewassen met water of water/oplosmiddelmengsels om bijproducten te verwijderen.
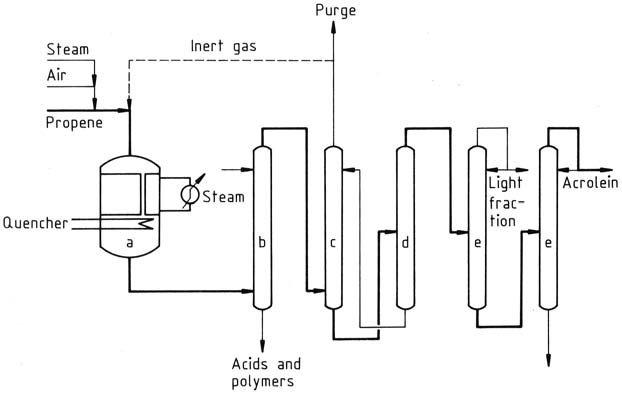
a) Oxidatiereactor; b) Scrubber; c) Absorber; d) Desorber; e) Fractionatoren
De acroleïne wordt verkregen door het gas in koud water te absorberen in een absorber. De waterige oplossing van acroleïne wordt verder verwerkt in een desorptiekolom om ruwe acroleïne te verkrijgen, die vervolgens wordt gedestilleerd om het product te zuiveren.
Nieuwe ontwikkelingen in de productie van acroleïne richten zich op het verbeteren van de selectiviteit en opbrengst van de katalysator, terwijl het energieverbruik en de CO2-uitstoot worden verminderd.
Alternatieve routes naar acroleïne uit propaan worden onderzocht en de combinatie van propaandehydrogenering en selectieve oxidatie van propeen tot acroleïne wordt onderzocht.
Het Methanol tot Propeen-proces, waarbij methanol wordt gebruikt als grondstof voor de productie van propeen, wint ook aan belang in de chemische industrie.
4. Toepassingen van Acroleïne
Acroleïne heeft een breed scala aan toepassingen als chemisch tussenproduct in verschillende industrieën. Enkele van de belangrijkste toepassingen van acroleïne zijn:
1. Biocide: Acroleïne wordt gebruikt als een zeer effectief breedspectrumbiocide bij lage concentraties, ongeveer 10 ppm. Het wordt gebruikt om de groei van waterplanten, algen, weekdieren en als ontsmettingsmiddel in watersystemen te beheersen. Het wordt ook gebruikt in olieveldwateren om stinkende waterstofsulfide te elimineren.
2. Methionineproductie: Acroleïne wordt voornamelijk gebruikt bij de productie van methionine, een essentieel aminozuur en een diervoedersupplement. Acroleïne wordt ook gebruikt om methioninehydroxy-analoog te produceren, een diervoedersupplement met een iets lagere bio-effectiviteit dan methionine.
3. Acrylzuur: Acroleïne is een voorloper voor de productie van acrylzuur, een belangrijke chemische stof die wordt gebruikt om acrylaten te maken. Acrylzuur wordt veel gebruikt bij de productie van coatings, kleefstoffen, textiel en verschillende polymeren.
4. 1,3-Propanediol: Acroleïne kan worden gebruikt om 1,3-propanediol te produceren via een hydrolyse- en hydrogeneringsproces. 1,3-Propanediol vindt toepassingen in de productie van composietmaterialen, kleefstoffen, oplosmiddelen en antivries.
5. Glutaraldehyde: Acroleïne wordt gebruikt bij de productie van glutaraldehyde, een veelzijdige dialdehyde. Glutaraldehyde wordt gebruikt bij het looien van leer, waterbehandeling, toepassingen in olievelden en als ontsmettingsmiddel en sterilisator voor medische apparatuur.
6. Pyridines: Acroleïne kan worden gebruikt om verschillende pyridinederivaten te synthetiseren, waaronder 3-methylpyridine en andere gesubstitueerde pyridines, die toepassingen hebben in de farmaceutische, pesticiden- en parfumindustrie.
7. Tetrahydrobenzaldehyde: Acroleïne kan worden gebruikt bij de productie van tetrahydrobenzaldehyde, dat wordt gebruikt bij de synthese van farmaceutica, fungiciden en parfums.
8. Smaken en geuren: Acroleïne en zijn derivaten worden gebruikt bij de productie van een breed scala aan smaken en geuren, waaronder verbindingen zoals lyral, myracaldehyde en 5-norborneen-2-carbaldehyde.
9. Herbiciden: Acroleïne cyanohydrine acetaat wordt gebruikt als tussenproduct bij de productie van fosfinotrycine, een niet-selectief herbicide dat wordt gebruikt bij gewasbescherming.
10. Andere toepassingen: Acroleïne is in het verleden gebruikt voor de productie van allylalcohol en glycerol, maar deze processen zijn stopgezet. Het kan ook worden gebruikt om D,L-glyceraldehyde te produceren, dat toepassingen heeft bij het looien van leer en verschillende syntheses. Acroleïne polymeren, zoals poly(aldehyde carbonzuur), hebben industriële toepassingen als sequestreermiddelen, textielbehandelingen, papierversterking en biociden.
Dit zijn slechts enkele van de belangrijkste toepassingen van acroleïne, en de veelzijdigheid ervan als chemisch tussenproduct maakt potentiële toepassingen in verschillende industrieën mogelijk.
Referentie
- Acroleïne en Methacroleïne; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_149.pub2




