Produktionsmethoden aliphatischer Aldehyde
Aldehyde werden durch die allgemeine chemische Formel RCHO bezeichnet, wobei R Wasserstoff oder eine Vielzahl aliphatischer, aromatischer oder heterocyclischer Gruppen darstellen kann. Gemäß der IUPAC-Nomenklatur werden Aldehyde an der Endung „al“ erkannt; Viele Aldehyde werden jedoch immer noch mit ihrem gebräuchlichen Namen bezeichnet.
Die primäre Methode zur Herstellung von Aldehyden ist die Oxosynthese, die durch milde Oxidation (Dehydrierung) primärer Alkohole und spezielle Olefinoxidationsverfahren erreicht wird. In den ätherischen Ölen verschiedener Pflanzen kommen natürlicherweise Spuren von Aldehyden vor. Acetaldehyd, ein Nebenprodukt der Alkoholgärung, entsteht durch Decarboxylierung des Zwischenprodukts Brenztraubensäure.
Aldehyde spielen wichtige biologische Rollen, beispielsweise die Beteiligung von 11-cis-Retinal am Sehvorgang und die Beteiligung von Pyridoxal an der Aminosäuretransaminierung.
Die Isolierung von Aldehyden aus natürlichen Quellen hat nur in wenigen Fällen kommerzielle Bedeutung, beispielsweise bei der Herstellung längerkettiger Duftstoffaldehyde.
Inhaltsverzeichnis
1. Herstellung gesättigter Aldehyde
Obwohl zahlreiche Methoden zur Synthese von Aldehyden entdeckt wurden, werden nur wenige im industriellen Maßstab genutzt. Dies ist häufig auf die Verfügbarkeit geeigneter Rohstoffe zurückzuführen. Die folgenden Verfahren sind für die Herstellung gesättigter aliphatischer Aldehyde von größter Bedeutung:
- Hydroformylierung von Olefinen, allgemein bekannt als Oxo-Synthese.
- Dehydrierung oder Oxidation primärer Alkohole, die hauptsächlich zur Herstellung von Formaldehyd aus Methanol eingesetzt werden.
- Hydratisierung von Acetylen, was zur Bildung von Acetaldehyd (auch als Ethanal bekannt) führt.
- Oxidation von Ethylen zu Acetaldehyd.
- Oxidation gesättigter Kohlenwasserstoffe, insbesondere C3- und C4-Kohlenwasserstoffe, zur Herstellung niederer Aldehyde.
Wichtig sind auch spezifische Synthesen zur Herstellung von Aldehyden, die in der Parfümindustrie eingesetzt werden.
1.1. Oxo-Synthese
Die Oxo-Synthese ist die bedeutendste Methode zur Herstellung von Aldehyden, die aus mindestens drei Kohlenstoffatomen bestehen (sog. Oxo-Synthese). Bei diesem speziellen Verfahren reagieren Olefine mit Synthesegas, einem Gemisch aus Kohlenmonoxid (CO) und Wasserstoff (H2). Als Ergebnis dieser Reaktion entstehen Aldehyde mit einem zusätzlichen Kohlenstoffatom im Vergleich zum Ausgangsolefin.
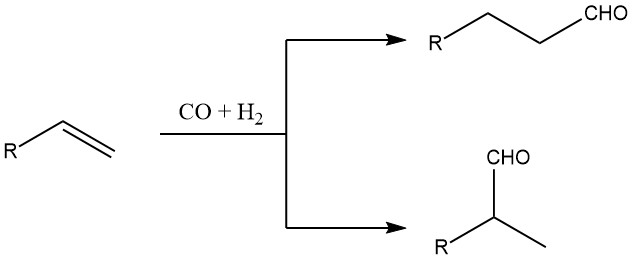
Die Bildung reiner Produkte erfolgt nur bei symmetrischen oder sterisch gehinderten Olefinmolekülen. In anderen Fällen wird jedoch eine Mischung aus geradkettigen und verzweigten Verbindungen erhalten. Durch sorgfältige Auswahl geeigneter Katalysatoren und Kontrolle der Reaktionsbedingungen kann das Verhältnis zwischen normalen (n) und iso (verzweigten) Aldehydprodukten in einem weiten Bereich eingestellt werden.
1.2. Dehydrierung/Oxidation primärer Alkohole
Dehydrierungs-, Oxidations- und oxidative Dehydrierungsreaktionen werden durch die folgenden Gleichungen dargestellt:
- RCH2OH → RCHO + H2; ΔH = +84 kJ/mol for R = CH3 (Gleichung 1)
- RCH2OH + 1/2 O2 → RCHO + H2O; ΔH = -159 kJ/mol for R = H (Gleichung 2)
- RCH2OH → RCHO + H2; H2 + 1/2 O2 → H2O; ΔH = -159 kJ/mol for R = H (Gleichung 3)
Dehydrierung: Die endotherme Dehydrierungsreaktion von Alkoholen erfolgt bei Atmosphärendruck und Temperaturen im Bereich von 250 bis 400 °C, typischerweise unter Verwendung von Cu- oder Ag-Katalysatoren. Diese Katalysatoren werden häufig mit Elementen wie Zr, Co oder Cr aktiviert.
Das Verfahren bietet den Vorteil einer gleichzeitigen Wasserstoffrückgewinnung, die ohne zusätzliche Reinigung genutzt werden kann. Es handelt sich um eine Gleichgewichtsreaktion, die aus wirtschaftlichen Gründen hohe Temperaturen und kurze Verweilzeiten erfordert.
Das Verfahren findet kommerzielle Anwendung bei der Herstellung von Acetaldehyd aus Ethanol. Die Gasphasendehydrierung mit einem durch Cer aktivierten Kupferkatalysator wird bei Atmosphärendruck und 270–300 °C durchgeführt, wobei 25–50 % Ethanol pro Durchsatz umgewandelt werden, mit einer Selektivität von 90–95 % für Acetaldehyd, zusammen mit der Bildung von Nebenprodukten wie z B. Ethylacetat, Ethylen, Crotonaldehyd und höhere Alkohole.
Oxidation: Der durch Gleichung (2) beschriebene Oxidationsprozess wird unter Verwendung eines Überschusses an Luft oder Sauerstoff und eines Katalysators, der 18–19 Gew.-% Fe2O3 und 81–82 Gew.-% MoO3 enthält, bei Temperaturen im Bereich von 350 bis 450 °C durchgeführt. Dieses Verfahren wird bei der Herstellung von Formaldehyd eingesetzt.
Oxidative Dehydrierung: Gleichung (3) kombiniert die endotherme Dehydrierung des Alkohols mit der exothermen Verbrennung des gebildeten Wasserstoffs, was zu einer insgesamt exothermen Reaktion führt.
Im industriellen Prozess laufen beide Reaktionen gleichzeitig ab, wenn unterstöchiometrische Mengen Sauerstoff oder Luft eingesetzt werden. Es ist von entscheidender Bedeutung, die Explosionsbereiche von Alkohol-Luft-Gemischen während der Oxidation und oxidativen Dehydrierung zu berücksichtigen.
Die oxidative Dehydrierung ist das wichtigste Verfahren zur Herstellung von Aldehyden aus Alkoholen. Bevorzugt werden Silberkatalysatoren, es kommen aber auch Kupferkatalysatoren zum Einsatz. Bei der Formaldehydherstellung aus Methanol erreichen Silberkristalle (Korngröße 0,2–3 mm), Silbernetze oder Silber auf Al2O3 bei Temperaturen von 500–720 °C und Verweilzeiten von weniger als 0,01 s einen Umsatz von 75–99 %.
Im Jahr 2006 stammten etwa 7 % der Acetaldehydproduktion Westeuropas aus Ethanol. Silber und Kupfer waren die primär verwendeten Katalysatoren mit Ethanolumwandlungen von 30–50 % pro Durchsatz und einer Acetaldehyd-Selektivität von 85–95 %. Die Reaktionstemperatur lag je nach Luftmenge zwischen 300 und 600 °C. Zu den Nebenprodukten gehörten Ethylacetat, Ameisensäure, Essigsäure und Kohlendioxid.
Duftstoff-Aldehyde: Zur Synthese von Duftstoff-Aldehyden werden auch Dehydrierungs- und Oxidationsprozesse bevorzugt. Ein spezielles Verfahren ermöglicht die katalytische Dehydrierung von C5-C14-Alkoholen in Gegenwart von Wasserstoff und Luft unter Verwendung von Kupfer- oder Silberkatalysatoren, möglicherweise kombiniert mit Zn, Cr oder Cr2O3.
Weitere in der Literatur beschriebene Katalysatorsysteme umfassen Cu/MgO, Ag/Na2O auf Trägern, Mischungen aus MnO, NiO auf MgO oder CuCl mit einem stickstoffhaltigen Liganden wie 2,20-Bipyridyl.
1.3. Oxidation von Kohlenwasserstoffen
Celanese hat ein Verfahren zur Oxidation von C3- und C4-Alkanen entwickelt, allerdings entsteht bei dieser Methode ein komplexes Reaktionsgemisch, das teure Extraktions- und Destillationsschritte erfordert.
Dabei werden Propan und Propan-Butan-Gemische in der Gasphase bei Temperaturen von 425 bis 460 °C und Drücken von 0,7 bis 0,8 MPa umgesetzt. Die Umsatzrate liegt bei ca. 20 %, wobei während der Reaktion ein Sauerstoffmangel vorliegt. Die Reaktion verläuft über einen radikalischen Mechanismus.
Das bei diesem Verfahren erhaltene Reaktionsgemisch besteht hauptsächlich aus Acetaldehyd (≈ 20 %), Formaldehyd (≈ 15 %), Methanol (≈ 19 %) und organischen Säuren (≈ 11 %).
Trotz dieser Komponenten gilt das Verfahren jedoch als technologisch veraltet. Darüber hinaus hat die Oxidation von Methan oder Ethan mit dieser Methode keine praktische Bedeutung.
1.4. Oxidation von Olefinen
Die primäre und entscheidende industrielle Methode zur Herstellung von Acetaldehyd ist die partielle Oxidation von Ethylen in der wässrigen Phase, die in Gegenwart von Palladium- und Kupferchloriden durchgeführt wird. Dieser Prozess ist als Wacker-Hoechst-Prozess bekannt.
Ein weiteres Oxidationsverfahren zur Herstellung von Aldehyden aus Olefinen ist die Acroleinsynthese, bei der Propen umgewandelt wird.
1.5. Verschiedene Prozesse
Das Verfahren, bei dem durch Zugabe von Wasser zu Acetylen Acetaldehyd entsteht, hat im Vergleich zu alternativen Verfahren auf Basis von Ethylen oder Ethanol an Bedeutung verloren. In Westeuropa wurden die letzten Anlagen, die dieses Verfahren nutzten, 1980 geschlossen.
Die geringere Bedeutung des Acetylen-basierten Verfahrens wird auf die leichte Verfügbarkeit und die geringeren Kosten von Ethylen sowie auf die überlegene Selektivität seiner Umwandlung zurückgeführt. Darüber hinaus hat die Verwendung von umweltschädlichem Quecksilbersulfat als Katalysator dazu beigetragen, dass das Verfahren praktisch obsolet geworden ist.
2. Herstellung ungesättigter Aldehyde
Niedere α,β-ungesättigte Aldehyde, darunter Acrolein, Crotonaldehyd oder 2-Ethyl-2-hexenal, werden hauptsächlich durch synthetische Verfahren gewonnen. Allerdings können bestimmte ätherische Öle als Rohstoffe für höhere Homologe wie Citral oder Citronellal dienen.
Es gibt zwei industrielle Hauptverfahren zur Herstellung von α,β-ungesättigten Aldehyden:
1. Oxidation von Olefinen: Dieses Verfahren dient der Herstellung von Acrolein.
2. Dehydratisierung von Aldolen, die durch Aldolkondensation gesättigter Aldehyde gewonnen werden: Diese Methode wird zur Herstellung von Crotonaldehyd und 2-Ethyl-2-hexenal eingesetzt.
Zusätzlich zu diesen Verfahren gibt es spezielle Synthesen zur Herstellung von Aldehyden für die Parfümindustrie, wie zum Beispiel:
1. Dehydrierung ungesättigter Alkohole: Dieses Verfahren wird bei der Herstellung von Citral aus Geraniol genutzt.
2. Reduktion ungesättigter Säuren: Mit dieser Methode wird Undecylenaldehyd aus Undecylensäure hergestellt.
2.1. Oxidation von Olefinen
Die direkte Oxidation von Olefinen, insbesondere die Oxidation von Propen, ist für die Herstellung von Acrolein von großer industrieller Bedeutung. Diese Oxidationsreaktion findet bei Temperaturen im Bereich von 300 bis 480 °C statt und verwendet unterschiedlich modifizierte Bi-Mo-Oxid-Katalysatoren. Als Ausgangsmaterial wird ein Gasgemisch verwendet, das Propen, Luft und Wasserdampf in einem Molverhältnis von etwa 1:10:2 enthält.
Dabei können Umwandlungsraten von bis zu 98 % erreicht werden, die Acroleinausbeuten liegen zwischen 78 % und 92 %. Allerdings entstehen neben Acrolein auch einige Nebenprodukte, darunter Acetaldehyd, Essigsäure und Acrylsäure.
Im Handel erhältliches Acrolein hat typischerweise einen Reinheitsgrad von 95 % bis 97 %. Um unerwünschte Reaktionen zu verhindern und die Stabilität während der gesamten Verarbeitungsschritte aufrechtzuerhalten, wird typischerweise ein Stabilisator zugesetzt. Hydrochinon wird in diesen Verfahren üblicherweise als Stabilisator verwendet.
2.2. Dehydrierung von Aldolen
Die β-Hydroxyaldehyde (Aldole) sind Zwischenprodukte, die bei der Aldolreaktion entstehen und sehr instabil sind. Sie zersetzen sich leicht unter Wasserverlust und bilden α,β-ungesättigte Aldehyde.
Abhängig von den Reaktionsbedingungen kann die Aldolreaktion direkt zur Bildung ungesättigter Verbindungen führen. Dieses Verfahren wird üblicherweise zur Synthese von Crotonaldehyd aus Acetaldehyd, 2-Methyl-2-pentenal aus Propionaldehyd und 2-Ethyl-2-hexenal aus Butanal verwendet.
Die Aldolkondensation von Acetaldehyd mit katalytischen Mengen verdünntem Natriumhydroxid wird typischerweise bei 20–25 °C durchgeführt. Die Reaktion wird mit Essigsäure gelöscht, um weitere Reaktionen zu stoppen. Im anschließenden Destillationsschritt wird dem Acetaldol Wasser entzogen, wodurch als Hauptprodukt Crotonaldehyd entsteht. Die Selektivität gegenüber Crotonaldehyd kann Werte von bis zu 95 % erreichen.
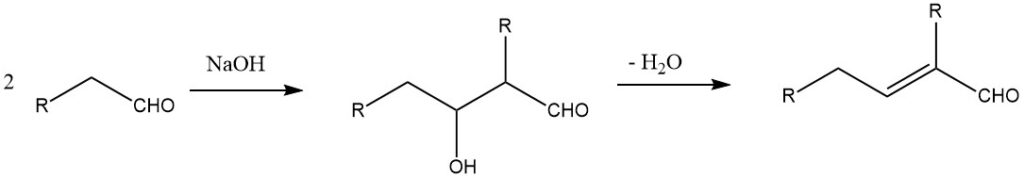
An der Aldolreaktion können zwei identische Aldehydmoleküle oder zwei verschiedene Aldehydspezies beteiligt sein. Im letzteren Fall entsteht häufig eine Produktmischung. Durch sorgfältige Auswahl der Reaktanten und Reaktionsbedingungen ist es jedoch möglich, die gewünschte Verbindung als Hauptprodukt zu erhalten.
Beispielsweise wurde Acrolein früher durch die Reaktion von Formaldehyd mit Acetaldehyd hergestellt.

Ebenso können höhere 2-Methylenalkanale (2-Alkylacroleine) durch Reaktion von Formaldehyd mit längerkettigen Aldehyden erhalten werden.
2.3. Verschiedene Prozesse
Zur Herstellung bestimmter ungesättigter Aromaaldehyde werden die entsprechenden Alkohole selektiv mit Kupfer-, Kupfer-Zink- oder Edelmetallkatalysatoren dehydriert. Diese Verfahren werden vorzugsweise unter vermindertem Druck durchgeführt und werden häufig bei der Herstellung von Citral, Citronellal und Hydroxycitronellal eingesetzt.
Eine weitere interessante industrielle Methode zur Synthese ungesättigter Aldehyde ist die Claissen-Umlagerung von Allylvinylethern. Als Zwischenprodukte entstehen dabei Allylvinylether nach folgendem Reaktionsschema:
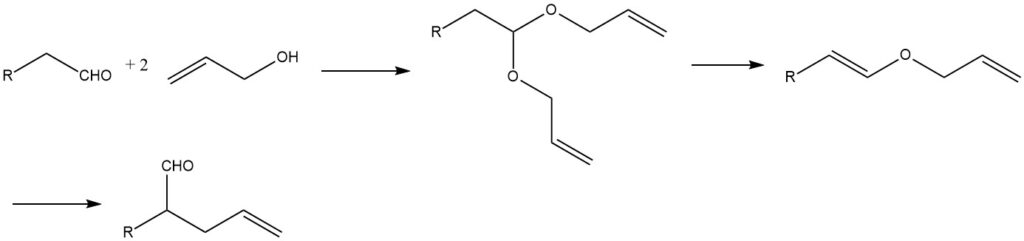
2-Alkenale können auch durch Reaktion ungesättigter Alkylhalogenide mit den Natriumsalzen sekundärer Nitrokohlenwasserstoffe erhalten werden. Beispielsweise kann Citral in einer Ausbeute von 80 % aus 1-Halogen-3,7-dimethylocta-2,6-dien gewonnen werden.
Ein weiterer Ansatz besteht darin, Acetale mit Vinylethern in Gegenwart von Bortrifluorid zu behandeln. Dabei kommt es zur Bildung entsprechender β-Alkoxyacetale. Die anschließende Behandlung mit Säuren führt zur Umwandlung von β-Alkoxyacetalen in α,β-ungesättigte Aldehyde.
3. Herstellung von Hydroxyaldehyden
3.1. Aldolkondensation
Die erstmals 1872 von A. Wurtz beschriebene Aldolkondensation lässt sich bei basenkatalysierten Reaktionen nach folgendem Mechanismus beschreiben:

Die Aldolkondensation ist eine reversible Reaktion und kann nicht nur durch Basen, sondern auch durch Säuren katalysiert werden. Dies ist nur für Aldehyde mit mindestens einem α-Wasserstoffatom möglich. Aus Aldehyden mit mehr als einem α-Wasserstoffatom gewonnene Aldole sind normalerweise instabil und verlieren Wasser unter Bildung von α,β-ungesättigten Aldehyden:
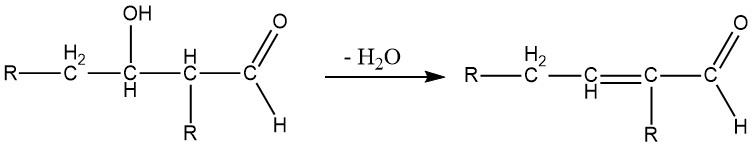
Wenn zwei verschiedene Aldehyde mit α-Wasserstoffatomen eine Aldoladdition eingehen, werden im Allgemeinen alle vier möglichen Aldolspezies in unterschiedlichen Mengen gebildet.
Für industrielle Zwecke sind Reaktionen von größerer Bedeutung, bei denen nur ein Reaktant α-Wasserstoffatome besitzt. In solchen Fällen ist der zweite Reaktant häufig Formaldehyd. Reaktionen zur Herstellung von Mono- oder Polymethylolalkanalen aus Formaldehyd und Alkanalen sind in industriellen Prozessen üblich.
Diese exothermen Reaktionen werden typischerweise in der flüssigen Phase durchgeführt und häufig werden Katalysatoren wie wässrige Lösungen von Natriumhydroxid oder Alkalicarbonaten eingesetzt.
Es wurden auch verschiedene andere Katalysatorsysteme beschrieben, darunter zink- oder Magnesium-haltige Zeolithe, Alkalihydroxide in Kombination mit Phasentransferkatalysatoren, tertiäre Amine und basische Ionenaustauscherharze.
Typische Nebenprodukte der Aldolkondensation sind neben den zuvor erwähnten dimeren Aldolen, Aldoxanen und α,β-ungesättigten Aldehyden auch cyclische Acetale, Tischchenko-Ester usw. Reaktionen mit Formaldehyd können zu zusätzlichen Komplikationen führen, da eine Reduktion des Aldols um a Es kann zu einer gekreuzten Cannizzaro-Reaktion kommen.
G. Wittig entdeckte eine modifizierte Version der klassischen Aldolreaktion, bei der Carbonylverbindungen mit metallierten Iminen behandelt wurden. Dabei werden überwiegend α,β-ungesättigte Aldehyde gebildet, und diese Methode hat sich insbesondere im Bereich der Naturstoffe bewährt.
3.2. Verschiedene Prozesse
Die Zugabe von Wasser zu α,β-ungesättigten Aldehyden führt zur Bildung von β-Hydroxyaldehyden. Diese Reaktion ist von industrieller Bedeutung und wird zur Synthese von 1,3-Propandiol genutzt.
Beispielsweise kann 3-Hydroxypropanal auch durch Hydroformylierung von Ethylenoxid erhalten werden, während 4-Hydroxybutanal durch Hydroformylierung von Allylalkohol erhalten wird. Die Hydroformylierung ungesättigter Alkohole zur Herstellung von Hydroxyaldehyden wurde ausführlich besprochen.
Darüber hinaus entsteht bei der Hydrolyse von 2,3-Dihydro-1,4-pyran 5-Hydroxypentanal, das im Gleichgewicht mit seiner cyclischen Halbacetalform vorliegt. Beispielsweise kann 2-Phenyl-2,3-dihydropyran, hergestellt aus Acrolein und Styrol durch eine Diels-Alder-Synthese, mit verdünnter Schwefelsäure gespalten werden, um 5-Phenyl-5-hydroxypentanal zu erzeugen.
4. Herstellung von Dialdehyden
Zahlreiche Synthesen von Dialdehyden sind in der Patentliteratur dokumentiert, von denen jedoch nur eine begrenzte Anzahl von kommerzieller Bedeutung ist, vor allem aufgrund ihrer mangelnden Selektivität. Die wichtigsten Verfahren zur Herstellung gesättigter aliphatischer und cycloaliphatischer Dialdehyde sind folgende:
- Oxidation von Ethylenglykol
- Oxidation von Acetaldehyd
- Hydroformylierung von Dienen
- Oxidative Ringöffnung von Cycloalkenen
- Zugabe von Methylvinylether zu Acrolein (was zu Glutardialdehyd führt)
4.1. Hydroformylierung von Dienen
Die Hydroformylierung von Dienen führt zu vielfältigen Produkten, die sowohl von der Struktur des Diens als auch vom verwendeten Katalysator beeinflusst werden. Beim Umgang mit konjugierten Dienen wie 1,3-Butadien unter Verwendung unmodifizierter Kobalt- oder Rhodiumkatalysatoren entstehen gesättigte Monoaldehyde oder Monoalkohole.
Durch einmalige Zugabe von CO/H2 entsteht zunächst der ungesättigte Monoaldehyd. Anschließend konkurriert die Hydroformylierung des ungesättigten Aldehyds mit der Hydrierung und Isomerisierung der Doppelbindung.
Andererseits isomerisieren nichtkonjugierte Diene typischerweise nach der einmaligen Zugabe von CO/H2 zu den thermodynamisch stabileren α,β-ungesättigten Aldehyden. Daher sind nichtkonjugierte Diene mit weit voneinander entfernten (> C6), vorzugsweise endständigen Doppelbindungen, besonders nützlich für die Synthese von Dialdehyden über Hydroformylierung.
4.2. Oxidative Ringöffnung von Cycloalkenen
Wenn Cycloalkene Katalysatoren wie Wolframsäure ausgesetzt werden, reagieren sie mit Wasserstoffperoxid, was zur Bildung der entsprechenden Epoxide und zu linearen α,ω-Dialdehyden führt.
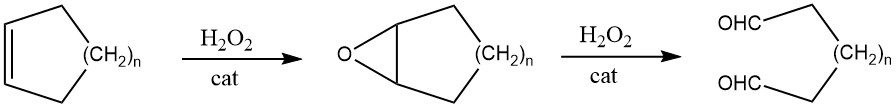
In bestimmten Fällen erleichtert der Zusatz von Borverbindungen die Reaktion.
4.3. Verschiedene Prozesse
Ähnlich wie bei der Bildung von Monoaldehyden durch Dehydrierung führt die Dehydrierung von Diolen zur Bildung von Dialdehyden.
Es gibt auch andere Wege, einschließlich der Ozonisierung von Cycloalkenen und der Dimerisierung ungesättigter Aldehyde. Darüber hinaus führt die Hydroformylierung ungesättigter Acetale zu den entsprechenden Dialdehyden.
5. Herstellung von Acetalen
Die primäre Methode zur Herstellung von Acetalen ist die Reaktion eines Aldehyds mit einem Alkohol. Aufgrund des Gleichgewichtscharakters der Reaktion entsteht typischerweise ein instabiles Halbacetal als Zwischenprodukt.
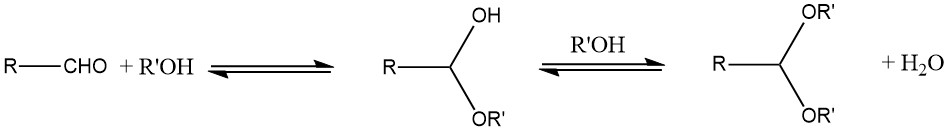
Um die Ausbeute zu steigern, muss das bei der Reaktion entstehende Wasser durch azeotrope Destillation oder wasseradsorbierende Mittel wie Molekularsiebe entfernt werden. Im Allgemeinen liefern zyklische Acetale tendenziell bessere Ausbeuten als offenkettige Acetale.
Als gängige Katalysatoren dienen wasserfreie Schwefelsäure oder p-Toluolsulfonsäure, es können aber auch andere Optionen wie anorganische Säuren, Oxal– oder Adipinsäure, Ionenaustauscherharze oder Molekularsiebe verwendet werden.
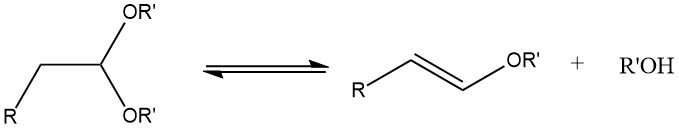
Bei der Acetalisierung gesättigter aliphatischer Aldehyde mit einem α-Wasserstoffatom kann es bei zu hoher Reaktionstemperatur zur Bildung von 1-Alkenylethern kommen.
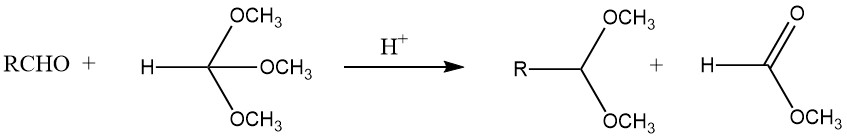
Acetale können mit guten Ausbeuten aus den meisten Aldehyden synthetisiert werden, indem man sie mit Orthoformiaten, hauptsächlich den Methyl- und Ethylestern, behandelt und starke Säuren als Katalysatoren verwendet, wie nach dem von L. Claisen entwickelten Verfahren.
Darüber hinaus können Acetale durch die Reaktion von Acetylen mit Alkoholen, die Addition von Alkohol an Vinylether und die Behandlung geminaler Dihalogenide mit Alkoxiden erhalten werden. Aldehyde und Oxirane ergeben 1,3-Dioxolane, während Brenzkatechine und Dichlormethan 1,3-Benzodioxole bilden.
Die säurekatalysierte Reaktion von Olefinen mit Formaldehyd führt zur Bildung von 1,3-Dioxanen (Prins-Reaktion), die bei 55–75 °C mit einem Überschuss an Formaldehyd durchgeführt wird.
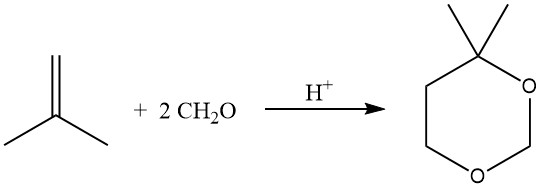
Unter Hydroformylierungsbedingungen kann die Reaktion von Olefinen mit Alkoholen, häufig unter Verwendung von Phasentransferkatalysatoren, auch zu Acetalen führen.
Acetaldehyd-Dimethylacetal wird bei 200 °C aus Methanol und Synthesegas in Gegenwart eines Katalysators mit einer Methanolumwandlung von etwa 60 % und einer Selektivität von 80–85 % gewonnen. Zu den Hauptnebenprodukten zählen Acetaldehyd und Ethylacetat.
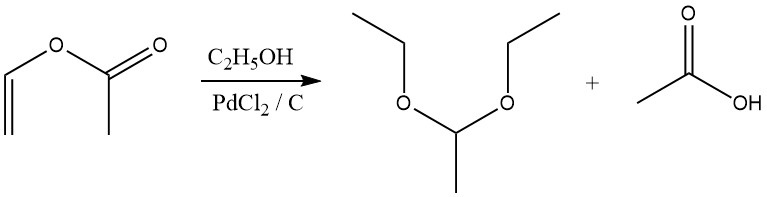
Acetale entstehen auch durch die Reaktion von Vinylestern mit Alkoholen in Gegenwart eines Palladiumchloridkatalysators.
Verweise
- Aldehydes, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_321.pub3
- Production of aliphatic aldehydes. – https://patents.google.com/patent/US2623905A/en
