Phthalonitril: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Phthalonitril?
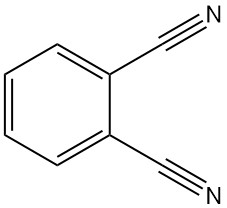
Phthalonitril, auch bekannt als 1,2-Dicyanobenzol oder 1,2-Benzoldicarbonitril, ist eine organische Verbindung mit der Formel C8H4N2. Es ist ein kristallines Pulver mit einer schwachen graugelben Farbe und einem schwachen aromatischen Geruch, ähnlich wie Benzonitril.
Phthalonitril wurde erstmals 1896 bei der Diazotierung von 2-Aminobenzonitril entdeckt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Phthalonitril
Phthalonitril ist ein kristalliner Feststoff, der nicht wasserlöslich ist (ca. 1 g/l), aber in organischen Lösungsmitteln wie Ethanol, Aceton, Nitrobenzol, Benzonitril und Ether löslich ist.
Phthalonitril kann nicht destilliert werden und polymerisiert, wenn es über seinen Schmelzpunkt erhitzt wird. Es ist nicht explosiv und lässt sich nur schwer entzünden, aber der Staub kann explodieren.
Tabelle 1 zeigt die wichtigen physikalischen Eigenschaften von Phthalonitril.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [91-15-6] |
| Formel | C6H4N2 |
| Molekulargewicht | 128,14 g/mol |
| Schmelzpunkt | 141 °C |
| Siedepunkt | 304,5 °C (Zersetzung) |
| Dichte | 1,238 g/cm3 |
| Scheinbare Dichte | ≈ 0,5 g/cm3 |
| Flammpunkt | 162 °C |
| Verbrennungswärme | 4013 kJ/mol |
| Verdampfungswärme | 67 kJ/mol |
| Spezifische Wärmekapazität (30 °C) | 1,30 J g-1 K-1 |
| Dampfdruck (20 °C) | 0,05 mbar |
| Selbstentzündungstemperatur | > 580 °C |
2. Reaktionen von Phthalonitril
Phthalonitril durchläuft mehrere wichtige Reaktionen, die typisch für Nitrilgruppen und aromatische Verbindungen sind, von denen einige in der Industrie verwendet werden.
Phthalonitril reagiert mit verschiedenen Metallvorläufern, wie Kupferchlorid, bei einer Temperatur von etwa 180 °C in einem Lösungsmittel zu intensiv gefärbten und haltbaren Phthalocyaninpigmenten.
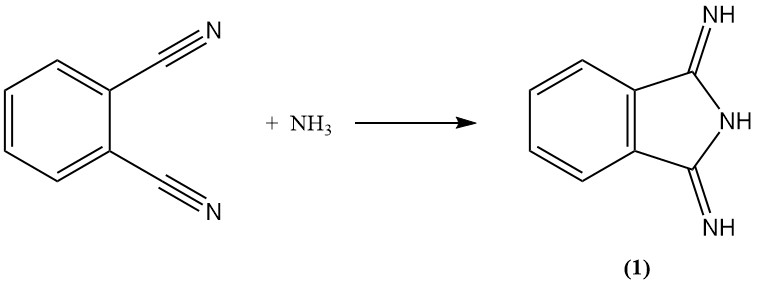
Phthalonitril reagiert mit Ammoniak zu Diiminoisoindolin (1). Dieses Zwischenprodukt kann dann weiter mit aktiven Methylenverbindungen kondensiert werden, um kommerziell wichtige gelbe Pigmente herzustellen.
Phthalonitril kann in Kombination mit bestimmten Promotoren, wie Verbindungen mit Sulfhydrylgruppen, an Aushärtungsreaktionen teilnehmen. Diese Reaktion kann zur Herstellung neuer Materialien eingesetzt werden.
Unter bestimmten Bedingungen können Festkörperreaktionen zwischen Phthalonitril und anderen Verbindungen auftreten. Beispielsweise kann die Dotierung von Phthalonitril mit Diiminoisoindolin eine thermische Reaktivität auslösen, die zur Bildung von Phthalocyanin führt.
Bei hohen Temperaturen über dem Schmelzpunkt kann Phthalonitril polymerisieren, wobei sich seine einzelnen Moleküle zu größeren Ketten verbinden und ein Phthalonitril-basiertes Polymermaterial entsteht.
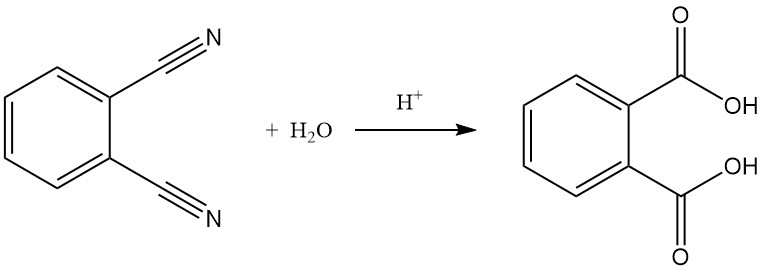
Eine Hydrolyse von Phthalonitril zu Phthalsäure ist möglich, insbesondere unter rauen Bedingungen wie starken Säuren und erhöhten Temperaturen.
Phthalonitril kann im Vergleich zu einem einfachen aromatischen Ring wie Benzol aufgrund der desaktivierenden Wirkung der Nitrilgruppen begrenzte aromatische Substitutionsreaktionen wie Halogenierung, Nitrierung, Sulfonierung, Acylierung und Alkylierung eingehen.
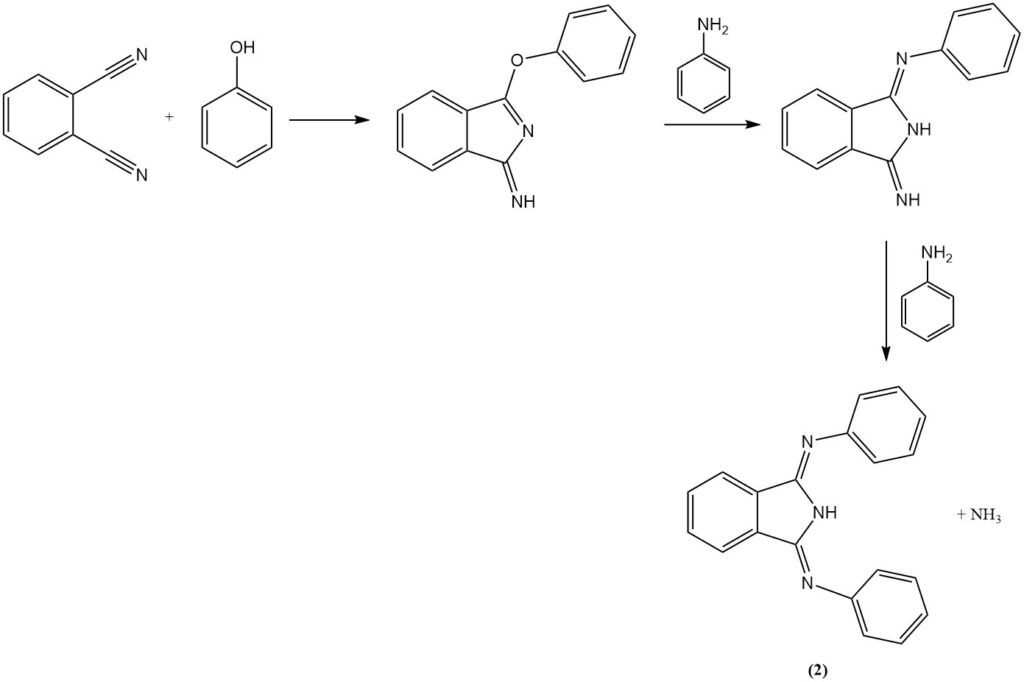
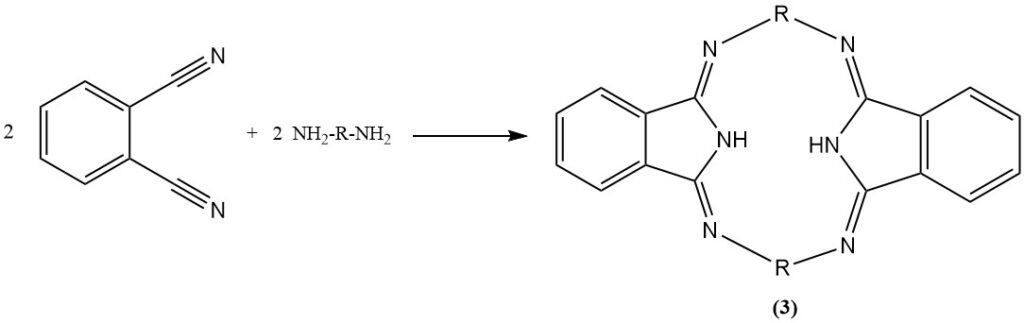
Die Reaktion von Phthalonitril mit Anilin in Gegenwart von Phenol erzeugt eine heterozyklische Verbindung (2) und mit Diaminen entstehen stickstoffhaltige Makroheterocyclen (Hexazocylelane) (3).
Es ist auch möglich, die Nitrilgruppen von Phthalonitril zu hydrieren, um ein Diaminderivat herzustellen.
3. Industrielle Herstellung von Phthalonitril
Phthalonitril wird kommerziell aus o-Xylol, Phthalsäure, Phthalsäureanhydrid, Phthalamid oder Phthalimid hergestellt.
3.1. Herstellung von Phthalonitril aus o-Xylol
Kommerziell wird Phthalonitril hauptsächlich aus o-Xylol durch ein Verfahren namens Ammoxidation hergestellt. Diese einstufige, kontinuierliche Gasphasenreaktion verwendet einen Wirbelschichtreaktor zur effizienten Umwandlung.
Beim Ammoxidationsverfahren werden häufig Metalloxidmischungen verwendet, die Vanadium, Antimon, Chrom und Molybdän enthalten und auf Aluminiumoxid oder Siliciumdioxid aufgebracht sind. Zur Steigerung der Aktivität können Eisen-, Wolfram- und Alkalimetalloxide zugesetzt werden.
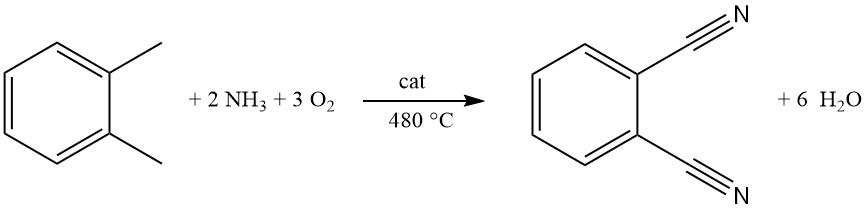
Ein gasförmiges Gemisch aus o-Xylol, Ammoniak und Sauerstoff wird durch eine Verteilerplatte in den Reaktor geleitet. Die optimale Temperatur für diesen drucklosen Prozess liegt bei etwa 480 °C.
Niedrigere Temperaturen erhöhen die Bildung von Nebenprodukten wie Phthalamid und Phthalimid (bis zu 10 %), während höhere Temperaturen (> 500 °C) zur Ammoniakverbrennung führen. Integrierte Kühlsysteme halten trotz der stark exothermen Reaktion eine konstante Temperatur aufrecht.
Heiße Reaktionsgase werden in einem Produktabscheider mit einer wässrigen Phthalonitrilsuspension abgeschreckt. Das abgekühlte Gemisch wird abgesetzt und dekantiert, um das Phthalonitrilprodukt abzutrennen und zu trocknen. Dieses hochreine Produkt mit einem Säure-/Phthalimidgehalt < 0,1 % und einem Wassergehalt < 0,1 % kann direkt zur Herstellung von Phthalocyaninpigmenten verwendet werden und erreicht Ausbeuten von 80–85 %.
Ammoniak wird aus dem Gasstrom nach dem Absetzbecken, der NH3, CO2, CO, N2 und Spuren von HCN enthält, mithilfe einer speziellen Ammoniakrückgewinnungsanlage zurückgewonnen. Das verbleibende Abgas wird verbrannt und das zurückgewonnene Ammoniak wird wieder in den Prozess zurückgeführt.
Nicht umgesetztes o-Xylol und das Zwischenprodukt o-Toluonitril können isoliert oder zur vollständigen Umwandlung in Phthalonitril wieder in den Reaktor eingespeist werden.
Pilotanlagenstudien haben einen kontinuierlichen oxidativen Ammonolyseprozess zur Synthese von Phthalonitril aus o-Xylol untersucht. Dieser Prozess verwendet einen Vanadiumoxid-Molybdänoxid-Katalysator auf Aluminiumoxid- oder Siliciumdioxidträger bei 350–450 °C.
Hier fungiert der Metalloxidkatalysator als Oxidationsmittel, wobei ein Teil kontinuierlich entfernt, erneut oxidiert und zurückgeführt wird. Die Abschreckung von Phthalonitril und die Nebenproduktbehandlung ähneln dem Ammoxidationsprozess.
Nebenprodukte wie o-Toluonitril, Phthalamid und Phthalimid können entweder in den Hauptreaktor zurückgeführt oder in einem separaten Reaktor bei einer Temperatur von 400 °C in Gegenwart von Ammoniak und einem Borphosphat-Aluminiumoxid-Katalysator in Phthalonitril umgewandelt werden.
Ammoniak wird aus dem Restgasgemisch, das NH3, CO2, CO, N2 und Spuren von HCN enthält, zurückgewonnen und in den Reaktor zurückgeführt. Schädliche Gase wie CO und HCN werden in einem Regenerator verbrannt, während N2 und CO2 aus dem Prozessstrom entfernt werden.
3.2. Herstellung von Phthalonitril aus Phthalsäurederivaten
Phthalonitril kann auch aus verschiedenen Phthalsäurederivaten synthetisiert werden, darunter Phthalsäure, Phthalsäureanhydrid, Phthalamid und Phthalimid. Bei diesem Verfahren handelt es sich um eine Gasphasenreaktion unter Ammoniak- und Wasserabspaltung bei Temperaturen im Bereich von 300 bis 500 °C in Gegenwart eines Katalysators.
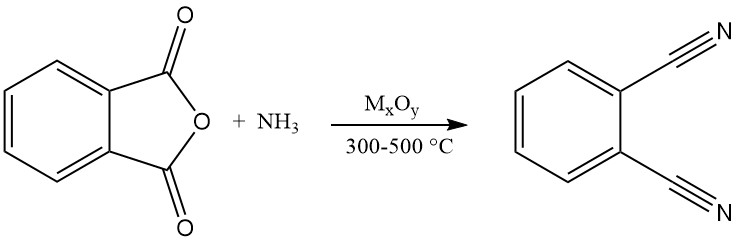
In der Patentliteratur wird die Verwendung von Metalloxidkatalysatoren auf Siliciumdioxid, Aluminiumoxid, Phosphaten, Silikaten, Boraten oder basischem Aluminiumoxid vorgeschlagen. Beispiele hierfür sind Oxide von Thorium, Kupfer, Beryllium, Zirkonium oder Wolfram.
Geschmolzenes Phthalsäureanhydrid wird zunächst auf etwa 160 °C erhitzt und in einem speziellen Apparat verdampft. Anschließend wird vorgewärmtes zirkulierendes Gas mit einer hohen Ammoniakkonzentration (NH3 ≈ 90 %) in den Verdampfer eingeleitet.
Diese Mischung reagiert bei nahezu atmosphärischem Druck bei einer Temperatur zwischen 350 und 400 °C in einem Festbettreaktor, der hinter dem Verdampfer angeordnet ist. In diesem Reaktor wird typischerweise ein Aluminiumoxidkatalysator verwendet.
Das heiße Reaktionsgas, das den Reaktor verlässt, wird mit Wasser abgeschreckt. Phthalonitril wird dann durch Dekantier- und Trocknungsprozesse von der resultierenden wässrigen Suspension getrennt. Die Ammoniakkonzentration im zirkulierenden Gas wird durch kontinuierliche Ammoniakzugabe bei etwa 90 % gehalten.
Phthalonitril kann durch Dehydratation von Phthalamid unter Verwendung von Säurehalogeniden wie Phosgen oder Thionylchlorid gebildet werden. Dieses Verfahren erfordert jedoch zusätzliche Schritte, um die Hydrolyse des Phthalamids durch die erzeugte Säure zu verhindern.
Zu den Techniken, die zur Überwindung dieses Problems eingesetzt werden, gehören die Zugabe von Verdünnungsmitteln (Benzol, Chlorbenzol) oder die Verwendung von tertiären Aminen (N,N-Diethyl-o-toluidin, Pyridin) oder acylierten sekundären Aminen (N-Methylformamid) zur Neutralisierung der Säure.
Dieses alternative Verfahren umfasst im Allgemeinen komplexe Verfahren und zusätzliche chemische Handhabung, was es im Vergleich zu den etablierten Verfahren für die Produktion im großen Maßstab weniger günstig macht.
4. Verwendung von Phthalonitril
Phthalonitril wird als Rohstoff bei der Herstellung von Phthalocyaninpigmenten, fluoreszierenden Aufhellern und fotografischen Sensibilisatoren verwendet.
Die Herstellung von Phthalocyaninpigmenten, die für ihre intensiven Farben und außergewöhnliche Haltbarkeit bekannt sind, ist die wichtigste industrielle Anwendung von Phthalonitril. Durch die Reaktion von Phthalonitril mit verschiedenen Metallvorläufern entsteht eine breite Palette an Farben. Diese Pigmente werden in Farben, Kunststoffen, Textilien und Tinten verwendet.
5. Toxikologie von Phthalonitril
Akute Toxizität
- Orale LD50 (Ratte): 30-125 mg/kg.
- Bei Kaninchen wurden keine Haut- oder Augenreizungen beobachtet.
- Es gibt keine Hinweise auf eine Sensibilisierung bei Arbeitern, die an der Herstellung und Verwendung von Phthalonitril beteiligt sind.
Toxizität bei wiederholter Gabe
- Nach wiederholter oraler Exposition wurden bei Ratten und Mäusen neurotoxische Effekte (Krämpfe, erhöhte Erregung) beobachtet.
- In einer 13-wöchigen Neurotoxizitätsstudie an Ratten mit 10 und 25 mg Phthalonitril/kg/Tag wurden erhöhte Aktivität und Körpergewichtsabnahmen festgestellt. Es wurde kein histopathologischer Zusammenhang für Verhaltensänderungen festgestellt. NOAEL in dieser Studie war 3 mg/kg/Tag.
- Berufliche Exposition hat bei Arbeitern zu verzögerten (Stunden bis Tage) epileptiformen Krämpfen geführt, die Minuten andauerten.
- Klinische Untersuchungen von 81 Arbeitern mit einer durchschnittlichen 8,5-jährigen Phthalonitril-Exposition (darunter 11 mit akuten Vergiftungen) zeigten keine Anomalien in klinischer Chemie, Hämatologie, Neurologie oder EEG.
- Dermale Exposition kann ebenfalls relevant sein.
- Anti-Cyanid-Maßnahmen gelten aufgrund eines fehlenden Cyanid-Stoffwechsels als nicht wirksam.
Genotoxizität
- Phthalonitril war im Ames-Test oder im CHO/HGPRT-Genmutationstest nicht mutagen.
- Negative Ergebnisse im Maus-Mikronukleustest.
- Bei Arbeitern, einschließlich derjenigen mit akuter Vergiftung, wurden keine erhöhten Chromosomenaberrationen beobachtet.
Karzinogenität
Studien berichten von Leukämieinduktion bei Ratten und Mäusen nach oraler, subkutaner und perkutaner Verabreichung (Mäuse). Vage Studienbeschreibungen schränken jedoch eine abschließende Beurteilung ein.
Referenzen
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://www.sciencedirect.com/science/article/abs/pii/S0032386118302945
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalonitrile
- Reaction of O-phthalonitrile with aniline. – https://link.springer.com/article/10.1007/BF00954275
