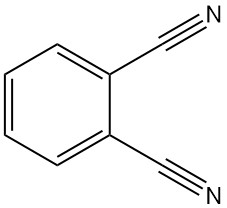
Qu’est-ce que le phtalonitrile ?
Le phtalonitrile, également connu sous le nom de 1,2-dicyanobenzène ou 1,2-benzènedicarbonitrile, est un composé organique de formule C8H4N2. Il s’agit d’une poudre cristalline de couleur jaune-gris pâle et d’une légère odeur aromatique, semblable au benzonitrile.
Le phtalonitrile a été découvert pour la première fois en 1896, lors de la diazotation du 2-aminobenzonitrile.
Table des matières
1. Propriétés physiques du phtalonitrile
Le phtalonitrile est un solide cristallin qui n’est pas soluble dans l’eau (environ 1 g/L) mais qui est soluble dans les solvants organiques comme l’éthanol, l’acétone, le nitrobenzène, le benzonitrile et l’éther.
Le phtalonitrile ne peut pas être distillé et subit une polymérisation lorsqu’il est chauffé au-dessus de son point de fusion. Il n’est pas explosif et son inflammation est difficile, mais la poussière peut exploser.
Le tableau 1 présente les propriétés physiques importantes du phtalonitrile.
| Propriété | Valeur |
|---|---|
| Numéro CAS | []91-15-6] |
| Formule | C6H4N2 |
| Poids moléculaire | 128,14 g/mol |
| Point de fusion | 141 °C |
| Point d'ébullition | 304,5 °C (décomposition) |
| Densité | 1,238 g/cm3 |
| Densité apparente | ≈ 0,5 g/cm3 |
| Point d'éclair | 162 °C |
| Chaleur de combustion | 4013 kJ/mol |
| Chaleur d'évaporation | 67 kJ/mol |
| Capacité thermique spécifique (30 °C) | 1,30 J g-1 K-1 |
| Pression de vapeur (20 °C) | 0,05 mbar |
| Température d'auto-inflammation | > 580 °C |
2. Réactions du phtalonitrile
Le phtalonitrile subit plusieurs réactions importantes typiques des groupes nitriles et des composés aromatiques, dont certains sont utilisés dans l’industrie.
Le phtalonitrile réagit avec divers précurseurs métalliques, tels que le chlorure de cuivre, à une température d’environ 180 °C dans un solvant pour former des pigments de phtalocyanine intensément colorés et durables.
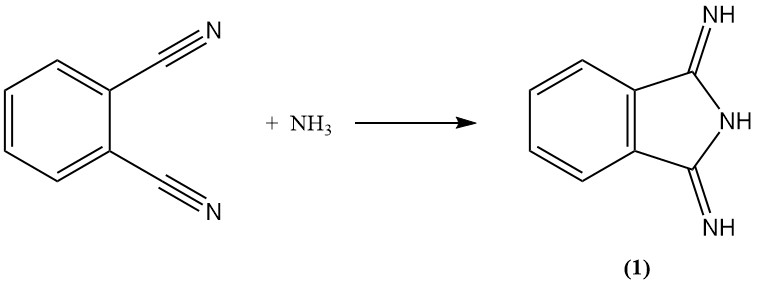
Le phtalonitrile réagit avec l’ammoniac pour former de la diiminoisoindoline (1). Cet intermédiaire peut ensuite être condensé avec des composés méthylène actifs pour produire des pigments jaunes commercialement importants.
Le phtalonitrile peut participer à des réactions de durcissement lorsqu’il est associé à des promoteurs spécifiques, comme des composés contenant des groupes sulfhydryle. Cette réaction a des applications potentielles pour la création de nouveaux matériaux.
Dans des conditions spécifiques, des réactions à l’état solide peuvent se produire entre le phtalonitrile et d’autres composés. Par exemple, le dopage du phtalonitrile avec de la diiminoisoindoline peut induire une réactivité thermique, conduisant à la formation de phtalocyanine.
À des températures élevées au-dessus du point de fusion, le phtalonitrile peut subir une polymérisation, où ses molécules individuelles se lient pour former des chaînes plus grandes, créant un matériau polymère à base de phtalonitrile.
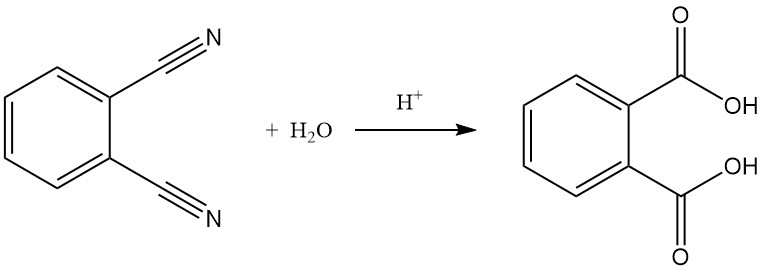
L’hydrolyse du phtalonitrile en acide phtalique est possible, en particulier dans des conditions comme des acides forts et des températures élevées.
Le phtalonitrile peut subir des réactions de substitution aromatique limitées telles que l’halogénation, la nitration, la sulfonation, l’acylation et l’alkylation par rapport à un cycle aromatique simple comme le benzène en raison de l’effet désactivant des groupes nitriles.
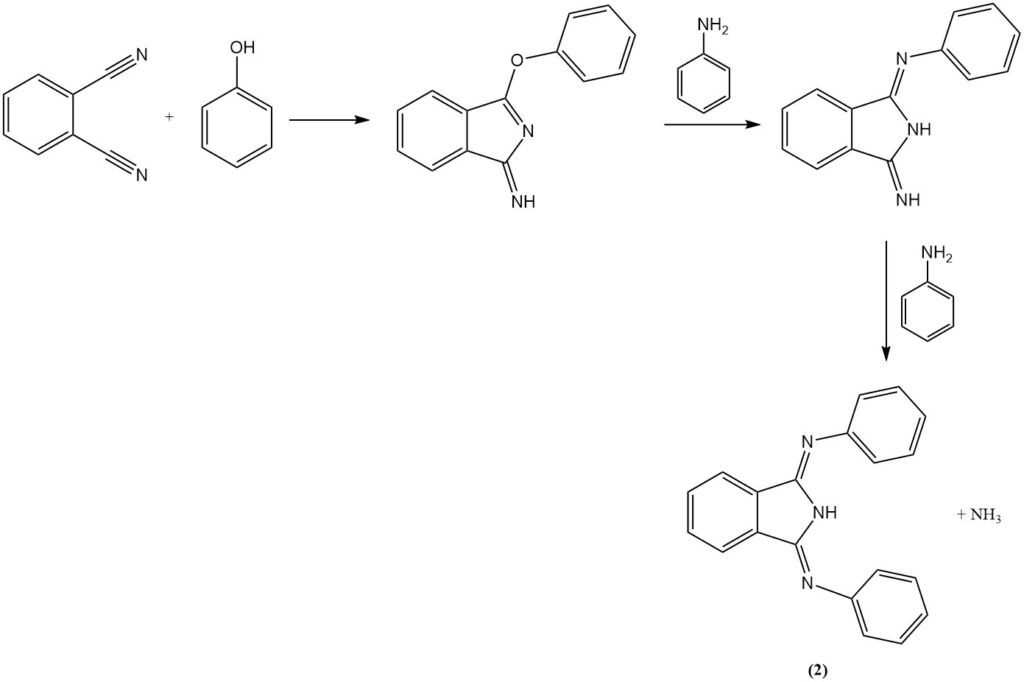
La réaction du phtalonitrile avec l’aniline en présence de phénol produit un composé hétérocyclique (2) et avec des diamines produit des macrohétérocycles contenant de l’azote (hexazocyelanes) (3).
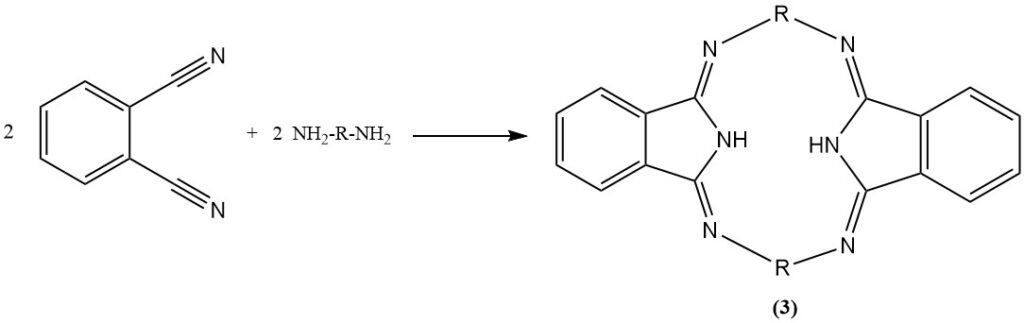
Il est également possible d’hydrogéner les groupes nitriles du phtalonitrile pour produire un dérivé diamine.
3. Production industrielle de phtalonitrile
Le phtalonitrile est produit commercialement à partir d’o-xylène, d’acide phtalique, d’anhydride phtalique, de phtalamide ou de phtalimide.
3.1. Production de phtalonitrile à partir d’o-xylène
Dans le commerce, le phtalonitrile est principalement produit à partir d’o-xylène par un procédé appelé ammoxydation. Cette réaction continue en phase gazeuse à une seule étape utilise un réacteur à lit fluidisé pour une conversion efficace.
Dans le processus d’ammoxydation, les mélanges d’oxydes métalliques contenant du vanadium, de l’antimoine, du chrome et du molybdène supportés sur de l’alumine ou de la silice sont des catalyseurs couramment utilisés. Des oxydes de fer, de tungstène et de métaux alcalins peuvent être ajoutés pour améliorer l’activité.
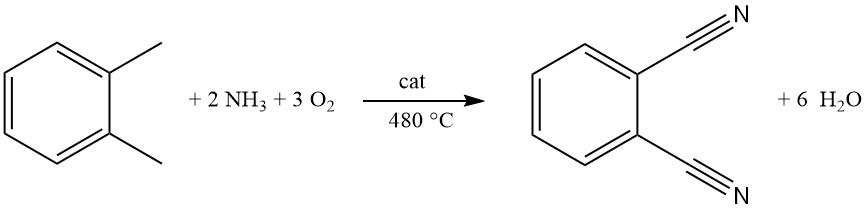
Un mélange gazeux d’o-xylène, d’ammoniac et d’oxygène est introduit dans le réacteur par l’intermédiaire d’une plaque de distribution. La température optimale pour ce procédé sans pression est d’environ 480 °C.
Les températures plus basses augmentent les sous-produits tels que le phtalamide et le phtalimide (jusqu’à 10 %), tandis que les températures plus élevées (> 500 °C) conduisent à la combustion de l’ammoniac. Les systèmes de refroidissement intégrés maintiennent une température constante malgré la réaction hautement exothermique.
Les gaz de réaction chauds sont refroidis avec une suspension aqueuse de phtalonitrile dans un décanteur de produit. Le mélange refroidi est décanté et décanté pour séparer et sécher le produit phtalonitrile. Ce produit de haute pureté avec une teneur en acide/phtalimide < 0,1 % et une teneur en eau < 0,1 % peut être directement utilisé pour la production de pigments de phtalocyanine, atteignant des rendements de 80 à 85 %.
L’ammoniac est récupéré à partir du flux de gaz post-décantation, qui contient du NH3, du CO2, du CO, du N2, et des traces de HCN, à l’aide d’une usine de récupération d’ammoniac dédiée. Le gaz d’échappement restant est brûlé et l’ammoniac récupéré est recyclé dans le procédé.
L’o-xylène non réagi et l’o-toluonitrile intermédiaire peuvent être isolés ou réinjectés dans le réacteur pour une conversion complète en phtalonitrile.
Des études en usine pilote ont exploré un procédé d’ammonolyse oxydative continue pour la synthèse du phtalonitrile à partir de l’o-xylène. Ce procédé utilise un catalyseur à base d’oxyde de vanadium et d’oxyde de molybdène sur un support en alumine ou en silice à 350–450 °C.
Ici, le catalyseur à base d’oxyde métallique agit comme oxydant, une partie étant continuellement retirée, réoxydée et recyclée. L’extinction du phtalonitrile et la gestion des sous-produits sont similaires au procédé d’ammoxydation.
Les sous-produits tels que l’o-toluonitrile, le phtalamide et le phtalimide peuvent être soit réintroduits dans le réacteur principal, soit convertis en phtalonitrile dans un réacteur séparé à une température de 400 °C en présence d’ammoniac et d’un catalyseur phosphate de bore-alumine.
L’ammoniac est récupéré à partir du mélange gazeux résiduel, qui contient du NH3, du CO2, du CO, du N2et des traces de HCN, et recyclé vers le réacteur. Les gaz nocifs comme le CO et le HCN sont brûlés dans un régénérateur, tandis que le N2 et le CO2 sont éliminés du flux de traitement.
3.2. Production de phtalonitrile à partir de dérivés d’acide phtalique
Le phtalonitrile peut également être synthétisé à partir de divers dérivés d’acide phtalique, notamment l’acide phtalique, l’anhydride phtalique, le phtalamide et le phtalimide. Ce procédé implique une réaction en phase gazeuse avec élimination d’ammoniac et d’eau à des températures allant de 300 à 500 °C en présence d’un catalyseur.
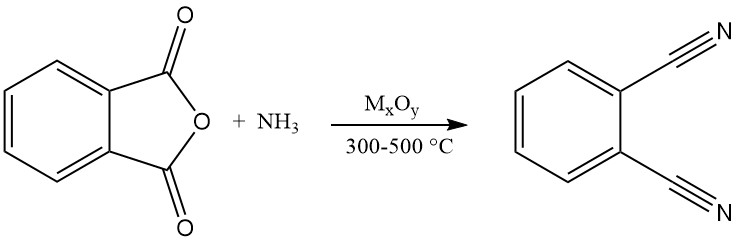
La littérature sur les brevets suggère l’utilisation de catalyseurs à base d’oxydes métalliques supportés sur de la silice, de l’alumine, des phosphates, des silicates, des borates ou de l’alumine basique. Les exemples incluent les oxydes de thorium, de cuivre, de béryllium, de zirconium ou de tungstène.
L’anhydride phtalique fondu est d’abord chauffé à environ 160 °C et vaporisé dans un appareil dédié. Un gaz circulant préchauffé contenant une concentration élevée d’ammoniac (NH3 ≈ 90 %) est ensuite introduit dans le vaporisateur.
Ce mélange réagit à une pression proche de la pression atmosphérique à une température comprise entre 350 et 400 °C dans un réacteur à lit fixe placé en aval du vaporisateur. Un catalyseur à base d’alumine est généralement utilisé dans ce réacteur.
Le gaz de réaction chaud sortant du réacteur est trempé avec de l’eau. Le phtalonitrile est ensuite séparé de la suspension aqueuse résultante par des processus de décantation et de séchage. La concentration d’ammoniac dans le gaz en circulation est maintenue à environ 90 % grâce à l’ajout continu d’ammoniac.
Le phtalonitrile peut être formé par déshydratation du phtalocyanine à l’aide d’halogénures d’acides tels que le phosgène ou le chlorure de thionyle. Cependant, cette méthode nécessite des étapes supplémentaires pour empêcher l’hydrolyse du phtalocyanine par l’acide généré.
Les techniques utilisées pour surmonter ce problème comprennent l’ajout de diluants (benzène, chlorobenzène) ou l’utilisation d’amines tertiaires (N,N-diéthyl-o-toluidine, pyridine) ou d’amines secondaires acylées (N-méthylformamide) pour neutraliser l’acide.
Ce procédé alternatif implique généralement des procédures complexes et une manipulation chimique supplémentaire, ce qui le rend moins favorable à la production à grande échelle par rapport aux voies établies.
4. Utilisations du phtalonitrile
Le phtalonitrile est utilisé comme matière première dans la production de pigments de phtalocyanine, d’azurants fluorescents et de sensibilisateurs photographiques.
La production de pigments de phtalocyanine, connus pour leurs couleurs intenses et leur durabilité exceptionnelle, est l’application industrielle la plus importante du phtalonitrile. La réaction du phtalonitrile avec divers précurseurs métalliques donne une large gamme de couleurs. Ces pigments sont utilisés dans les peintures, les plastiques, les textiles et les encres.
5. Toxicologie du phtalonitrile
Toxicité aiguë
- DL50 orale (rat) : 30-125 mg/kg.
- Aucune irritation cutanée ou oculaire n’a été observée chez les lapins.
- Il n’existe aucune preuve de sensibilisation chez les travailleurs impliqués dans la production et l’utilisation du phtalonitrile.
Toxicité à doses répétées
- Des effets neurotoxiques (convulsions, augmentation de l’excitation) ont été observés chez des rats et des souris après une exposition orale répétée.
- Une augmentation de l’activité et une diminution du poids corporel ont été signalées dans une étude de neurotoxicité sur des rats de 13 semaines à 10 et 25 mg de phtalonitrile/kg/jour. Aucun lien histopathologique n’a été trouvé pour les changements comportementaux. La dose sans effet nocif observé (NOAEL) dans cette étude était de 3 mg/kg/jour.
- L’exposition professionnelle a entraîné des convulsions épileptiformes retardées (de quelques heures à quelques jours) durant quelques minutes chez les travailleurs.
- Les examens cliniques de 81 travailleurs ayant été exposés en moyenne pendant 8,5 ans au phtalonitrile (dont 11 avec intoxication aiguë) n’ont montré aucune anomalie en chimie clinique, hématologie, neurologie ou EEG.
- L’exposition cutanée peut également être pertinente.
- Les mesures anti-cyanure ne sont pas considérées comme efficaces en raison d’un manque de métabolisme du cyanure.
Génotoxicité
- Le phtalonitrile n’était pas mutagène dans le test d’Ames ou dans le test de mutation génétique CHO/HGPRT.
- Résultats négatifs dans le test du micronoyau chez la souris.
- Aucune augmentation des aberrations chromosomiques n’a été observée chez les travailleurs, y compris chez ceux ayant subi une intoxication aiguë.
Cancérogénicité
Des études font état d’une induction de leucémie chez des rats et des souris après administration orale, sous-cutanée et percutanée (souris). Cependant, des descriptions d’études vagues limitent l’évaluation concluante.
Références
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://www.sciencedirect.com/science/article/abs/pii/S0032386118302945
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalonitrile
- Reaction of O-phthalonitrile with aniline. – https://link.springer.com/article/10.1007/BF00954275




