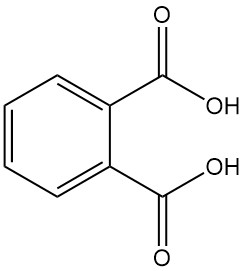
L’acide phtalique, également connu sous le nom d’acide o-phtalique ou acide 1,2-benzènedicarboxylique, est un acide dicarboxylique aromatique de formule chimique C8H6O4. Il s’agit d’un solide cristallin blanc qui n’a pas d’importance industrielle. Il est formé comme sous-produit lors de la fabrication de l’anhydride phtalique.
L’acide phtalique se trouve naturellement dans certaines plantes, telles que Papaver somniferum, Cocos nucifera et d’autres organismes et animaux. Il a été découvert pour la première fois en 1836 par le chimiste français A. Laurent comme produit de l’oxydation du naphtalène.
Table des matières
1. Propriétés physiques de l’acide phtalique
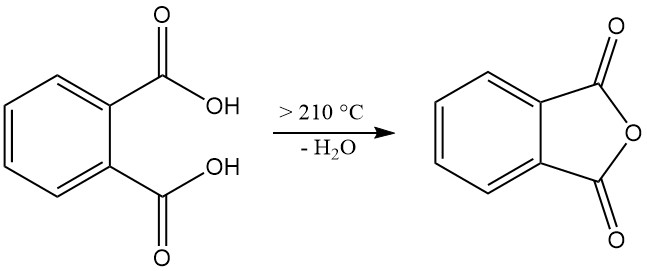
L’acide phtalique [88-99-3] est un acide diprotique faible avec des constantes de dissociation pKa1 = 2,89 et pKa2 = 5,51. Il forme des cristaux monocliniques incolores avec un point de fusion de 191 °C dans un tube scellé qui se transforment en anhydride phtalique avec élimination de l’eau à des températures supérieures à 210 °C.
L’acide phtalique est soluble dans l’eau bouillante (100 °C), 18 g/100 ml, et est beaucoup moins soluble dans l’eau froide (14 °C), 0,54 g/100 ml. Il est soluble dans l’éthanol (10 g/100 ml) et le méthanol (19,5 g/100 ml) et insoluble dans le chloroforme et l’éther.
Certaines des propriétés physiques importantes de l’acide phtalique sont répertoriées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Formule | C8H6O4 |
| Poids moléculaire | 166,14 g/mol |
| Point de fusion | 191 °C (en tube scellé) Décomposition à 210 °C |
| Densité à 15 °C | 1,593 g/cm3 |
| Densité de vapeur | 5.7 |
| Chaleur de fusion | 315,3 J/g |
| Chaleur spécifique d'un solide (0 à 99 °C) | 1,214 J g-1 K-1 |
| Chaleur de combustion | 19657.03 J/g |
| Chaleur de formation | 43714.34 J/g |
| Chaleur de la solution à 25 °C | 123,55 J/g |
| Point éclair | 168 °C |
2. Réactions de l’acide phtalique
L’acide phtalique subit des réactions chimiques typiques des acides carboxyliques et des composés aromatiques.
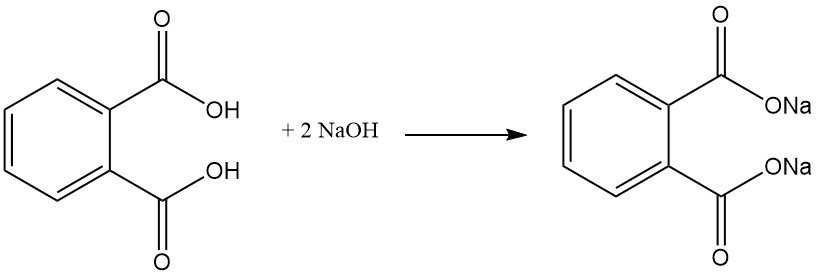
L’acide phtalique est un acide diprotique faible qui réagit avec des bases telles que NaOH ou KOH et des oxydes métalliques pour former des sels appelés phtalates. Ces sels peuvent être solubles dans l’eau (sels formés avec des métaux alcalins (par exemple sodium, potassium)) ou insolubles, comme les phtalates de calcium et de magnésium.
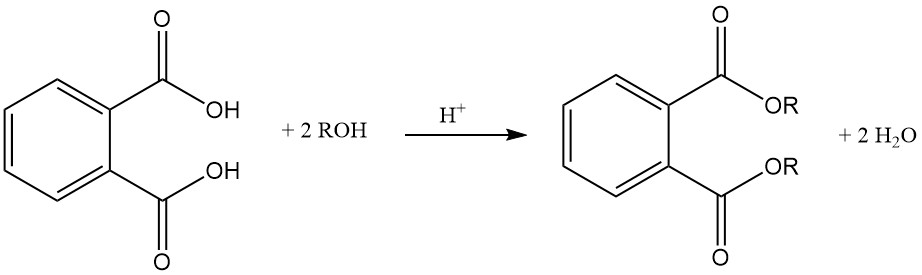
L’acide phtalique réagit avec les alcools en présence d’un catalyseur acide (acide sulfurique) pour former des diesters de phtalates. Ces esters sont des produits chimiques industriels utiles avec diverses applications.
Lorsqu’il est chauffé à 210 °C ou plus, l’acide phtalique subit une déshydratation pour produire de l’anhydride phtalique.
L’acide phtalique peut subir des réactions de substitution aromatique ; cependant, la présence des deux groupes acide carboxylique le désactive. Dans des conditions spécifiques et difficiles, une fonctionnalisation plus poussée du cycle aromatique pourrait être possible.
3. Production d’acide phtalique
L’acide phtalique est formé comme sous-produit dans la fabrication de l’anhydride phtalique par hydrolyse. L’acide phtalique n’est pas important dans l’industrie. Au lieu de cela, l’anhydride phtalique est produit industriellement puis converti en acide phtalique si nécessaire.
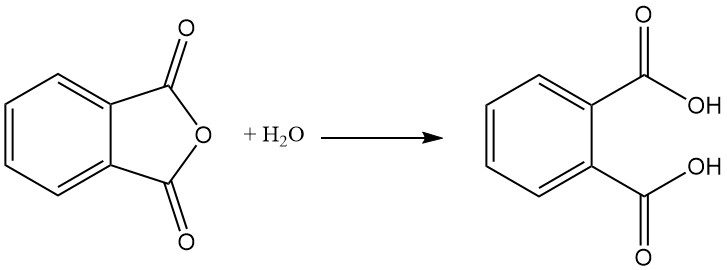
L’anhydride phtalique est préparé par oxydation catalytique du naphtalène ou de l’orthoxylène (o-xylène) à haute température et utilise souvent une configuration de réacteur tubulaire à lit fixe.
Un brevet de 1979 décrivait la production d’acide phtalique par oxydation liquide continue de l’o-xylène avec de l’air dans un réacteur agité. La réaction est réalisée à une température comprise entre 160 °C et 200 °C et une pression comprise entre 21 et 29 kg/cm2.
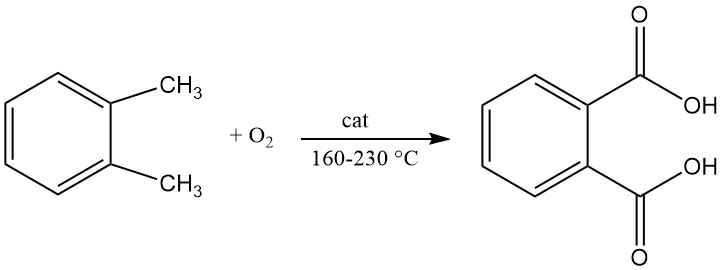
Le catalyseur utilisé dans ce procédé contenait un mélange de cobalt, de manganèse et de brome et la teneur en eau dans le milieu réactionnel est comprise entre 0,2 % et 7 %.
L’air est utilisé comme oxydant et le mélange liquide résultant contient 8 à 40 % d’acide phtalique et 6 à 30 % d’o-xylène. Ce mélange liquide est introduit en continu, avec de l’air supplémentaire, dans un deuxième réacteur agité.
La température dans ce deuxième réacteur est maintenue entre 210°C et 230°C. Il est important de noter qu’un catalyseur frais, contenant au moins 1 milligramme d’atome de cobalt par mole de xylène traité (par rapport à la première étape), est ajouté ici.
Cette réaction en deux étapes donne un effluent liquide riche en acide phtalique (85 à 92 %). Cependant, il contient également de l’eau, des impuretés comme l’acide benzoïque et des composés à point d’ébullition plus élevé.
4. Utilisations de l’acide phtalique
L’acide phtalique est utilisé comme réactif d’analyse et de laboratoire et pour fabriquer des médicaments, des colorants, du phtalimide, de l’acide anthranilique, des esters d’acide phtalique et des parfums synthétiques.
L’acide phtalique peut être utilisé comme précurseur de l’anhydride phtalique, qui est plus précieux et est utilisé dans diverses industries comme les peintures, les plastiques, les textiles et les produits pharmaceutiques.
5. Toxicologie et dangers de l’acide phtalique
L’acide phtalique est un intermédiaire produit et ensuite utilisé dans l’industrie dans des conditions bien contrôlées. Une exposition professionnelle peut survenir mais devrait être faible. L’exposition du grand public à l’acide phtalique est faible et négligeable.
Malgré le nombre limité d’études toxicologiques disponibles, les données existantes suggèrent une faible toxicité de l’acide phtalique. Les études de toxicité aiguë chez la souris (injection intrapéritonéale) indiquent une dose mortelle médiane (DL50) de 550 mg/kg.
Après exposition, la majorité de l’acide phtalique est excrétée dans l’urine, soit directement (comme chez le chien), soit partiellement conjuguée (comme chez le rat et le lapin). Une petite partie peut subir une décarboxylation et être éliminée sous forme d’acide benzoïque.
Références
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://patents.google.com/patent/US4215053A/en
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalic-acid


