Méthodes de production des aldéhydes aliphatiques
Les aldéhydes sont désignés par la formule chimique générale RCHO, où R peut représenter l’hydrogène ou une gamme variée de groupes aliphatiques, aromatiques ou hétérocycliques. Conformément à la nomenclature IUPAC, les aldéhydes sont reconnus par le suffixe « al » ; mais, de nombreux aldéhydes sont encore appelés par leurs noms communs.
La principale méthode de production d’aldéhydes est la synthèse oxo, réalisée par une oxydation douce (déshydrogénation) des alcools primaires et des procédés spécialisés d’oxydation des oléfines. Dans les huiles essentielles de diverses plantes, des traces d’aldéhydes sont naturellement présentes. L’acétaldéhyde, sous-produit de la fermentation alcoolique, se forme par décarboxylation de l’acide pyruvique intermédiaire.
Les aldéhydes ont des rôles biologiques importants, tels que l’implication du 11-cis-rétinien dans le processus visuel et la participation du pyridoxal dans la transamination des acides aminés.
L’isolement d’aldéhydes à partir de sources naturelles n’a d’importance commerciale que dans quelques cas, comme la production d’aldéhydes parfumés à chaîne plus longue.
Table des matières
1. Production d’aldéhydes saturés
Alors que de nombreuses méthodes de synthèse des aldéhydes ont été découvertes, seules quelques-unes sont utilisées à l’échelle industrielle. Cela est souvent dû à la disponibilité de matières premières appropriées. Les procédés suivants sont les plus significatifs pour la préparation d’aldéhydes aliphatiques saturés :
- Hydroformylation des oléfines, communément appelée synthèse oxo.
- Déshydrogénation ou oxydation d’alcools primaires, principalement utilisés pour la production de formaldéhyde à partir de méthanol.
- Hydratation de l’acétylène, entraînant la formation d’acétaldéhyde (également appelé éthanal).
- Oxydation de l’éthylène pour donner de l’acétaldéhyde.
- Oxydation des hydrocarbures saturés, en particulier des hydrocarbures C3 et C4, pour produire des aldéhydes inférieurs.
Les synthèses spécifiques pour la production d’aldéhydes utilisés dans l’industrie de la parfumerie sont également importantes.
1.1. Synthèse Oxo
La synthèse oxo se distingue comme la méthode la plus importante pour produire des aldéhydes composés d’au moins trois atomes de carbone (appelée synthèse oxo). Dans ce procédé particulier, les oléfines subissent une réaction avec le gaz de synthèse, qui est un mélange de monoxyde de carbone (CO) et d’hydrogène (H2). À la suite de cette réaction, des aldéhydes avec un atome de carbone supplémentaire par rapport à l’oléfine de départ sont formés.

La formation de produits purs ne se produit que lorsqu’il s’agit de molécules d’oléfines symétriques ou à encombrement stérique. Cependant, dans d’autres cas, on obtient un mélange de composés linéaires et ramifiés. En sélectionnant avec soin des catalyseurs appropriés et en contrôlant les conditions de réaction, le rapport entre les produits aldéhydes normaux (n) et iso (ramifiés) peut être ajusté sur une large plage.
1.2. Déshydrogénation/oxydation des alcools primaires
Les réactions de déshydrogénation, d’oxydation et de déshydrogénation oxydative sont représentées par les équations suivantes :
- RCH2OH → RCHO + H2; ΔH = +84 kJ/mol for R = CH3 (Equation 1)
- RCH2OH + 1/2 O2 → RCHO + H2O; ΔH = -159 kJ/mol for R = H (Equation 2)
- RCH2OH → RCHO + H2; H2 + 1/2 O2 → H2O; ΔH = -159 kJ/mol for R = H (Equation 3)
Déshydrogénation : La réaction de déshydrogénation endothermique des alcools se produit à la pression atmosphérique et à des températures allant de 250 à 400°C, en utilisant généralement des catalyseurs Cu ou Ag. Ces catalyseurs sont souvent activés avec des éléments tels que Zr, Co ou Cr.
Le procédé offre l’avantage d’une récupération simultanée de l’hydrogène, qui peut être utilisé sans purification supplémentaire. C’est une réaction d’équilibre, nécessitant des températures élevées et des temps de séjour courts pour une efficacité économique.
Le procédé trouve une utilisation commerciale dans la préparation d’acétaldéhyde à partir d’éthanol. La déshydrogénation en phase gazeuse avec un catalyseur au cuivre activé par le cérium est conduite à pression atmosphérique et à 270-300°C, convertissant 25-50% d’éthanol par débit, avec une sélectivité de 90-95% pour l’acétaldéhyde, ainsi que la formation de sous-produits tels que comme l’acétate d’éthyle, l’éthylène, le crotonaldéhyde et les alcools supérieurs.
Oxydation : le processus d’oxydation décrit par l’équation (2) est réalisé en utilisant un excès d’air ou d’oxygène et un catalyseur contenant 18-19 % en poids de Fe2O3 et 81-82 % en poids de MoO3 à des températures allant de 350 à 450 °C. Cette méthode est employée dans la production de formaldéhyde.
Déshydrogénation oxydative : L’équation (3) combine la déshydrogénation endothermique de l’alcool avec la combustion exothermique de l’hydrogène formé, résultant en une réaction exothermique globale.
Dans le procédé industriel, les deux réactions se produisent simultanément lorsque des quantités sous-stoechiométriques d’oxygène ou d’air sont utilisées. Il est crucial de considérer les plages d’explosion des mélanges alcool-air lors de l’oxydation et de la déshydrogénation oxydative.
La déshydrogénation oxydative est le processus le plus important pour produire des aldéhydes à partir d’alcools. Les catalyseurs à l’argent sont préférés, mais les catalyseurs au cuivre sont également utilisés. Dans la production de formaldéhyde à partir de méthanol, les cristaux d’argent (granulométrie 0,2-3 mm), les filets d’argent ou l’argent sur Al2O3 atteignent une conversion de 75 à 99 % à des températures de 500 à 720 °C et des temps de séjour inférieurs à 0,01 s.
En 2006, environ 7 % de la production d’acétaldéhyde de l’Europe de l’Ouest provenait de l’éthanol. L’argent et le cuivre étaient les principaux catalyseurs utilisés, avec des conversions d’éthanol de 30 à 50 % par débit et une sélectivité en acétaldéhyde de 85 à 95 %. La température de réaction variait entre 300 et 600°C selon la quantité d’air. Les sous-produits comprenaient l’acétate d’éthyle, l’acide formique, l’acide acétique et le dioxyde de carbone.
Aldéhydes parfumés : Les procédés de déshydrogénation et d’oxydation sont également préférés pour synthétiser les aldéhydes parfumés. Un procédé spécialisé permet la déshydrogénation catalytique des alcools C5-C14 en présence d’hydrogène et d’air, à l’aide de catalyseurs au cuivre ou à l’argent, éventuellement combinés avec Zn, Cr ou Cr2O3.
D’autres systèmes catalytiques décrits dans la littérature comprennent Cu/MgO, Ag/Na2O sur des supports, des mélanges de MnO, NiO sur MgO ou CuCl avec un ligand contenant de l’azote tel que le 2,20-bipyridyle.
1.3. Oxydation des Hydrocarbures
Celanese a mis au point un procédé d’oxydation des alcanes en C3 et C4, mais cette méthode produit un mélange réactionnel complexe qui nécessite des étapes d’extraction et de distillation coûteuses.
Dans ce procédé, des mélanges de propane et de propane-butane sont mis à réagir en phase gazeuse à des températures allant de 425 à 460°C et des pressions de 0,7 à 0,8 MPa. Le taux de conversion est d’environ 20%, avec un déficit en oxygène présent lors de la réaction. La réaction procède par un mécanisme radicalaire.
Le mélange réactionnel obtenu à partir de ce procédé est principalement constitué d’acétaldéhyde (≈ 20 %), de formaldéhyde (≈ 15 %), de méthanol (≈ 19 %) et d’acides organiques (≈ 11 %).
Cependant, malgré ces composants, le processus est considéré comme dépassé sur le plan technologique. De plus, l’oxydation du méthane ou de l’éthane par cette méthode n’a aucune signification pratique.
1.4. Oxydation des oléfines
La principale et cruciale voie industrielle de production d’acétaldéhyde est l’oxydation partielle de l’éthylène en phase aqueuse, réalisée en présence de chlorures de palladium et de cuivre. Ce processus est connu sous le nom de processus Wacker-Hoechst.
Un autre procédé d’oxydation utilisé pour préparer des aldéhydes à partir d’oléfines est la synthèse d’acroléine, qui implique la conversion du propène.
1.5. Processus divers
Le procédé qui consiste à ajouter de l’eau à l’acétylène pour produire de l’acétaldéhyde a perdu de son importance par rapport aux procédés alternatifs à base d’éthylène ou d’éthanol. En Europe occidentale, les dernières usines utilisant ce procédé ont été fermées en 1980.
L’importance réduite du procédé à base d’acétylène est attribuée à la disponibilité et au coût inférieur de l’éthylène, ainsi qu’à la sélectivité supérieure de sa conversion. De plus, l’utilisation de sulfate de mercure nocif pour l’environnement en tant que catalyseur a contribué à rendre le processus pratiquement obsolète.
2. Production d’aldéhydes insaturés
Les aldéhydes α,β-insaturés inférieurs, y compris l’acroléine, le crotonaldéhyde ou le 2-éthyl-2-hexénal, sont principalement obtenus par des procédés de synthèse. Cependant, certaines huiles essentielles peuvent servir de matières premières à des homologues supérieurs, comme le citral ou le citronellal.
Il existe deux principaux procédés industriels de fabrication des aldéhydes α,β-insaturés :
1. Oxydation des oléfines : Ce procédé est utilisé pour préparer l’acroléine.
2. Déshydratation des aldols obtenus par condensation aldolique d’aldéhydes saturés : Cette méthode est employée pour produire le crotonaldéhyde et le 2-éthyl-2-hexénal.
A ces procédés s’ajoutent des synthèses spécifiques permettant de préparer des aldéhydes pour l’industrie de la parfumerie, telles que :
1. Déshydrogénation des alcools insaturés : Ce procédé est utilisé dans la préparation du citral à partir du géraniol.
2. Réduction des acides insaturés : Cette méthode est utilisée pour produire un undécylènealdéhyde à partir d’acide undécylénique.
2.1. Oxydation des oléfines
L’oxydation directe des oléfines, en particulier l’oxydation du propène, est d’une grande importance industrielle pour la production d’acroléine. Cette réaction d’oxydation se produit à des températures allant de 300 à 480°C et utilise des catalyseurs d’oxyde Bi-Mo diversement modifiés. La charge utilisée est un mélange gazeux contenant du propène, de l’air et de la vapeur d’eau dans un rapport molaire d’environ 1:10:2.
Au cours de ce processus, des taux de conversion allant jusqu’à 98 % peuvent être atteints, avec des rendements en acroléine allant de 78 % à 92 %. Cependant, parallèlement à l’acroléine, certains sous-produits se forment, notamment l’acétaldéhyde, l’acide acétique et l’acide acrylique.
L’acroléine disponible dans le commerce a généralement un niveau de pureté de 95 % à 97 %. Pour éviter les réactions indésirables et maintenir la stabilité tout au long des étapes de traitement, un stabilisant est généralement ajouté. L’hydroquinone est couramment utilisée comme stabilisant dans ces procédés.
2.2. Déshydratation des aldols
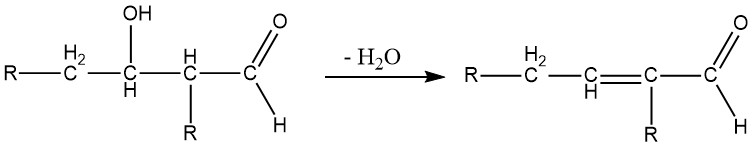
Les β-hydroxyaldéhydes (aldols) sont des composés intermédiaires formés lors de la réaction d’aldolisation et sont très instables. Ils se décomposent facilement en perdant de l’eau pour former des aldéhydes α,β-insaturés.
Selon les conditions de réaction, la réaction d’aldolisation peut conduire directement à la formation de composés insaturés. Ce procédé est couramment utilisé pour synthétiser le crotonaldéhyde à partir de l’acétaldéhyde, le 2-méthyl-2-penténal à partir du propionaldéhyde et le 2-éthyl-2-hexénal à partir du butanal.
La condensation aldolique de l’acétaldéhyde avec des quantités catalytiques d’hydroxyde de sodium dilué est typiquement conduite à 20-25°C. La réaction est désactivée avec de l’acide acétique pour arrêter d’autres réactions. Dans l’étape de distillation ultérieure, l’eau est éliminée de l’acétaldol, ce qui donne du crotonaldéhyde comme produit principal. La sélectivité vis-à-vis du crotonaldéhyde peut atteindre des valeurs allant jusqu’à 95 %.

La réaction d’aldolisation peut impliquer deux molécules d’aldéhyde identiques ou deux espèces d’aldéhydes différentes. Dans ce dernier cas, un mélange de produits est souvent obtenu. Cependant, en sélectionnant soigneusement les réactifs et les conditions de réaction, il est possible d’obtenir le composé souhaité comme produit principal.
Par exemple, l’acroléine était auparavant préparée par la réaction du formaldéhyde avec l’acétaldéhyde.

De même, des 2-méthylènealcanals supérieurs (2-alkylacroléines) peuvent être obtenus en faisant réagir du formaldéhyde avec des aldéhydes à chaîne plus longue.
2.3. Processus divers
Pour la préparation de certains aldéhydes aromatiques insaturés, les alcools correspondants subissent une déshydrogénation sélective à l’aide de catalyseurs à base de cuivre, de cuivre-zinc ou de métaux nobles. Ces procédés sont de préférence conduits sous pression réduite et sont couramment utilisés dans la production de citral, de citronellal et d’hydroxycitronellal.
Une autre méthode industrielle d’intérêt pour la synthèse des aldéhydes insaturés est le réarrangement de Claissen des allyl vinyl éthers. Les éthers allyliques vinyliques sont formés comme intermédiaires dans ce procédé selon le schéma réactionnel suivant :

Les 2-alcénals peuvent également être obtenus en faisant réagir des halogénures d’alkyle insaturés avec les sels de sodium de nitrohydrocarbures secondaires. Par exemple, le citral peut être obtenu avec un rendement de 80 % à partir du 1-halo-3,7-diméthylocta-2,6-diène.
Une approche supplémentaire consiste à traiter les acétals avec des éthers vinyliques en présence de trifluorure de bore. Il en résulte la formation de β-alcoxyacétals correspondants. Un traitement ultérieur avec des acides conduit à la conversion des β-alcoxyacétals en aldéhydes α,β-insaturés.
3. Production d’hydroxyaldéhydes
3.1. Condensation Aldolique
La condensation d’aldol, rapportée pour la première fois en 1872 par A. Wurtz, peut être décrite dans le cas de réactions catalysées par une base par le mécanisme suivant :
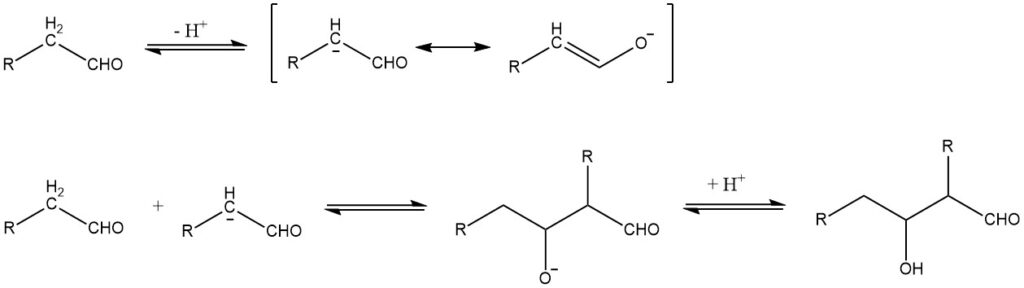
La condensation d’aldol est une réaction réversible et peut être catalysée non seulement par des bases mais aussi par des acides. Cela n’est possible que pour les aldéhydes avec au moins un atome d’hydrogène α. Les aldols obtenus à partir d’aldéhydes contenant plus d’un atome d’hydrogène α sont généralement instables et perdent de l’eau pour former des aldéhydes α, β-insaturés :
Lorsque deux aldéhydes différents avec des atomes d’hydrogène α subissent une addition d’aldol, les quatre espèces d’aldol possibles sont généralement formées en quantités variables.
À des fins industrielles, les réactions dans lesquelles un seul réactif possède des atomes d’hydrogène α sont plus importantes. Dans de tels cas, le deuxième réactif est souvent le formaldéhyde. Les réactions pour préparer des mono- ou polyméthylolalcanals à partir de formaldéhyde et d’alcanals sont courantes dans les procédés industriels.
Ces réactions exothermiques sont généralement conduites en phase liquide et des catalyseurs tels que des solutions aqueuses d’hydroxyde de sodium ou de carbonates alcalins sont fréquemment utilisés.
Divers autres systèmes catalytiques ont également été décrits, y compris des zéolithes contenant du zinc ou du magnésium, des hydroxydes alcalins combinés avec des catalyseurs de transfert de phase, des amines tertiaires et des résines échangeuses d’ions basiques.
Les sous-produits typiques de la condensation d’aldol, outre les aldols dimères, les aldoxanes et les aldéhydes α, β-insaturés mentionnés précédemment, comprennent les acétals cycliques, les esters de Tishchenko, etc. Les réactions avec le formaldéhyde peuvent entraîner des complications supplémentaires, comme une réduction de l’aldol par un une réaction croisée de Cannizzaro peut se produire.
G. Wittig a découvert une version modifiée de la réaction d’aldol classique impliquant le traitement de composés carbonylés avec des imines métallisées. Dans ce cas, des aldéhydes α,β-insaturés sont majoritairement formés, et cette méthode a montré son intérêt, notamment dans le domaine des produits naturels.
3.2. Processus divers
L’addition d’eau aux aldéhydes α,β-insaturés entraîne la formation de β-hydroxyaldéhydes. Cette réaction est d’importance industrielle et est utilisée pour la synthèse du 1,3-propanediol.
Par exemple, le 3-hydroxypropanal peut également être obtenu par l’hydroformylation de l’oxyde d’éthylène, tandis que le 4-hydroxybutanal est obtenu par l’hydroformylation de l’alcool allylique. L’hydroformylation d’alcools insaturés pour produire des hydroxyaldéhydes a fait l’objet d’un examen approfondi.
De plus, lorsque le 2,3-dihydro-1,4-pyranne est hydrolysé, il donne du 5-hydroxypentanal, qui existe en équilibre avec sa forme hémiacétal cyclique. Par exemple, le 2-phényl-2,3-dihydropyrane, produit à partir d’acroléine et de styrène par une synthèse de Diels-Alder, peut être clivé en utilisant de l’acide sulfurique dilué pour produire du 5-phényl-5-hydroxypentanal.
4. Production de dialdéhydes
De nombreuses synthèses de dialdéhydes sont documentées dans la littérature des brevets, mais seul un nombre limité d’entre elles ont une importance commerciale, en grande partie en raison de leur manque de sélectivité. Les principaux procédés utilisés pour la production de dialdéhydes aliphatiques et cycloaliphatiques saturés sont les suivants :
- Oxydation de l’éthylène glycol
- Oxydation de l’acétaldéhyde
- Hydroformylation des diènes
- Ouverture du cycle oxydatif des cycloalcènes
- Addition d’éther méthylvinylique à l’acroléine (résultant en glutardialdéhyde)
4.1. Hydroformylation des diènes
L’hydroformylation des diènes conduit à divers produits, influencés à la fois par la structure du diène et le catalyseur utilisé. Lorsqu’il s’agit de diènes conjugués comme le 1,3-butadiène utilisant des catalyseurs au cobalt ou au rhodium non modifiés, des monoaldéhydes ou des monoalcools saturés sont produits.
Initialement, la seule addition de CO/H2 génère le monoaldéhyde insaturé. Par la suite, l’hydroformylation de l’aldéhyde insaturé entre en compétition avec l’hydrogénation et l’isomérisation de la double liaison.
D’autre part, les diènes non conjugués s’isomérisent généralement en aldéhydes α, β-insaturés thermodynamiquement plus stables après la seule addition de CO / H2. Par conséquent, les diènes non conjugués avec des doubles liaisons largement séparées (> C6), de préférence terminales, sont particulièrement utiles pour la synthèse de dialdéhydes par hydroformylation.
4.2. Ouverture du cycle oxydatif des cycloalcènes
Les cycloalcènes, lorsqu’ils sont exposés à des catalyseurs comme l’acide tungstique, subissent une réaction avec le peroxyde d’hydrogène, conduisant à la formation des époxydes correspondants et aboutissant à des α,ω-dialdéhydes linéaires.

Dans certains cas, l’ajout de composés du bore facilite la réaction.
4.3. Processus divers
Semblable au processus de formation de monoaldéhydes par déshydrogénation, la déshydrogénation des diols entraîne la production de dialdéhydes.
Il existe également d’autres voies, notamment l’ozonisation des cycloalcènes et la dimérisation des aldéhydes insaturés. De plus, l’hydroformylation d’acétals insaturés conduit aux dialdéhydes correspondants.
5. Production d’acétals
La principale méthode employée pour la préparation des acétals est la réaction d’un aldéhyde avec un alcool. Typiquement, un hémiacétal instable est formé en tant que produit intermédiaire en raison de la nature d’équilibre de la réaction.
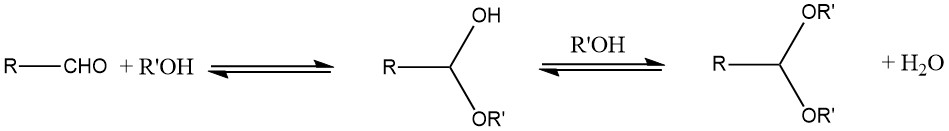
Pour améliorer le rendement, l’eau produite au cours de la réaction doit être éliminée à l’aide d’une distillation azéotropique ou d’agents adsorbant l’eau, comme des tamis moléculaires. En général, les acétals cycliques ont tendance à offrir de meilleurs rendements que les acétals à chaîne ouverte.
L’acide sulfurique anhydre ou l’acide p-toluène sulfonique servent de catalyseurs courants, bien que d’autres options telles que les acides inorganiques, l’acide oxalique ou adipique, les résines échangeuses d’ions ou les tamis moléculaires puissent également être utilisées.
Lors de l’acétalisation d’aldéhydes aliphatiques saturés contenant un atome d’hydrogène α, la formation d’éthers 1-alcényliques peut se produire si la température de réaction est trop élevée.
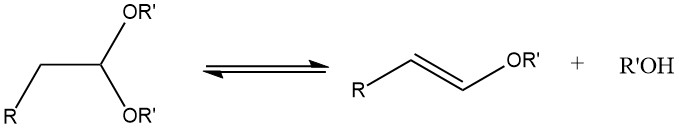
Les acétals peuvent être synthétisés avec de bons rendements à partir de la plupart des aldéhydes en les traitant avec des orthoformiates, principalement les esters méthyliques et éthyliques, en utilisant des acides forts comme catalyseurs, selon le procédé développé par L. Claisen.
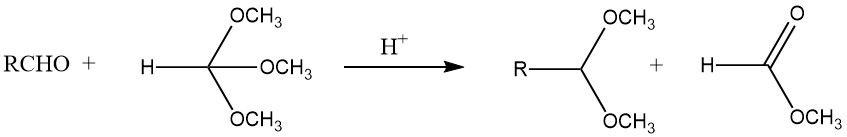
De plus, les acétals peuvent être obtenus par la réaction de l’acétylène avec des alcools, l’addition d’alcool à des éthers vinyliques et le traitement de dihalogénures géminés avec des alcoxydes. Les aldéhydes et les oxiranes donnent des 1,3-dioxolanes, tandis que les pyrocatéchols et le dichlorométhane forment des 1,3-benzodioxoles.
La réaction catalysée par un acide des oléfines avec le formaldéhyde conduit à la formation de 1,3-dioxanes (réaction de Prins), réalisée à 55-75°C avec un excès de formaldéhyde.
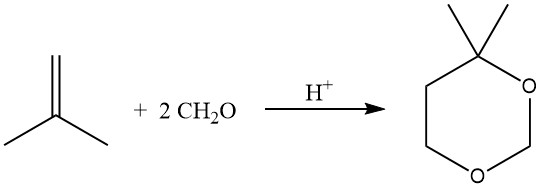
Dans des conditions d’hydroformylation, la réaction des oléfines avec des alcools, souvent à l’aide de catalyseurs de transfert de phase, peut également donner des acétals.
L’acétaldéhyde diméthylacétal est obtenu à 200 ° C à partir de méthanol et de gaz de synthèse en présence de catalyseur, avec une conversion d’environ 60% du méthanol et une sélectivité de 80 à 85%. Les principaux sous-produits comprennent l’acétaldéhyde et l’acétate d’éthyle.
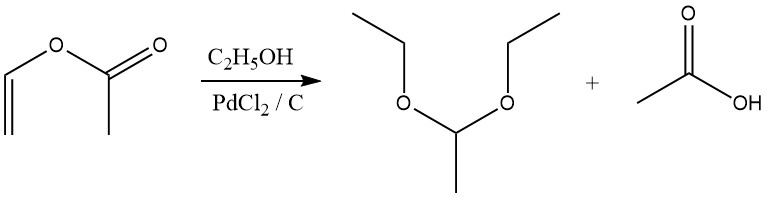
Les acétals sont également formés par réaction d’esters vinyliques avec des alcools en présence d’un catalyseur au chlorure de palladium.
Références
- Aldehydes, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_321.pub3
- Production of aliphatic aldehydes. – https://patents.google.com/patent/US2623905A/en
