Catéchol: production, réactions et utilisations
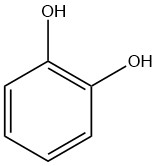
Le catéchol, également connu sous le nom de pyrocatéchol ou 1,2-dihydroxybenzène, est un composé organique de formule moléculaire C6H4(OH)2. C’est une substance cristalline au parfum phénolique distinctif.
Le catéchol est un diol aromatique découvert en 1839 grâce à la distillation sèche de la catéchine par Reinsch. Aujourd’hui, il est synthétisé industriellement à partir du phénol.
Le catéchol a été trouvé, par exemple, dans le sucre de betterave brut, le goudron de bois brut, certaines espèces d’eucalyptus, l’oignon et le charbon.
Le catéchol et nombre de ses dérivés sont obtenus par distillation sèche et d’autres procédés à partir, par exemple, de tanin, de lignine, de bois et de charbon bitumineux.
Il est également présent dans la fumée de tabac et est présent dans l’urine humaine et équine sous la forme de son ester sulfurique.
Table des matières
1. Production de catéchol
Le catéchol était autrefois produit par carbonisation à basse température du charbon, mais ce processus n’est actuellement réalisé que dans de rares cas.
1.1. Hydrolyse du 2-Chlorophénol

Industriellement, le catéchol peut être produit par hydrolyse du 2-chlorophénol avec une solution aqueuse d’hydroxyde de baryum et d’hydroxyde de sodium. Le baryum est récupéré sous forme de carbonate et recyclé dans le procédé en convertissant le carbonate en hydroxyde, ce qui complique le procédé.
Par conséquent, des procédés améliorés dans lesquels seul un alcali caustique est utilisé ont été développés.
Par exemple, 1 mol de 2-chlorophénol est mis à réagir avec 2,3 mol 4 – 8 % de solution d’hydroxyde de sodium en présence d’un sulfate de cuivre(II) ou d’oxyde de cuivre(I) à 190°C pendant 3 h dans un autoclave en cuivre.
La conversion du 2-chlorophénol est de 96 à 99 %, la sélectivité pour le catéchol est de 81 à 86 %.
Le mélange réactionnel est ensuite neutralisé par de l’acide sulfurique et le catéchol brut formé est extrait, le solvant est récupéré, le catéchol est séparé et purifié par distillation.
La production industrielle de catéchol a été réalisée par cette méthode jusqu’en 1973.
1.2. Hydroxylation du Phénol
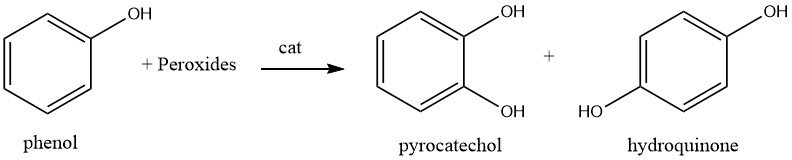
Le catéchol est actuellement fabriqué avec l’hydroquinone par hydroxylation directe du phénol avec des peroxydes.
A l’heure actuelle, trois usines utilisant ce procédé sont en fonctionnement dans le monde ; chaque plante utilise un type de peroxyde ou de catalyseur quelque peu différent.
Comme la réaction est exothermique et que les benzènediols formés s’oxydent plus facilement que le phénol, la réaction s’effectue dans un large excès de phénol.
En France, Rhône-Poulenc fait réagir du phénol avec du peroxyde d’hydrogène à 70 % (rapport molaire 20 : 1) en présence d’acide phosphorique et de quantités catalytiques d’acide perchlorique à 90°C ; le catéchol et l’hydroquinone sont obtenus dans un rapport d’env. 3 : 2.
Cette réaction se déroule de manière électrophile et l’acide phosphorique sert de réactif masquant empêchant les réactions secondaires (formation de résorcinol par une réaction radicalaire qui donne un rendement inférieur) provoquées par des traces d’ions métalliques.
Après la réaction, les acides phosphorique et perchlorique sont éliminés par lavage à l’eau, puis le mélange réactionnel est simultanément extrait par de l’éther diisopropylique, distillé et séparé en continu.
Brichima SpA (aujourd’hui Enichem) en Italie utilise des composés de métaux lourds (par exemple, de petites quantités de sels de ferrocène et/ou de cobalt) comme catalyseur et fait réagir le phénol avec du peroxyde d’hydrogène aqueux à 60 % à 40 °C.
Le catéchol et l’hydroquinone sont produits dans un rapport de 1,5 à 4,1. Cette réaction se produit via un mécanisme de chaîne radicalaire et est donc très rapide.
Au Japon, Ube Industries produit du catéchol avec de l’hydroquinone par hydroxylation du phénol avec des peroxydes de cétone (peroxyde de méthyléthylcétone) formés in situ à partir d’une cétone et de peroxyde d’hydrogène en présence d’un catalyseur acide.
Le processus est effectuée en ajoutant une trace d’acide (par exemple, de l’acide sulfurique ou sulfonique), un petit volume de cétone et du peroxyde d’hydrogène aqueux à 60 % au phénol à 70 °C.
Le peroxyde de cétone qui se forme in situ réagit rapidement et de manière électrophile avec le phénol, et le catéchol et l’hydroquinone sont obtenus dans un rapport molaire d’environ 3 : 2 avec un rendement de plus de 90 % (basé sur le phénol ayant réagi).
Lorsqu’un acide solide tel que l’argile est utilisé comme catalyseur, le rapport molaire du catéchol et de l’hydroquinone est d’environ 1 : 1. Comme seule une petite quantité de catalyseur est utilisée, aucune corrosion ne se produit et le mélange réactionnel peut être distillé sans retirer le catalyseur.
Après la réaction. La cétone ajoutée peut être recyclée au procédé en la récupérant par distillation.
Les méthodes de séparation et de purification utilisées dans les trois procédés susmentionnés sont fondamentalement les mêmes. C’est-à-dire que le mélange réactionnel est séparé par distillation dans différentes colonnes de distillation.
L’eau est éliminée, les fractions à bas point d’ébullition (solvants, cétone, etc.) et le phénol n’ayant pas réagi sont récupérés et recyclés, la fraction catéchol est transformée en un produit en flocons et l’hydroquinone est purifiée par recristallisation de la fraction correspondante dans l’eau.
1.3. Déshydrogénation du 1,2-cyclohexanediol

Le catéchol peut être obtenu avec un rendement de 90 % par déshydrogénation du 1,2-cyclohexanediol avec un système catalyseur Pd/Te à 300 °C. Le catéchol serait formé comme produit unique.
De plus, le catéchol peut être obtenu par les voies de synthèse suivantes :
- fusion alcaline d’acide 2-phénolsulfonique et d’acide phénol-2,4-disulfonique
- oxydation du salicylaldéhyde avec du peroxyde d’hydrogène dans une solution alcaline aqueuse
- déméthylation du gaïacol avec de l’acide bromhydrique ou du chlorure d’aluminium
- hydrolyse du 2-aminophénol à l’aide d’un halogénure d’hydrogène.
2. Réactions chimiques du catéchol
Le catéchol donne une coloration verte avec le chlorure de fer-(III) et vire au rouge lors de l’ajout d’une petite quantité d’hydroxyde de sodium ou d’ammoniac. Ces colorations sont spécifiques du catéchol et peuvent être utilisées pour sa détection et son identification.
Le catéchol peut former des composés de coordination stables avec presque tous les métaux et est donc utilisé comme réactif analytique pour les métaux.
Le catéchol est un acide faible et forme des mono- et des disels avec des hydroxydes ou des carbonates alcalins.
De nombreux sels de métaux lourds du catéchol, en particulier ses sels de plomb, sont pratiquement insolubles dans l’eau. Ainsi, la réaction du catéchol avec l’acétate de plomb est utilisée pour l’analyse quantitative et la séparation du catéchol de ses isomères hydroquinone et résorcinol.
Le catéchol est l’agent réducteur le plus puissant des trois isomères du benzènediol et peut réagir avec une solution de sels de métaux lourds pour former de fins précipités des métaux élémentaires.
La 1,2-benzoquinone est formée par une oxydation soigneuse du catéchol avec de l’oxyde d’argent ou du carbonate d’argent sur de la célite.
L’ester monométhylique d’acide cis,cis-muconique peut être obtenu par clivage oxydatif du catéchol avec de l’oxygène en présence de chlorure de cuivre (I) et de méthanol.
Le catéchol subit de nombreuses réactions typiques du phénol. Il réagit avec les halogénures d’acyle pour former les mono- et diesters correspondants, qui sont convertis en cétones phénoliques par réarrangement de Fries avec du chlorure d’aluminium comme catalyseur.
Un groupe aldéhyde peut être introduit dans le noyau aromatique par réaction de Reimer-Tiemann avec du chloroforme et un alcali, ou par addition d’acide glyoxylique et décarboxylation oxydative ultérieure.
Les mono- et diéthers de catéchol peuvent être préparés par les méthodes habituelles. Le catéchol peut subir des réactions de cyclisation en raison de ses deux groupes hydroxyle adjacents. Il réagit avec le dichlorométhane pour former du méthylènedioxybenzène et avec le bis(2-chloroéthyl)éther pour donner du dibenzo-18-couronne-6-polyéther.
L’ammonolyse du catéchol donne le 2-aminophénol. Le catéchol se couple avec des sels d’aryldiazonium pour former des composés azoïques, qui peuvent être réduits en 4-aminocatéchol.
Le catéchol forme du bis (dihydroxyphényl) méthane par réaction de condensation avec du formaldéhyde et des composés polycycliques (par exemple, l’ hystazarine et l’ alizarine ) par condensation avec de l’anhydride phtalique.
Les mono-substitutions du cycle se produisent aux positions 3 et 4. Le catéchol peut ainsi être alkylé, halogéné, nitré, carboxylé et sulfoné.
3. Utillisations du catéchol
Le catéchol lui-même est utilisé comme révélateur photographique, réactif analytique et désoxygénant (antioxydant); la plupart du catéchol est utilisé sous la forme de ses dérivés : le gaïacol (2-méthoxyphénol) et le vératrol (1,2 diméthoxybenzène) peuvent être synthétisés par O-méthylation du catéchol.
La vanilline (4-hydroxy-3-méthoxybenzaldéhyde), dérivée du gaïacol, est utilisée comme agent aromatisant. L’éthylvanilline (3-éth-oxy-4-hydroxybenzaldéhyde) dérivée du guethol (2-éthoxyphénol, un homologue du gaïacol) ne se trouve pas dans la nature, et sa saveur est 3 à 4 fois plus forte que celle de la vanilline. C’est donc un composé aromatique précieux.
L’eugénol (2-méthoxy-4-allylphénol), le safrole (5-allyl-1,3-benzodioxole) et le pipéronal [3,4-(méthylènedioxy)benzaldéhyde], qui peuvent être préparés à partir de ce dernier, sont des parfums utiles en parfumerie .
En médecine, le sulfonate de gaïacol de potassium (sel monopotassique de l’acide 4-hydroxy-3-méthoxy-benzènesulfonique) et l’éther glycérylique de gaïacol [3-(2-méthoxyphénoxy)-1,2-propanediol] sont utilisés comme expectorants.
La L-a-méthyldopa (3-hydroxy-a-méthyl-L-tyrosine) et la L-dopa (3-hydroxy-L-tyrosine) dérivées de la vanilline sont utilisées respectivement comme antihypertenseur et antiparkinsonien.
De plus, le triméthoprime dérivé de la vanilline est utilisé comme anti-infectieux ; le carbazochrome et le carbazochrome sulfonate de sodium sont utilisés comme hémostatiques; la papavérine est utilisée comme antispasmodique, vasodilatateur et relaxant des muscles lisses.
Deux insecticides carbamates importants produits à partir de catéchol sont utilisés comme produits chimiques agricoles – le carbofuran (2,3-dihydro-2,2-diméthyl-7-benzofuranyl méthylcarbamate, nom commercial Furadan) et le propoxur (2-isopropoxyphényl-N-méthylcarbamate, nom commercial Baygon) développé par Bayer.
Le 4-tert-butylcatéchol, qui est préparé par alkylation cyclique du catéchol, est appliqué comme inhibiteur de polymérisation lors de la fabrication et du stockage de monomères tels que le styrène et le butadiène.
Référence
- Phenol Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_313
