Anhydride maléique : propriétés, réactions, production et utilisations
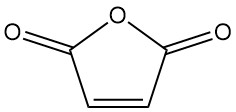
Qu’est-ce que l’anhydride maléique ?
L’anhydride maléique, également connu sous le nom de 2,5-furandione, est un composé organique de formule C4H2O3. Il s’agit d’un solide incolore ou blanc avec une odeur forte et irritante qui est industriellement plus importante que l’acide maléique.
Table des matières
1. Propriétés physiques de l’anhydride maléique
L’anhydride maléique forme des cristaux en aiguilles orthorhombiques. Il est soluble dans l’eau, l’acétone, l’éthanol, le xylène, l’acétate d’éthyle, le chloroforme, le benzène, le toluène, le tétrachlorométhane et de nombreux autres solvants organiques.
L’anhydride maléique est hygroscopique et inflammable et peut former des mélanges explosifs avec l’air. Il peut se sublimer. Le pH des solutions aqueuses d’anhydride maléique est de 2,42 à 1×10-2 M, de 2,62 à 5×10-3 M et de 3,10 à 1×10-4 M.
Les propriétés physiques les plus importantes de l’anhydride maléique sont résumées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | 108-31-6 |
| Formule chimique | C4H2O3 |
| Masse moléculaire | 98,06 g/mol |
| Point de fusion | 52,85 °C |
| Point d'ébullition (101,3 kPa) | 202,0 °C |
| Densité | 1,48 g/cm3 |
| Densité de vapeur | 3,40 |
| Chaleur de combustion | -1391,2 kJ/mol |
| Chaleur spécifique (liquide) | -1,67 kJ mol-1 K-1 |
| Chaleur d'évaporation | 54,8 kJ/mol |
| Chaleur de fusion | 13,66 kJ/mol |
| Point d'éclair | 102 °C (coupe fermée) 110 °C (coupe ouverte) |
| Température d'auto-inflammation | 477 °C |
2. Réactions de l’anhydride maléique
L’anhydride maléique présente une réactivité élevée en raison de la présence d’une double liaison et de son groupe anhydride.
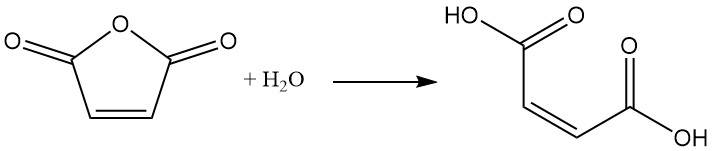
L’anhydride maléique subit facilement une hydrolyse avec l’eau pour former de l’acide maléique. Cette réaction est exothermique.
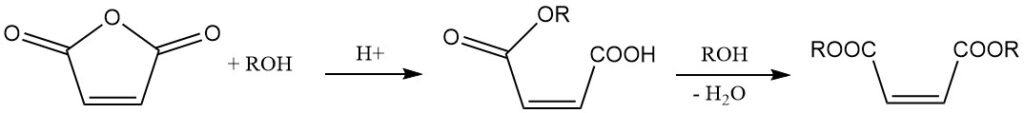
La réaction avec des alcools en présence d’un catalyseur conduit à la formation d’esters d’acide maléique. Le choix du catalyseur et la température de réaction déterminent le produit. À des températures plus basses, des semi-esters se forment, tandis que des températures plus élevées favorisent la formation de diesters avec élimination d’eau.
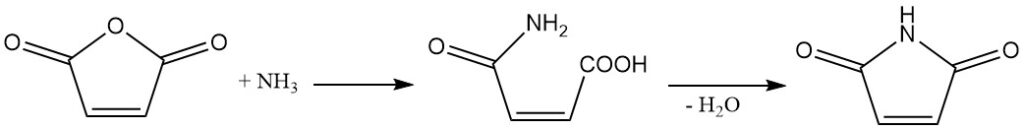
L’anhydride maléique réagit avec l’ammoniac ou les amines pour produire les semiamides correspondants. Une déshydratation supplémentaire conduit à la formation d’imides cycliques.
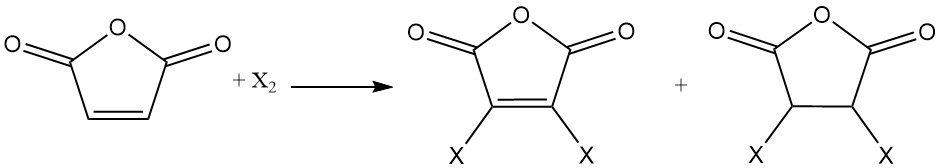
La double liaison de l’anhydride maléique subit des réactions d’addition avec les halogènes. Selon les conditions de réaction, des anhydrides maléiques mono- ou dihalogénés ou des anhydrides succiniques dihalogénés peuvent se former.
L’hydrogénation de l’anhydride maléique produit divers produits, selon les conditions de réaction. Ces produits comprennent l’anhydride succinique, le 1,4-butanediol, le tétrahydrofurane ou la butyrolactone.

L’ajout d’oléfines conduit à la formation d’anhydrides alcénylsucciniques.
L’anhydride maléique participe aux réactions de Diels-Alder avec les diènes conjugués.
L’anhydride maléique peut subir des réactions d’homopolymérisation et de copolymérisation.
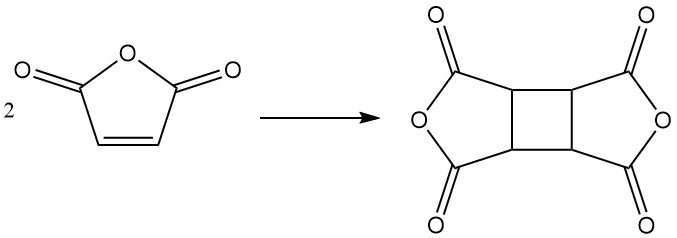
Dans des conditions spécifiques, l’anhydride maléique peut se dimériser pour former du dianhydride cyclobutane tétracarboxylique (CBTA), qui est utilisé dans la production de polyimides.
3. Production d’anhydride maléique
L’anhydride maléique est produit par oxydation catalytique d’hydrocarbures appropriés en phase gazeuse. Traditionnellement, le benzène était la principale matière première. Cependant, les hydrocarbures C4 (comme le butane) sont devenus de plus en plus importants ces dernières années.
3.1. Production d’anhydride maléique par oxydation du benzène
Pour produire de l’anhydride maléique (figure 1), le benzoène est préchauffé et mélangé à un flux d’air pour former un mélange homogène. Des réacteurs tubulaires avec des tubes verticaux remplis d’un catalyseur tel que des oxydes de vanadium et de molybdène sur un support inerte sont utilisés.
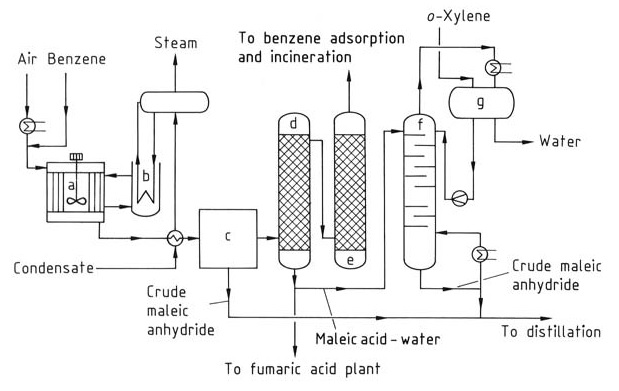
a) Réacteur ; b) Refroidisseur à bain de sel ; c) Condenseur partiel ; d) Épurateur d'acide ; e) Épurateur d'alcali ; f) Colonne de déshydratation ; g) Séparateur de phases
La réaction est exothermique, nécessitant un contrôle de la température de fonctionnement et une pression comprise entre 0,15 et 0,25 MPa pour optimiser le rendement en anhydride maléique et minimiser la combustion en CO2 et CO. La chaleur générée pendant la réaction (environ 27 MJ par tonne de benzène) est éliminée à l’aide de sels fondus en circulation, qui sont ensuite refroidis à l’eau.
La réaction suivante représente la production d’anhydride maléique :
C6H6 + 4,5 O2 → C4H2O3 + 2 CO2 + 2 H2O (ΔH = -1875 kJ/mol)
Cependant, une combustion indésirable se produit également. Le benzène n’ayant pas réagi peut être récupéré à l’aide de techniques telles que l’adsorption et réutilisé dans le processus. Bien que des brevets existent pour des procédés qui recyclent une plus grande partie du gaz de réaction après la séparation de l’anhydride maléique, ceux-ci n’ont pas encore été largement adoptés commercialement.
Séparation de l’anhydride maléique brut
L’effluent du réacteur est d’abord refroidi pour éviter la condensation de l’anhydride maléique et de l’eau. Deux méthodes peuvent ensuite être utilisées pour un traitement ultérieur :
- Condensation partielle : le mélange gazeux est refroidi à environ 55 °C, ce qui permet à l’anhydride maléique de se condenser et d’être séparé sous forme liquide. Cependant, un contact prolongé avec le gaz contenant de l’eau peut entraîner la formation d’acide maléique. Cette approche permet généralement de récupérer 40 à 60 % de l’anhydride maléique.
- Épuration à l’eau : cette méthode capture tout l’anhydride maléique dans le gaz de réaction sous forme de solution d’acide maléique. Cependant, l’étape de déshydratation ultérieure pour récupérer l’anhydride maléique est gourmande en énergie et n’est préférée que pour les gaz de réaction à forte teneur en eau (comme ceux issus de l’oxydation C4).
3.2. Production d’anhydride maléique par déshydratation de solutions aqueuses d’acide maléique
L’anhydride maléique peut être dérivé des solutions d’acide maléique obtenues en épurant le gaz de réaction avec de l’eau.
À des températures supérieures à 150 °C, même des traces d’alcali dans la solution de lavage peuvent provoquer la décarboxylation de l’anhydride maléique. Par conséquent, une eau de lavage exempte d’alcali est nécessaire.
La déshydratation de l’acide maléique nécessite des températures supérieures à 100 °C (ΔH = +34,88 kJ/mol). Cependant, pour obtenir une vitesse de réaction pertinente au niveau industriel, il faut des températures supérieures à 130 °C. Ce système à température plus élevée favorise également l’isomérisation indésirable de l’acide maléique en acide fumarique.
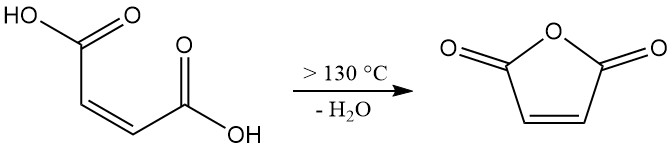
Bien que l’acide fumarique lui-même ne se décompose pas de manière significative pour former de l’anhydride maléique en dessous de 230 °C, sa présence réduit le rendement global du produit souhaité. Pour minimiser l’isomérisation, un court temps de séjour à des températures élevées est essentiel pendant le processus de déshydratation.
Deux procédés principaux sont utilisés pour déshydrater les solutions aqueuses d’acide maléique : la méthode de l’agent d’entraînement et le procédé thermique sans agent d’entraînement.
3.2.1. Méthode de l’agent d’entraînement
Dans ce procédé, la solution aqueuse d’acide maléique est introduite dans la section supérieure d’une colonne de distillation, où elle se mélange à un mélange bouillant d’anhydride maléique et d’un agent d’entraînement tel que le xylène.
L’agent d’entraînement (xylène) forme un mélange azéotropique avec l’eau, ce qui permet aux deux d’être éliminés de la tête de colonne sous forme de flux de vapeur. Ce flux de vapeur est ensuite séparé dans un décanteur en phases organique et aqueuse.
La phase organique contenant le xylène est recyclée vers la partie supérieure de la colonne de distillation, tandis que la phase aqueuse est renvoyée vers l’épurateur de gaz de réaction de l’usine d’oxydation.
Le flux de produit de fond de la colonne de distillation, contenant de l’anhydride maléique (10 à 40 %), du xylène (1 à 5 %), de l’acide maléique (1 à 3 %) et de l’acide fumarique (1 à 3 %), subit une distillation supplémentaire pour isoler l’anhydride maléique pur. Ce procédé peut être utilisé en continu ou par lots.
3.2.2. Procédé thermique sans agent d’entraînement
Cette méthode utilise la technologie d’évaporation en couche mince pour réaliser la déshydratation thermique de la solution aqueuse d’acide maléique. La technique permet une élimination efficace de l’eau sous forme de vapeur tout en minimisant le temps de séjour de l’acide maléique à haute température (150 à 200 °C). Ce temps d’exposition court permet de supprimer l’isomérisation en acide fumarique (seulement 1 à 3 %).
Plusieurs unités d’évaporateurs à couche mince sont souvent disposées en série. L’anhydride maléique liquide obtenu à partir du condenseur partiel peut également être introduit dans la deuxième étape de ce système pour déshydrater l’acide maléique restant (1 à 5 %).
Ce procédé continu produit de l’anhydride maléique de haute pureté (99 %) après une étape de distillation finale. Le produit de fond du dernier évaporateur contient de l’acide fumarique et des résidus à point d’ébullition élevé, qui sont éliminés.
Ces installations fonctionnant en continu nécessitent des arrêts périodiques pour le nettoyage.
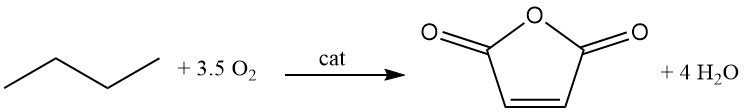
3.3. Production d’anhydride maléique par oxydation d’hydrocarbures C4
Ces dernières années, l’oxydation d’hydrocarbures C4, principalement à l’aide de n-butane ou de mélanges n-butane-n-butène riches en paraffines, est apparue comme une alternative importante à l’oxydation traditionnelle du benzène pour la production d’anhydride maléique.
Différents types de procédés ont été développés, tels que les procédés à lit fixe, à lit fluidisé et à lit de transport.
3.3.1. Procédé à lit fixe
Le procédé à lit fixe est une méthode commercialement établie qui utilise des catalyseurs à base d’oxyde de vanadium-phosphore (V-P-O) conditionnés dans des réacteurs tubulaires, de manière similaire à l’oxydation du benzène. La réaction est hautement exothermique.
C4H10 + 3,5 O2 → C4H2O3 + 4 H2O (ΔH = -1260 kJ/mol)
Cependant, par rapport à l’oxydation du benzène, on observe des taux de conversion inférieurs de 80 % et des sélectivités (70 %). La récupération des hydrocarbures C4 n’ayant pas réagi est plus difficile qu’avec le benzène.
3.3.2. Procédé à lit fluidisé
Le procédé à lit fluidisé offre un contrôle de température plus uniforme dans le réacteur, minimisant les « points chauds » et améliorant potentiellement la sélectivité de la réaction. Cependant, le procédé de fluidisation implique également un remixage intensif du produit, ce qui peut contrecarrer cet avantage.
Un autre défi est la contrainte mécanique exercée sur le catalyseur V-P-O en raison de l’abrasion et de l’érosion. Malgré ces inconvénients, les lits fluidisés peuvent fonctionner à des concentrations de C4 plus élevées (dans la plage d’explosion) en raison de leur efficacité en tant que barrières anti-flammes.
Le procédé ALMA (Alusuisse, Lummus) est un exemple de réacteur à lit fluidisé couplé à une unité de traitement non aqueuse.
3.3.3. Procédé à lit de transport
Ce procédé a été développé par Monsanto et DuPont et utilise deux réacteurs. Le catalyseur V-P-O consommé dans l’oxydation C4 est régénéré avec de l’oxygène dans le premier réacteur. Le catalyseur régénéré réagit ensuite avec le n-butane dans le deuxième réacteur dans des conditions proches de la stœchiométrie avec un minimum d’oxygène atmosphérique.
Ce procédé permet d’obtenir une sélectivité élevée de formation d’anhydride maléique (75 mol%) tout en minimisant le remixage du gaz produit, mais il est encore en cours de développement.
En raison de la formation d’eau accrue par rapport à l’oxydation du benzène, la liquéfaction directe de l’anhydride maléique à partir du gaz de réaction C4 par condensation partielle est limitée. Une plus grande partie (65-70%) doit être récupérée sous forme d’acide maléique par épuration à l’eau, suivie d’une déshydratation.
Une autre méthode de purification utilise l’absorption par solvant organique de l’anhydride maléique du gaz de réaction, ce qui permet une séparation sans formation significative d’acide maléique. Le mélange solvant-anhydride maléique subit ensuite une distillation fractionnée pour isoler l’anhydride maléique pur.
3.4. Purification de l’anhydride maléique brut
Il existe deux méthodes principales pour purifier l’anhydride maléique brut : la distillation par lots et la distillation continue.
3.4.1. Distillation discontinue
La distillation discontinue est utilisée pour traiter l’anhydride maléique directement séparé ou les mélanges obtenus par déshydratation de l’agent d’entraînement. L’anhydride maléique brut est chargé dans une colonne de distillation discontinue et initialement chauffé dans des conditions de reflux total. Cela permet d’obtenir une déshydratation complète de tout acide maléique restant.
La petite quantité d’eau éliminée pendant la déshydratation se condense et est séparée de l’agent d’entraînement en recirculation (généralement du xylène). Le xylène est ensuite éliminé par distillation. Enfin, l’anhydride maléique purifié est récupéré par distillation sous vide.
Des alambics discontinus d’une capacité allant de 50 à 150 mètres cubes et des colonnes de distillation de 10 à 20 plateaux sont couramment utilisés pour ce procédé.
3.4.2. Distillation continue
La distillation continue est plus économique pour les installations de production d’anhydride maléique à grande échelle.
Dans ce procédé (Figure 2), un flux continu du mélange d’anhydride maléique brut est introduit dans le système de distillation. Le xylène résiduel est d’abord éliminé dans une colonne dédiée (f). Enfin, l’anhydride maléique pur est isolé du haut d’une deuxième colonne (g) par distillation.
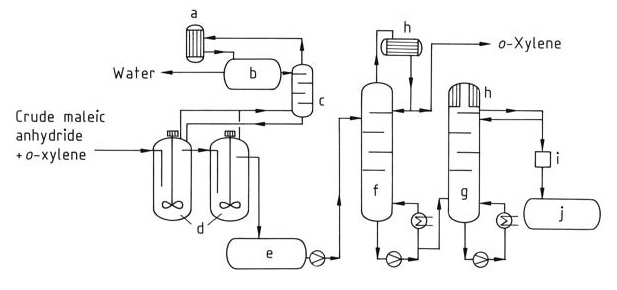
a) Condenseur ; b) Cuve de séparation ; c) Colonne ; d) Post-déshydratation ; e) Cuve intermédiaire ; f) Colonne d'o-xylène ; g) Colonne d'anhydride maléique pur ; h) Refroidisseur ; i) Colorimètre ; j) Cuve d'anhydride maléique pur
4. Utilisations de l’anhydride maléique
Les propriétés uniques de l’anhydride maléique en tant qu’anhydride dicarboxylique avec une double liaison en font un élément de base polyvalent pour diverses applications industrielles.
L’anhydride maléique est principalement utilisé pour la production de polyesters et de résines alkydes, qui sont utilisés dans la production de plastiques renforcés de fibres de verre pour la construction, les applications électriques, les pipelines et la construction marine. Il est également utilisé dans la formulation de lubrifiants et de plastifiants.
L’anhydride maléique participe facilement aux réactions de copolymérisation. Parmi les exemples importants sur le plan industriel, citons les copolymères anhydride maléique-styrène utilisés pour les plastiques techniques et les copolymères anhydride maléique-acide acrylique utilisés dans l’industrie des détergents.
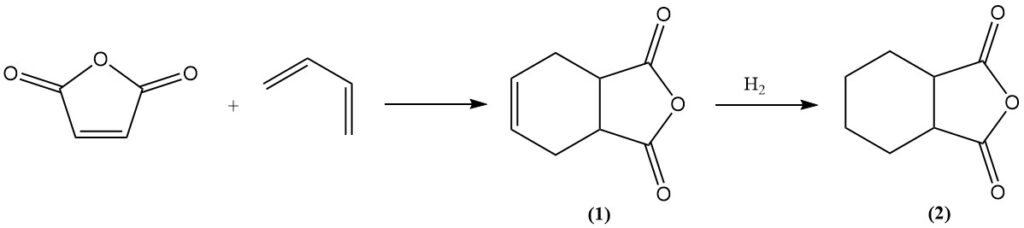
L’anhydride maléique subit des réactions de Diels-Alder avec des diènes comme le butadiène pour former de l’anhydride tétrahydrophtalique (1). Une hydrogénation supplémentaire donne de l’anhydride hexahydrophtalique (2), qui est un agent de durcissement précieux pour les résines époxy. Un procédé similaire utilisant de l’isoprène donne de l’anhydride méthylhexahydrophtalique pour la même application.
De plus petites quantités d’anhydride maléique sont utilisées dans la production de pesticides comme le captane et le malathion, ainsi que d’inhibiteurs de croissance comme l’hydrazide d’acide maléique.
Les esters d’acide maléique peuvent être transformés en tensioactifs par des réactions avec de l’hydrogénosulfite de sodium.
L’anhydride maléique peut être utilisé comme accélérateur de séchage lorsqu’il est ajouté aux huiles siccatives, améliorant ainsi la qualité des laques.
5. Toxicologie de l’anhydride maléique
L’anhydride maléique peut s’hydrolyser en acide maléique dans l’eau, ses propriétés toxicologiques sont donc influencées par la présence d’acide maléique.
L’anhydride maléique présente une toxicité aiguë modérée basée sur les valeurs DL50 (481 mg (rat, voie orale), 465 mg (souris, voie orale), 2620 mg (lapin, voie percutanée) et 390 mg (cobaye, voie orale) par kilogramme de poids corporel).
Le principal effet toxique aigu est son effet irritant et corrosif local sur la peau, les muqueuses et les yeux. L’exposition peut provoquer une irritation à des concentrations aussi faibles que 1,5–2 ppm, avec une irritation grave au-dessus de 2,5 ppm.
L’inhalation d’anhydride maléique à des concentrations supérieures à 1,2 ppm pendant des périodes prolongées peut déclencher des symptômes asthmatiques.
L’anhydride maléique est un sensibilisant puissant, ce qui signifie qu’une exposition répétée peut entraîner des réactions allergiques chez les humains et les animaux.
Les études sur les animaux n’ont pas montré de preuve de cancérogénicité, de tératogénicité (anomalies congénitales) ou de toxicité pour la reproduction suite à une exposition à l’anhydride maléique. Cependant, aucun effet systémique n’a été observé jusqu’à un niveau d’exposition de 2,4 ppm, de sorte que les effets à des concentrations plus élevées ne sont pas totalement exclus.
Les limites d’exposition professionnelle ont été établies sur la base des propriétés irritantes et sensibilisantes :
- MAK (Commission allemande pour l’enquête sur les risques pour la santé des matériaux de travail) : 0,2 ppm
- TLV-TWA (American Conference of Governmental Industrial Hygienists Threshold Limit Value—Time-Weighted Average) : 0,25 ppm
Références
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Anhydride
- Method for producing cyclobutane tetracarboxylic acid derivative. – https://patents.google.com/patent/WO2015108168A1/en
