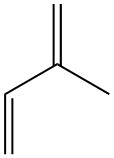
L’isoprène, également connu sous le nom de 2-méthyl-1,3-butadiène, est un hydrocarbure à cinq carbones qui existe dans la nature à l’état de traces. C’est un liquide incolore et volatil de formule chimique C5H8.
L’isoprène est utilisé comme élément de base de nombreux produits naturels. Ceux-ci comprennent les terpènes (caoutchouc naturel, camphre), la vitamine A et les hormones sexuelles stéroïdes (adhérant à la « règle de l’isoprène » de Wallach et Ruzicka). Il a été synthétisé pour la première fois par pyrolyse du caoutchouc naturel en 1860 par Williams.
Table des matières
1. Propriétés physiques de l’isoprène
Dans des conditions normales, l’isoprène est un liquide incolore et volatil, insoluble dans l’eau à 20 °C. Il est miscible avec les solvants organiques tels que l’éthanol, l’éther diéthylique, l’acétone et le benzène.
L’isoprène forme des mélanges azéotropiques binaires avec divers composés tels que le méthanol, le n-pentane, le disulfure de carbone, le formiate de méthyle, le bromoéthane, l’éthanol, le sulfure de diméthyle, l’acétone, l’oxyde de propylène, le formiate d’éthyle, le nitrite d’isopropyle, le méthylal, l’éther diéthylique, la perfluorotriéthylamine, l’acétonitrile et isopropylamine.
Les propriétés physiques importantes de l’isoprène sont détaillées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Poids moléculaire | 68,118 g/mol |
| Point de fusion (101,3 kPa) | -145,95 °C |
| Point d'ébullition (101,3 kPa) | 34,059 °C |
| Température critique | 483,3 Ko |
| Pression critique | 3,74 MPa |
| Volume critique | 266 cm3/mol |
| Densité (293 Ko) | 0,68095 g/cm3 |
| Viscosité (293 K) | 0,216 mPa.s |
| Tension superficielle (293 K) | 18,22 mN/m |
| Indice de réfraction | 1.42194 |
| Pression de vapeur | |
| -20 °C | 9,8 kPa |
| 0 °C | 26,4 kPa |
| 20 °C | 60,7 kPa |
| 34,059 °C | 101,3 kPa |
| 40 °C | 123,8 kPa |
| 60 °C | 229,1 kPa |
| 80 °C | 392,1 kPa |
| 100 °C | 629,5 kPa |
| Chaleur spécifique | |
| Vapeur (298 K) | 102,69 J mol-1 K-1 |
| Liquide (298 Ko) | 151,07 J mol-1 K-1 |
| Limites d'explosivité dans l'air (pression totale 13 kPa, 25 °C) | |
| Limite supérieure | 7 à 9,7 % en volume (200 à 275 g/m3) |
| Limite inférieure | 1 à 1,5 % en volume (28 à 40 g/m3) |
| Pression d'explosion maximale | 0,66 MPa |
2. Propriétés chimiques de l’isoprène
L’analyse spectroscopique indique qu’à 50 °C, la majorité des molécules d’isoprène existent dans la conformation s-trans. Seulement 15 % adoptent la forme s-cis à plus haute énergie.
En tant que diène conjugué, l’isoprène présente un comportement caractéristique. La présence d’un groupe méthyle améliore sa réactivité avec les électrophiles et les diénophiles Diels-Alder par rapport au butadiène.
L’isoprène est plus réactif que le butadiène en raison de ses quatre atomes d’hydrogène uniques, contre deux pour le butadiène. L’isoprène participe à un large éventail de réactions, notamment la substitution, l’addition, la formation de cycles, la complexation et la télomérisation.
La réaction avec les radicaux hydroxyles est la voie dominante de dégradation de l’isoprène dans l’atmosphère. Les radicaux hydroxyles, molécules hautement réactives, déclenchent une réaction en chaîne complexe qui décompose l’isoprène en divers produits. Il peut également être décomposé par l’ozone.
À des températures élevées et dans des conditions spécifiques, l’isoprène forme des peroxydes et des radicaux libres, conduisant finalement à sa décomposition en différents produits comme le diméthoxyméthane et le naphtalène.
L’isoprène peut subir des réactions d’addition similaires aux alcènes mais n’est pas sélectif et donne lieu à un mélange de produits.
La seule réaction chimique importante de l’isoprène est sa conversion en terpènes. L’isoprène est principalement utilisé dans la synthèse des polymères.
3. Production d’isoprène
3.1. Production d’isoprène à partir d’oléfines
L’isoprène est principalement produit par la réaction de Prins catalysée par un acide du formaldéhyde avec l’isobutène, produisant du 4,4-diméthyl-1,3-dioxane, qui est ensuite clivé en phase gazeuse (à 200 – 300 °C) pour produire de l’isoprène et récupérer. la moitié du formaldéhyde.
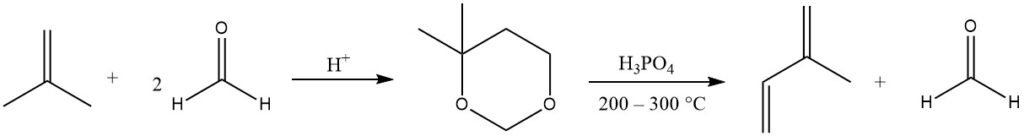
Plusieurs entreprises ont affiné ce processus grâce aux matières premières facilement disponibles. Des installations de production actuelles de ce type existent au Japon.
Les efforts se sont concentrés sur la simplification et l’amélioration de la rentabilité de la synthèse de l’isoprène à partir de l’isobutène et du formaldéhyde. Takeda Chemical au Japon a proposé un procédé en phase gazeuse en une seule étape utilisant des catalyseurs à base d’oxydes.
Les sous-produits du formaldéhyde posent un défi. Des entreprises comme Idemitsu et Sun Oil utilisent des dérivés de formaldéhyde (méthylal, diméthoxyméthane) pour éviter la formation de résine. Des méthodes alternatives consistent à intégrer la production de formaldéhyde directement dans le processus en utilisant du méthanol et de l’oxygène ou de l’éther méthyltert-butylique (MTBE) et de l’oxygène.
Les brevets japonais exploraient l’alcool tert-butylique comme source de C4, tandis que d’anciennes publications soviétiques décrivaient des méthodes basées sur le clivage du 1,3-dioxane.
Le procédé en phase gazeuse en une seule étape est limité par le faible rendement spatio-temporel du catalyseur et sa désactivation rapide. On ne sait pas si l’une de ces variantes a atteint une production commerciale.
Le 2-méthylbutanal est une autre matière première pour la production d’isoprène. Il est produit par hydroformylation du 2-butène à l’aide d’un catalyseur au rhodium.
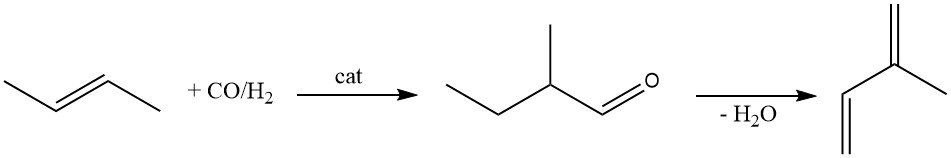
La déshydratation catalytique du 2-méthylbutanal en isoprène a été largement étudiée. Si de nombreux catalyseurs ont été proposés (β-phosphate, phosphate de magnésium et d’ammonium, tamis moléculaires et zéolites), ils souffrent tous d’une perte rapide d’activité.
Cependant, les zéolites modifiées avec du silane ou du césium présentent des durées de vie améliorées. Le clivage du 3-méthylbutanal a donné des résultats moins bons. Actuellement, aucune installation industrielle n’utilise la synthèse d’isoprène à partir du 2-méthylbutanal.
La codimérisation de l’éthylène et du propène conduit au 2-méthyl-1-butène, qui peut être déshydrogéné en isoprène, mais cette méthode reste au stade expérimental.
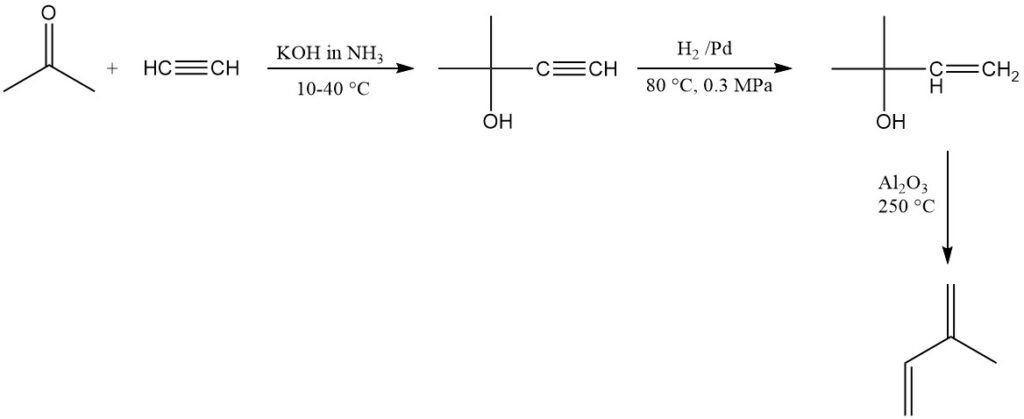
La SNAM en Italie produit commercialement de l’isoprène en utilisant de l’acétylène et de l’acétone, mais l’usine n’est plus opérationnelle. Une usine similaire existe en Afrique du Sud. Cette méthode produit de l’isoprène de haute pureté mais est relativement coûteuse.
Le procédé Goodyear-Scientific Design a produit de l’isoprène par dimérisation du propène en 2-méthyl-1-pentène, suivie d’une isomérisation en 2-méthyl-2-pentène et d’un craquage ultérieur. La première synthèse commerciale d’isoprène a utilisé cette approche (Beaumont, Texas), mais la production a cessé en 1975 en raison de la hausse des coûts du propène.
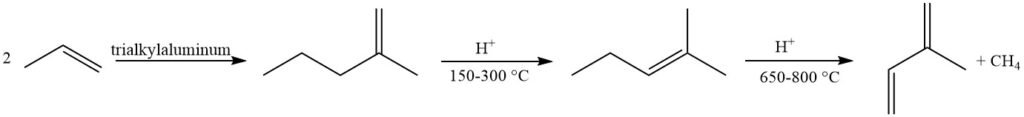
La métathèse des oléfines offre une approche intéressante utilisant des produits pétrochimiques facilement disponibles. Une fraction de butène est convertie en 2-méthyl-2-butène et propène, avec déshydrogénation ultérieure du 2-méthyl-2-butène en isoprène. Cependant, cette méthode souffre de la formation de sous-produits dus aux réactions entre diverses oléfines dans le réacteur.
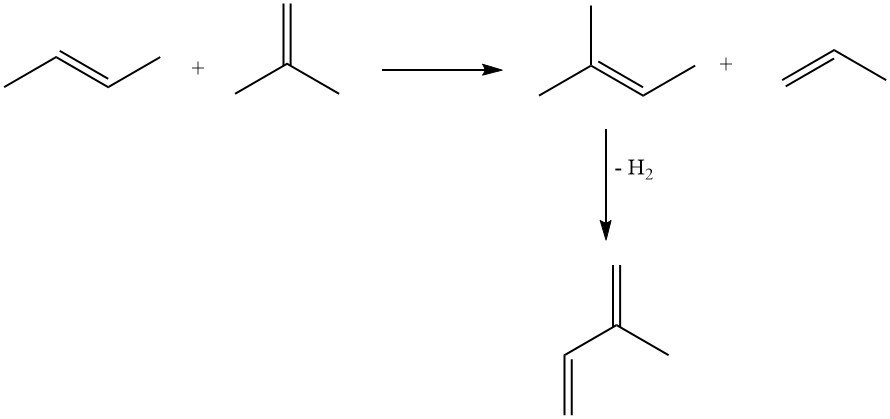
3.2. Production d’isoprène par déshydrogénation d’isopentane ou de méthylbutènes
L’isoprène peut être produit par déshydrogénation de l’isopentane ou des méthylbutènes (isopentènes). Ces réactions sont similaires à la déshydrogénation du n-butane et des n-butènes en butadiène.
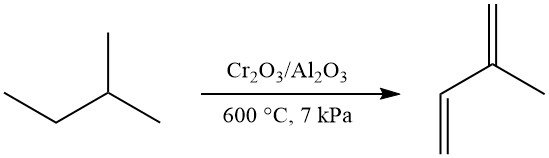
La déshydrogénation en une étape de l’isopentane en isoprène peut être réalisée à l’aide du procédé Houdry-Catadiène (catalyseur Cr2O3/Al2O3, ~600 °C, ~7 kPa), donnant 52 % d’isoprène. Cette méthode était utilisée commercialement dans l’ex-Union soviétique.
Des usines de production d’isoprène basées sur la déshydrogénation du méthylbutène existaient aux États-Unis et aux Pays-Bas mais ne sont pas opérationnelles actuellement.
Le matériau de départ est généralement extrait des gaz de craquage catalytique en utilisant la procédure Sinclair (extraction à l’acide sulfurique suivie d’une rétro-extraction avec des paraffines).
La déshydrogénation est réalisée avec un catalyseur Shell (Fe2O3-K2CO3-Cr2O3) à 600 °C avec dilution à la vapeur et permet d’obtenir un rendement en isoprène de 85 %.
La déshydrogénation oxydative de l’isopentane et des méthylbutènes a été explorée. Des rendements et des sélectivités de 60 % et 95 % pour l’isoprène ont été rapportés. Des catalyseurs silicatés dopés avec des oxydes alcalino-terreux ou des oxydes de nickel, de fer ou de cobalt sont utilisés pour la déshydrogénation oxydative des méthylbutènes en isoprène.
3.3. Récupération de l’isoprène à partir des fractions de craquage C5
L’isoprène peut être récupéré à partir des sous-produits C5 de la pyrolyse des hydrocarbures dans la production d’éthylène. Le craquage du naphta produit de l’« essence de crack » contenant une faible teneur en isoprène et d’autres hydrocarbures en C5, principalement des aromatiques en C6-C8.
La distillation sépare ce mélange en fractions C5 et aromatiques. Le rendement en isoprène est généralement de 2 à 5 % en poids sur la base de l’éthylène, augmentant avec les matières premières plus lourdes comme le gazole. Le rendement en isoprène diminue avec la gravité de la fissuration (température/temps de séjour), mais sa concentration dans la fraction C5 augmente. La récupération de l’isoprène à partir des fractions de fissures est plus économe en énergie que la synthèse chimique.
Des matières premières de craquage plus lourdes pour la production d’éthylène entraîneront davantage de sous-produits d’isoprène. Certains craqueurs ne récupèrent qu’une fraction aromatique de l’essence de craquage, tandis que le résidu C5 est souvent recyclé avec la fraction C4 dans l’alimentation du craqueur.
L’isolement de l’isoprène pur à partir de la fraction C5 n’est pas réalisable par simple distillation en raison des points d’ébullition similaires des composants et de la formation d’un azéotrope avec le n-pentane. L’enrichissement distillatif jusqu’à 25 à 50 % est utilisé commercialement pour réduire les coûts de transport et de séparation.
Les techniques de séparation pour produire de l’isoprène pur sont la distillation azéotropique, l’isolement chimique et la distillation extractive utilisant des solvants tels que la N-méthylpyrrolidone, le diméthylformamide et l’acétonitrile.
Un processus simple d’isolation de l’isoprène est illustré à la figure 1.
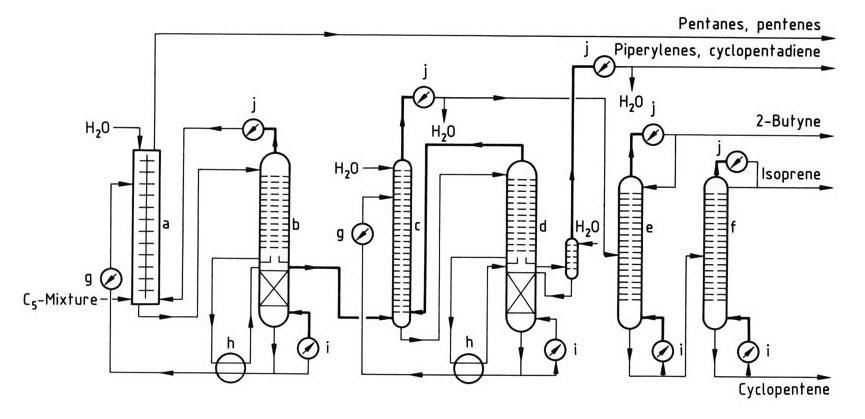
a) Liquide – colonne d'extraction liquide ; b) – d) Colonnes pour distillation extractive ; e) Colonne Butyne ; f) Colonne isoprène ; g) Refroidisseur ; h) Échangeur de chaleur ; i) Rebouilleur ; j) Condenseur
La première étape est une combinaison d’extraction liquide-liquide et de distillation extractive, particulièrement adaptée aux fractions C5 à faible teneur en isoprène. La préconcentration de l’isoprène se produit dans l’extracteur, suivie par l’élimination de l’isoprène brut de la colonne de distillation extractive.
Une distillation extractive ultérieure élimine les pipérylènes et le cyclopentadiène. La purification finale de l’isoprène de qualité polymérisable est réalisée dans des colonnes de distillation supplémentaires. Ce procédé permet de traiter des fractions C5 contenant du cyclopentadiène, qui est éliminé avec des pipérylènes.
Le procédé peut être adapté pour isoler le cyclopentadiène ou le cyclopentène avec un équipement supplémentaire, et les pipérylènes purs peuvent être récupérés avec une colonne supplémentaire.
4. Utilisations de l’isoprène
4.1. Utilisation de l’isoprène dans la synthèse des polymères
Le poly(cis-1,4-isoprène) (caoutchouc isoprène, IR), en particulier le type catalysé par le titane, est la principale application de l’isoprène. Ce caoutchouc synthétique ressemble beaucoup au caoutchouc naturel en termes de structure et de propriétés. Le caoutchouc isoprène est principalement utilisé dans la production de pneus de véhicules.
Le poly(trans-1,4-isoprène) possède des propriétés similaires à celles de la gutta-percha ou de la balata, limitant ses applications commerciales principalement à l’isolation des câbles et aux balles de golf.
Le deuxième marché de l’isoprène est la production de copolymères blocs styrène-isoprène-styrène (SIS), un type d’élastomère thermoplastique. Environ 0,79 à 0,88 tonne d’isoprène sont consommées par tonne de polymère SIS. Ces copolymères sont utilisés comme caoutchoucs thermoplastiques et adhésifs sensibles à la pression ou thermodurcissables.
De plus petites quantités d’isoprène sont utilisées dans la production de caoutchouc butyle (caoutchouc isobutène-isoprène, IIR), un copolymère avec l’isobutène. La teneur en isoprène du caoutchouc butyle est comprise entre 0,5 et 3,0 % en moles. L’IIR est connu pour sa faible perméabilité aux gaz, ce qui le rend adapté aux flexibles et doublures des pneus tubeless.
Enfin, des résines d’hydrocarbures (résines de pétrole) peuvent être produites par copolymérisation de l’isoprène à partir de fractions de craquage C5 sans cyclopentadiène avec d’autres composés insaturés en C5.
4.2. Utilisation de l’isoprène dans la synthèse des terpènes
Alors que l’isoprène subit diverses réactions chimiques, seule la synthèse des terpènes a une importance industrielle et fait l’objet de recherches actives.
En 1972, Rhodia a commencé à développer un procédé de synthèse du terpène C10 et de ses dérivés à partir de l’isoprène, de l’acétone et de l’acétylène. L’isoprène réagit avec l’acide chlorhydrique pour former du chlorure de prényle, qui est ensuite converti en déshydrolinalol en deux étapes.
Rhodia a utilisé le déhydrolinalol pour diverses synthèses mais a arrêté sa production. Cependant, Kuraray au Japon continue de produire ces composés, du squalane et d’autres à partir de l’isoprène.
Rhodia utilisait auparavant une synthèse de Grignard pour produire l’alcool terpénique C10 lavandulol à partir de deux molécules d’isoprène.
L’isoprène réagit par oligomérisation ou télomérisation pour former des terpènes. Les exemples incluent l’oligomérisation linéaire scientifiquement et industriellement pertinente de l’isoprène en myrcène et la télomérisation avec la N,N-diéthylnérylamine (tous deux terpènes en C10).
Les terpènes naturels sont constitués d’unités d’isoprène disposées « tête-à-queue » avec des positions spécifiques de double liaison. La production de terpènes à partir de l’isoprène nécessite de reproduire cette structure, ce qui rend la synthèse des terpènes C10 à partir de l’isoprène généralement moins favorable que les voies alternatives. La composition du catalyseur peut influencer la structure des diméthyloctadiènes synthétisés à partir de l’isoprène.
Takabé et coll. ont rapporté la synthèse du myrcène par oligomérisation de l’isoprène à l’aide d’un catalyseur sodium/dialkylamine. Nissan Chemical Industries a développé et annoncé la production industrielle de myrcène selon cette méthode.
La télomérisation de l’isoprène se produit avec divers composés, notamment l’ammoniac ou les amines. La régiosélectivité peut être manipulée en faisant varier la quantité et la concentration des acides de Brønsted et de Lewis dans le catalyseur.
L’isoprène réagit avec la diéthylamine pour former de la N,N-diéthylnérylamine via une réaction de télomérisation catalysée par le butyl lithium. D’autres réactions à partir de la N,N-diéthylnérylamine donnent du linalol, du géraniol, du nérol, de l’hydroxycitronellal, du citronellal et du menthol (Figure 2).
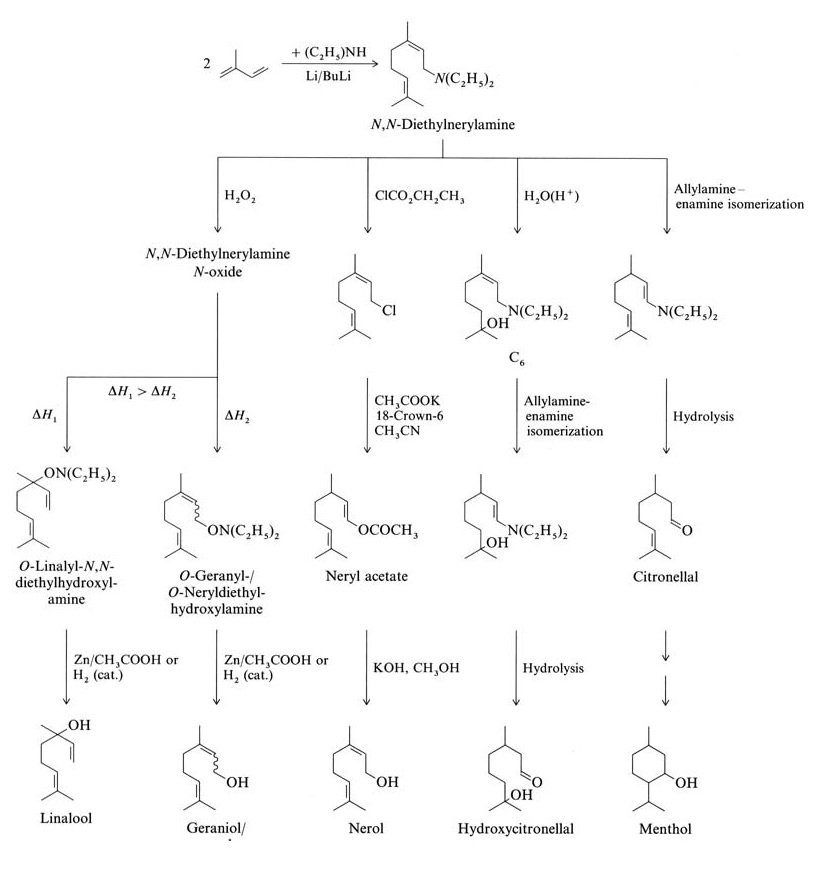
La société de parfumerie Takasago au Japon utilise une synthèse industrielle de L-menthol énantiomériquement pur à partir de citronellal optiquement actif. Ce processus implique l’isomérisation asymétrique allylamine-énamine de la N,N-diéthylgéranylamine ou de la N,N-diéthylnérylamine avec un catalyseur Rh-BINAP.
5. Toxicologie de l’isoprène
Toxicité aiguë
Une exposition élevée à l’isoprène provoque des effets anesthésiques chez les animaux, entraînant la paralysie et la mort. Des expositions par inhalation uniques de 2 heures chez des souris (56 000 mg/m³) n’ont montré aucun effet indésirable. Des niveaux de 98 000 à 126 000 mg/m³ ont induit une narcose profonde, et une exposition à 140 000 mg/m³ pendant 2 heures a entraîné une mortalité (CL50 = 180 000 mg/m³ pour les rats).
La concentration seuil d’irritation chez le chat est de 800 mg/m³. Les valeurs de DL50 orale et intrapéritonéale chez les rats mâles ont été déterminées à 2 100 mg/kg et 1 400 mg/kg, respectivement, pour l’isoprène liquide. Une exposition cutanée unique (1 ml/kg) chez le rat n’a entraîné aucune mortalité ni symptôme indésirable.
Toxicité d’exposition répétée
Des rats et des souris ont été exposés à 0, 438, 875, 1 750, 3 500 et 7 000 ppm d’isoprène pendant deux semaines par inhalation. Les rats n’ont présenté aucun changement lié à l’exposition.
Les souris exposées à 7 000 ppm ont présenté un gain de poids corporel inférieur, tandis que tous les groupes présentaient une anémie, une atrophie testiculaire, une dégénérescence épithéliale olfactive et des modifications hyperplasiques épithéliales de l’estomac. Semblable au 1,3-butadiène, les souris semblent être plus sensibles que les rats.
Une exposition cutanée répétée (500 mg x 2 applications/jour pendant 5 jours) sur les oreilles de lapin n’a provoqué qu’une légère irritation réversible. Les données sur l’exposition par inhalation à long terme ne sont pas disponibles.
Mutagénicité
L’isoprène et ses monoépoxydes ne sont pas mutagènes dans le test d’Ames. Cependant, le dioxyde d’isoprène (2-méthyl-1,2,3,4-diépoxybutane) s’est révélé mutagène dans ce système de test.
En raison des similitudes potentielles avec le 1,3-butadiène dans la génération de métabolites mutagènes, une évaluation plus approfondie du pouvoir cancérigène de l’isoprène est justifiée.
L’exposition par inhalation de souris à 438-7 000 ppm d’isoprène pendant 6 h/jour pendant 12 jours a entraîné une augmentation des fréquences d’échange des chromatides sœurs, indiquant des effets cytogénétiques.
Les données sur les effets sur la reproduction ou tératogènes ne sont pas disponibles.
Métabolisme
Les fractions mitochondriales de rongeurs convertissent l’isoprène en ses monoépoxydes (3,4-époxy-3-méthyl-1-butène et 3,4-époxy-2-méthyl-1-butène), conduisant aux diols correspondants. Une oxydation mineure du métabolite le plus stable (3,4-époxy-2-méthyl-1-butène) en diépoxyde a été rapportée.
L’isoprène subit un métabolisme important dans les voies respiratoires. Jusqu’à 300 ppm d’isoprène atmosphérique, l’exposition présente une proportionnalité directe entre la concentration d’exposition et le métabolisme. Les effets de saturation se produisent au-dessus de 300 à 500 ppm. Les souris métabolisent l’isoprène plus rapidement que les rats.
Une synthèse endogène d’isoprène a été observée. Les taux de synthèse chez les souris et les rats non exposés sont estimés à 0,4 mmol h⁻¹ kg⁻¹ et 1,9 mmol h⁻¹ kg⁻¹, respectivement.
Effets humains
À des niveaux d’exposition très élevés, l’isoprène agit comme un stupéfiant chez l’homme. Il peut également irriter la peau, les yeux, les muqueuses et les voies respiratoires.
Normes d’hygiène
Aucune valeur limite seuil (TLV) ni concentration maximale admissible (MAK) n’a été établie pour l’isoprène. L’ex-Union soviétique a fixé un seuil de 40 mg/m³.
Références
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812


