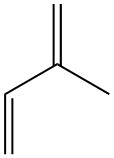
Isopren, auch bekannt als 2-Methyl-1,3-butadien, ist ein Kohlenwasserstoff mit fünf Kohlenstoffatomen, der in der Natur in Spuren vorkommt. Es ist eine farblose, flüchtige Flüssigkeit mit der chemischen Formel C5H8.
Isopren wird als Grundbaustein für zahlreiche Naturprodukte verwendet. Dazu gehören Terpene (Naturkautschuk, Kampfer), Vitamin A und Steroid-Sexualhormone (gemäß der „Isopren-Regel“ von Wallach und Ruzicka). Es wurde erstmals 1860 von Williams durch Pyrolyse von Naturkautschuk synthetisiert.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Isopren
Unter normalen Bedingungen ist Isopren eine farblose, flüchtige Flüssigkeit, die bei 20 °C in Wasser unlöslich ist. Es ist mit organischen Lösungsmitteln wie Ethanol, Diethylether, Aceton und Benzol mischbar.
Isopren bildet binäre azeotrope Gemische mit verschiedenen Verbindungen wie Methanol, n-Pentan, Schwefelkohlenstoff, Methylformiat, Bromethan, Ethanol, Dimethylsulfid, Aceton, Propylenoxid, Ethylformiat, Isopropylnitrit, Methylal, Diethylether, Perfluortriethylamin, Acetonitril usw Isopropylamin.
Wichtige physikalische Eigenschaften von Isopren sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht | 68,118 g/mol |
| Schmelzpunkt (101,3 kPa) | -145,95 °C |
| Siedepunkt (101,3 kPa) | 34.059 °C |
| Kritische Temperatur | 483,3 K |
| Kritischer Druck | 3,74 MPa |
| Kritisches Volumen | 266 cm3/mol |
| Dichte (293 K) | 0,68095 g/cm3 |
| Viskosität (293 K) | 0,216 mPa.s |
| Oberflächenspannung (293 K) | 18,22 mN/m |
| Brechungsindex | 1,42194 |
| Dampfdruck | |
| -20 °C | 9,8 kPa |
| 0 °C | 26,4 kPa |
| 20 °C | 60,7 kPa |
| 34.059 °C | 101,3 kPa |
| 40 °C | 123,8 kPa |
| 60 °C | 229,1 kPa |
| 80 °C | 392,1 kPa |
| 100 °C | 629,5 kPa |
| Spezifische Wärme | |
| Dampf (298 K) | 102,69 J mol-1 K-1 |
| Flüssigkeit (298 K) | 151,07 J mol-1 K-1 |
| Explosionsgrenzen in Luft (Gesamtdruck 13 kPa, 25 °C) | |
| Obergrenze | 7 – 9,7 Vol.-% (200 – 275 g/m3) |
| Untergrenze | 1 – 1,5 Vol.-% (28 – 40 g/m3) |
| Maximaler Explosionsdruck | 0,66 MPa |
2. Chemische Eigenschaften von Isopren
Die spektroskopische Analyse zeigt, dass bei 50 °C die Mehrzahl der Isoprenmoleküle in der s-trans-Konformation vorliegt. Nur 15 % nehmen die energiereichere s-cis-Form an.
Als konjugiertes Dien zeigt Isopren ein charakteristisches Verhalten. Das Vorhandensein einer Methylgruppe erhöht seine Reaktivität mit Elektrophilen und Diels-Alder-Dienophilen im Vergleich zu Butadien.
Isopren ist aufgrund seiner vier einzigartigen Wasserstoffatome im Vergleich zu Butadien nur zwei reaktiver als Butadien. Isopren ist an einer Vielzahl von Reaktionen beteiligt, darunter Substitution, Addition, Ringbildung, Komplexierung und Telomerisierung.
Die Reaktion mit Hydroxylradikalen ist der dominierende Weg für den Isoprenabbau in der Atmosphäre. Hydroxylradikale, hochreaktive Moleküle, lösen eine komplexe Kettenreaktion aus, die Isopren in verschiedene Produkte zerlegt. Es kann auch durch Ozon zersetzt werden.
Unter hohen Temperaturen und bestimmten Bedingungen bildet Isopren Peroxide und freie Radikale, was letztendlich zur Zersetzung von Isopren in verschiedene Produkte wie Dimethoxymethan und Naphthalin führt.
Isopren kann ähnlich wie Alkene Additionsreaktionen eingehen, ist jedoch nicht selektiv und führt zu einem Produktgemisch.
Die einzige wichtige chemische Reaktion von Isopren ist seine Umwandlung in Terpene. Isopren wird hauptsächlich in der Polymersynthese verwendet.
3. Herstellung von Isopren
3.1. Herstellung von Isopren aus Olefinen
Isopren wird hauptsächlich durch die säurekatalysierte Prins-Reaktion von Formaldehyd mit Isobuten hergestellt, wobei 4,4-Dimethyl-1,3-dioxan entsteht, das dann in der Gasphase (bei 200–300 °C) gespalten wird, um Isopren zu ergeben und zurückzugewinnen die Hälfte des Formaldehyds.
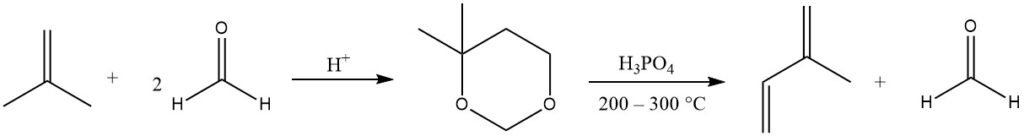
Mehrere Unternehmen haben diesen Prozess aufgrund leicht verfügbarer Ausgangsmaterialien verfeinert. Aktuelle Produktionsanlagen dieser Art gibt es in Japan.
Die Bemühungen konzentrierten sich auf die Vereinfachung und Verbesserung der Kosteneffizienz der Isoprensynthese aus Isobuten und Formaldehyd. Takeda Chemical in Japan schlug einen einstufigen Gasphasenprozess mit Oxidkatalysatoren vor.
Formaldehyd-Nebenprodukte stellen eine Herausforderung dar. Unternehmen wie Idemitsu und Sun Oil verwenden Formaldehyd-Derivate (Methylal, Dimethoxymethan), um Harzbildung zu vermeiden. Alternative Methoden bestehen darin, die Formaldehydproduktion direkt in den Prozess mit Methanol und Sauerstoff oder Methyl-tert-butylether (MTBE) und Sauerstoff zu integrieren.
Japanische Patente untersuchten tert-Butylalkohol als C4-Quelle, während frühere sowjetische Veröffentlichungen Methoden beschrieben, die auf der 1,3-Dioxan-Spaltung basieren.
Der einstufige Gasphasenprozess ist durch die geringe Raum-Zeit-Ausbeute des Katalysators und die schnelle Desaktivierung begrenzt. Es ist unklar, ob eine dieser Variationen die kommerzielle Produktion erreicht hat.
2-Methylbutanal ist ein weiterer Rohstoff zur Herstellung von Isopren. Es wird durch Hydroformylierung von 2-Buten unter Verwendung eines Rhodiumkatalysators hergestellt.
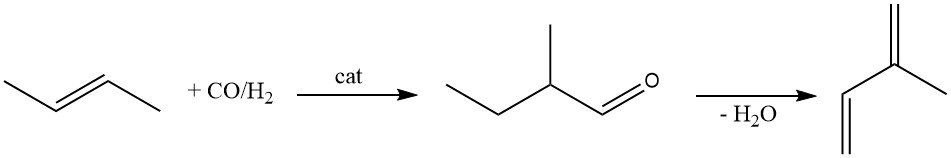
Die katalytische Dehydratisierung von 2-Methylbutanal zu Isopren wurde ausführlich untersucht. Obwohl zahlreiche Katalysatoren vorgeschlagen wurden (β-Phosphat, Magnesium-Ammonium-Phosphat, Molekularsiebe und Zeolithe), leiden sie alle unter einem schnellen Aktivitätsverlust.
Allerdings zeigen mit Silan oder Cäsium modifizierte Zeolithe eine verbesserte Lebensdauer. Die Spaltung von 3-Methylbutanal lieferte schlechtere Ergebnisse. Derzeit nutzen keine Industrieanlagen die Synthese von Isopren aus 2-Methylbutanal.
Die Codimerisierung von Ethylen und Propen führt zu 2-Methyl-1-buten, das zu Isopren dehydriert werden kann, diese Methode befindet sich jedoch noch im experimentellen Stadium.
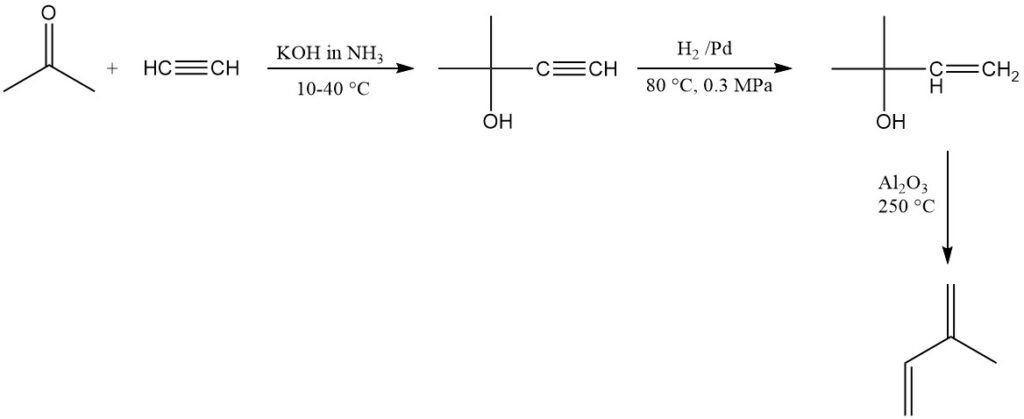
SNAM in Italien produziert kommerziell Isopren unter Verwendung von Acetylen und Aceton, die Anlage ist jedoch nicht mehr in Betrieb. Eine ähnliche Anlage gibt es in Südafrika. Diese Methode erzeugt hochreines Isopren, ist aber relativ teuer.
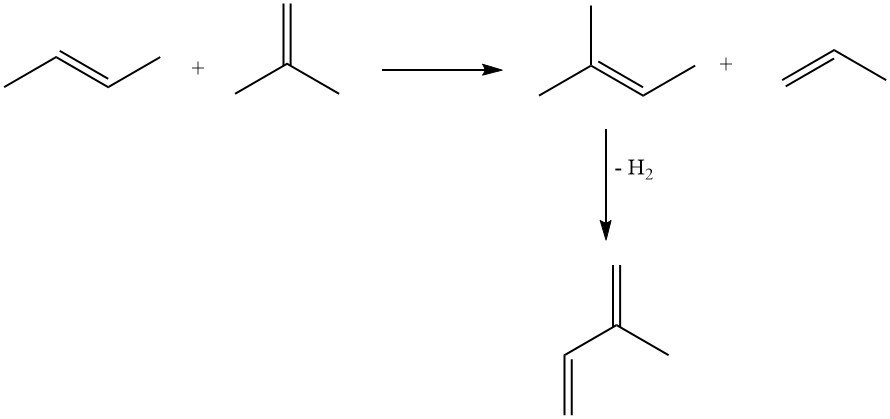
Der Goodyear-Scientific Design-Prozess erzeugte Isopren durch Propendimerisierung zu 2-Methyl-1-penten, gefolgt von der Isomerisierung zu 2-Methyl-2-penten und anschließendem Cracken. Die erste kommerzielle Isoprensynthese nutzte diesen Ansatz (Beaumont, Texas), die Produktion wurde jedoch 1975 aufgrund steigender Propenkosten eingestellt.
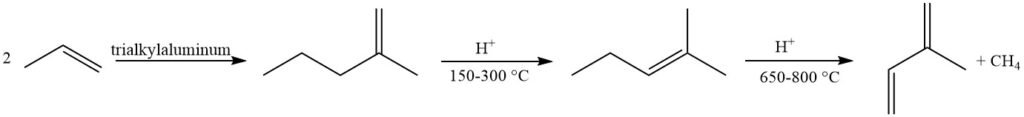
Die Olefinmetathese bietet einen attraktiven Ansatz unter Verwendung leicht verfügbarer Petrochemikalien. Eine Butenfraktion wird in 2-Methyl-2-buten und Propen umgewandelt, mit anschließender Dehydrierung von 2-Methyl-2-buten zu Isopren. Dieses Verfahren leidet jedoch unter der Bildung von Nebenprodukten aufgrund von Reaktionen zwischen verschiedenen Olefinen im Reaktor.
3.2. Herstellung von Isopren durch Dehydrierung von Isopentan oder Methylbutenen
Isopren kann durch Dehydrierung von Isopentan oder Methylbutenen (Isopentenen) hergestellt werden. Diese Reaktionen ähneln der Dehydrierung von n-Butan und n-Butenen zu Butadien.
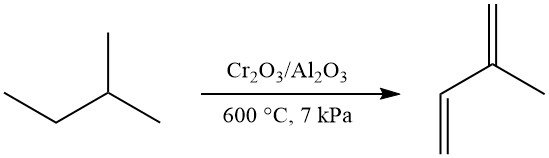
Eine einstufige Dehydrierung von Isopentan zu Isopren kann mit dem Houdry-Catadiene-Verfahren (Cr2O3/Al2O3-Katalysator, ~600 °C, ~7 kPa) erreicht werden, was eine Ausbeute von 52 % Isopren ergibt. Diese Methode wurde in der ehemaligen Sowjetunion kommerziell genutzt.
Isopren-Produktionsanlagen auf Basis der Methylbuten-Dehydrierung existierten in den Vereinigten Staaten und den Niederlanden, sind jedoch derzeit nicht in Betrieb.
Das Ausgangsmaterial wird typischerweise nach dem Sinclair-Verfahren (Schwefelsäureextraktion und anschließende Rückextraktion mit Paraffinen) aus Cat-Cracker-Abgasen gewonnen.
Die Dehydrierung erfolgt mit einem Shell-Katalysator (Fe2O3-K2CO3-Cr2O3) bei 600 °C mit Dampfverdünnung und erreicht eine Isoprenausbeute von 85 %.
Die oxidative Dehydrierung von Isopentan und Methylbutenen wurde untersucht. Für Isopren wurden Ausbeuten und Selektivitäten von 60 % und 95 % berichtet. Für die oxidative Dehydrierung von Methylbutenen zu Isopren werden mit Erdalkalioxiden oder Oxiden von Nickel, Eisen oder Kobalt dotierte Silikatkatalysatoren eingesetzt.
3.3. Rückgewinnung von Isopren aus C5-Crackfraktionen
Isopren kann aus C5-Nebenprodukten der Kohlenwasserstoffpyrolyse bei der Ethylenproduktion gewonnen werden. Durch das Cracken von Naphtha entsteht „Crackbenzin“ mit niedrigem Isoprengehalt und anderen C5-Kohlenwasserstoffen, hauptsächlich C6-C8-Aromaten.
Durch Destillation wird dieses Gemisch in C5- und Aromatenfraktionen getrennt. Die Isoprenausbeute beträgt typischerweise 2–5 Gew.-%, bezogen auf Ethylen, und steigt mit schwereren Rohstoffen wie Gasöl. Die Isoprenausbeute nimmt mit zunehmender Crackhärte (Temperatur/Verweilzeit) ab, ihre Konzentration in der C5-Fraktion nimmt jedoch zu. Die Rückgewinnung von Isopren aus Crackfraktionen ist energieeffizienter als die chemische Synthese.
Schwerere Cracker-Rohstoffe für die Ethylenproduktion werden zu mehr Isopren-Nebenprodukten führen. Einige Cracker gewinnen nur eine aromatische Fraktion aus Crackbenzin zurück, während der C5-Rückstand häufig mit der C4-Fraktion in der Crackerbeschickung recycelt wird.
Die Isolierung reinen Isoprens aus der C5-Fraktion ist durch einfache Destillation aufgrund der ähnlichen Siedepunkte der Komponenten und der Bildung eines Azeotrops mit n-Pentan nicht möglich. Die destillative Anreicherung auf 25–50 % wird kommerziell genutzt, um Transport- und Trennkosten zu senken.
Trenntechniken zur Herstellung von reinem Isopren sind azeotrope Destillation, chemische Isolierung und extraktive Destillation unter Verwendung von Lösungsmitteln wie N-Methylpyrrolidon, Dimethylformamid und Acetonitril.
Ein einfacher Isopren-Isolierungsprozess ist in Abbildung 1 dargestellt.
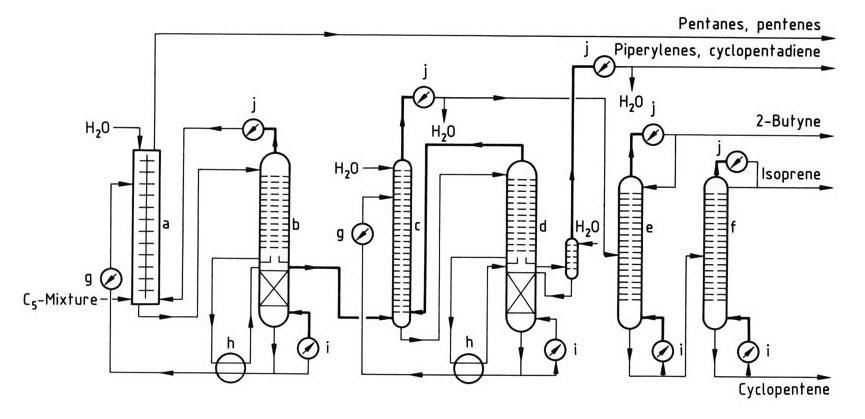
a) Flüssig-Flüssig-Extraktionskolonne; b) – d) Kolonnen für die Extraktivdestillation; e) Butyne-Säule; f) Isoprensäule; g) Kühler; h) Wärmetauscher; i) Reboiler; j) Kondensator
Der erste Schritt ist eine Kombination aus Flüssig-Flüssig-Extraktion und extraktiver Destillation, die sich besonders für C5-Fraktionen mit niedrigem Isoprengehalt eignet. Die Vorkonzentration von Isopren erfolgt im Extraktor, gefolgt von der Entfernung des rohen Isoprens aus der Extraktivdestillationskolonne.
Durch anschließende Extraktivdestillation werden Piperylene und Cyclopentadien entfernt. Die endgültige Reinigung von Isopren in Polymerisationsqualität erfolgt in zusätzlichen Destillationskolonnen. Dieses Verfahren ermöglicht die Verarbeitung von C5-Fraktionen, die Cyclopentadien enthalten, das mit Piperylenen entfernt wird.
Das Verfahren kann mit zusätzlicher Ausrüstung angepasst werden, um Cyclopentadien oder Cyclopenten zu isolieren, und reine Piperylene können mit einer zusätzlichen Kolonne zurückgewonnen werden.
4. Verwendung von Isopren
4.1. Verwendung von Isopren in der Polymersynthese
Poly(cis-1,4-isopren) (Isoprenkautschuk, IR), insbesondere der titankatalysierte Typ, ist die Hauptanwendung von Isopren. Dieser synthetische Kautschuk ähnelt in Struktur und Eigenschaften stark dem Naturkautschuk. Isoprenkautschuk wird hauptsächlich in der Fahrzeugreifenproduktion verwendet.
Poly(trans-1,4-isopren) hat ähnliche Eigenschaften wie Guttapercha oder Balata, weshalb seine kommerziellen Anwendungen hauptsächlich auf Kabelisolierungen und Golfbälle beschränkt sind.
Der zweitgrößte Markt für Isopren ist die Herstellung von Styrol-Isopren-Styrol (SIS)-Blockcopolymeren, einer Art thermoplastischer Elastomere. Pro Tonne SIS-Polymer werden etwa 0,79–0,88 Tonnen Isopren verbraucht. Diese Copolymere werden als thermoplastische Kautschuke und druckempfindliche oder duroplastische Klebstoffe verwendet.
Geringere Mengen Isopren werden bei der Herstellung von Butylkautschuk (Isobuten-Isopren-Kautschuk, IIR), einem Copolymer mit Isobuten, verwendet. Der Isoprengehalt in Butylkautschuk liegt zwischen 0,5 und 3,0 Mol-%. IIR ist für seine geringe Gasdurchlässigkeit bekannt und eignet sich daher für Schläuche und Liner in schlauchlosen Reifen.
Schließlich können Kohlenwasserstoffharze (Erdölharze) durch Copolymerisation von Isopren aus Cyclopentadien-freien C5-Crackfraktionen mit anderen ungesättigten C5-Verbindungen hergestellt werden.
4.2. Verwendung von Isopren in der Terpensynthese
Während Isopren verschiedene chemische Reaktionen durchläuft, ist nur die Terpensynthese von industrieller Bedeutung und wird aktiv erforscht.
Im Jahr 1972 begann Rhodia mit der Entwicklung eines Verfahrens zur C10-Terpen- und Derivatsynthese aus Isopren, Aceton und Acetylen. Isopren reagiert mit Salzsäure zu Prenylchlorid, das dann in zwei Schritten in Dehydrolinalool umgewandelt wird.
Rhodia verwendete Dehydrolinalool für verschiedene Synthesen, stellte die Produktion jedoch ein. Allerdings stellt Kuraray in Japan diese Verbindungen, Squalan und andere weiterhin aus Isopren her.
Rhodia nutzte zuvor eine Grignard-Synthese, um aus zwei Isoprenmolekülen den C10-Terpenalkohol Lavandulol herzustellen.
Isopren reagiert durch Oligomerisierung oder Telomerisierung zu Terpenen. Beispiele hierfür sind die wissenschaftlich und industriell relevante lineare Oligomerisierung von Isopren zu Myrcen und die Telomerisierung mit N,N-Diethylnerylamin (beides C10-Terpene).
Natürlich vorkommende Terpene bestehen aus „Kopf-an-Schwanz“ angeordneten Isopreneinheiten mit spezifischen Doppelbindungspositionen. Die Herstellung von Terpenen aus Isopren erfordert die Replikation dieser Struktur, wodurch die Synthese von C10-Terpenen aus Isopren im Allgemeinen weniger günstig ist als alternative Wege. Die Zusammensetzung des Katalysators kann die Struktur von aus Isopren synthetisierten Dimethyloctadienen beeinflussen.
Takabe et al. berichteten über die Myrcensynthese durch Oligomerisierung von Isopren unter Verwendung eines Natrium/Dialkylamin-Katalysators. Nissan Chemical Industries entwickelte und kündigte die industrielle Produktion von Myrcen mit dieser Methode an.
Die Telomerisierung von Isopren erfolgt mit verschiedenen Verbindungen, einschließlich Ammoniak oder Aminen. Die Regioselektivität kann durch Variation der Menge und Konzentration der Brønsted- und Lewis-Säuren im Katalysator manipuliert werden.
Isopren reagiert mit Diethylamin unter Bildung von N,N-Diethylnerylamin über eine Butyllithium-katalysierte Telomerisationsreaktion. Weitere Reaktionen aus N,N-Diethylnerylamin ergeben Linalool, Geraniol, Nerol, Hydroxycitronellal, Citronellal und Menthol (Abbildung 2).
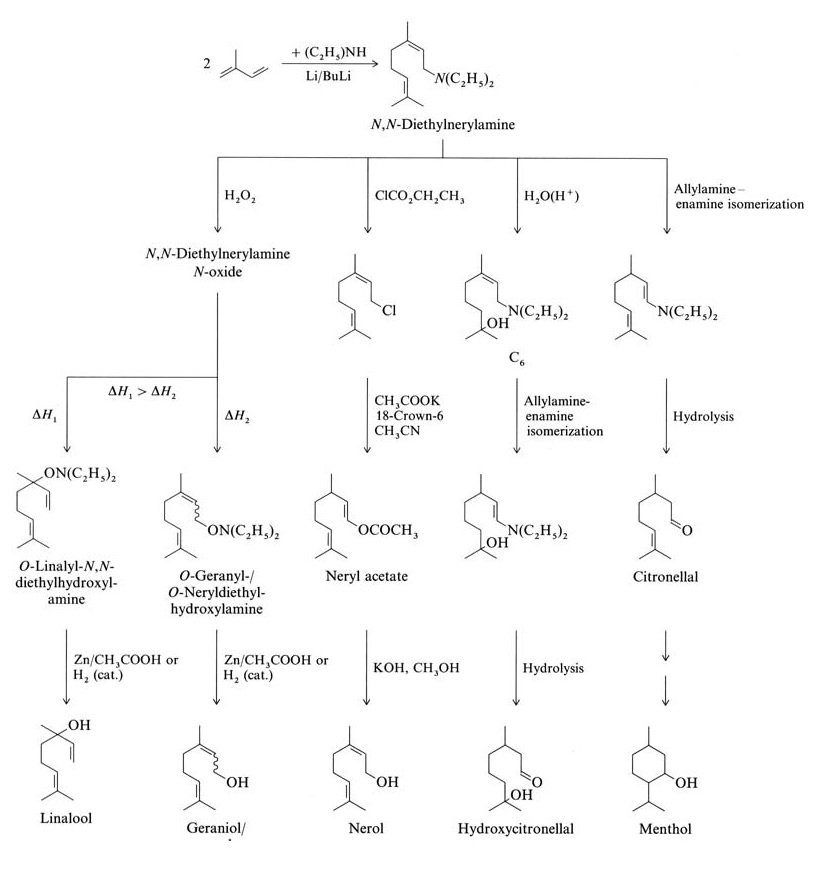
Die Takasago Perfumery Company in Japan nutzt eine industrielle Synthese für enantiomerenreines L-Menthol aus optisch aktivem Citronellal. Dieser Prozess beinhaltet die asymmetrische Allylamin-Enamin-Isomerisierung von N,N-Diethylgeranylamin oder N,N-Diethylnerylamin mit einem Rh-BINAP-Katalysator.
5. Toxikologie von Isopren
Akute Toxizität
Eine hohe Isopren-Exposition verursacht bei Tieren eine anästhetische Wirkung, die zu Lähmungen und zum Tod führt. Eine einmalige zweistündige inhalative Exposition bei Mäusen (56.000 mg/m³) zeigte keine schädlichen Auswirkungen. Konzentrationen von 98.000–126.000 mg/m³ lösten eine tiefe Narkose aus, und eine zweistündige Exposition gegenüber 140.000 mg/m³ verursachte Mortalität (LC50 = 180.000 mg/m³ für Ratten).
Die Reizschwellenkonzentration bei Katzen wird mit 800 mg/m³ angegeben. Bei männlichen Ratten wurden orale und intraperitoneale LD50-Werte von 2100 mg/kg bzw. 1400 mg/kg für flüssiges Isopren ermittelt. Eine einmalige dermale Exposition (1 ml/kg) bei Ratten verursachte keine Mortalität oder unerwünschte Symptome.
Toxizität bei wiederholter Exposition
Ratten und Mäuse wurden zwei Wochen lang durch Inhalation 0, 438, 875, 1750, 3500 und 7000 ppm Isopren ausgesetzt. Bei Ratten zeigten sich keine expositionsbedingten Veränderungen.
Mäuse, die 7000 ppm ausgesetzt waren, zeigten eine geringere Körpergewichtszunahme, während alle Gruppen Anämie, Hodenatrophie, olfaktorische Epitheldegeneration und epitheliale hyperplastische Veränderungen im Magen aufwiesen. Ähnlich wie bei 1,3-Butadien scheinen Mäuse anfälliger zu sein als Ratten.
Wiederholte dermale Exposition (500 mg x 2 Anwendungen/Tag über 5 Tage) an Kaninchenohren verursachte nur leichte, reversible Reizungen. Daten zur langfristigen Inhalationsexposition liegen nicht vor.
Mutagenität
Isopren und seine Monoepoxide sind im Ames-Test nicht mutagen. Allerdings zeigte Isoprendioxid (2-Methyl-1,2,3,4-diepoxybutan) in diesem Testsystem mutagene Wirkung.
Aufgrund möglicher Ähnlichkeiten mit 1,3-Butadien bei der Bildung mutagener Metaboliten ist eine weitere Bewertung der Karzinogenität von Isopren erforderlich.
Die inhalative Exposition von Mäusen gegenüber 438–7000 ppm Isopren für 6 Stunden/Tag über 12 Tage führte zu einer erhöhten Schwesterchromatid-Austauschhäufigkeit, was auf zytogenetische Effekte hinweist.
Es liegen keine Daten zu reproduktiven oder teratogenen Wirkungen vor.
Stoffwechsel
Mitochondriale Fraktionen von Nagetieren wandeln Isopren in seine Monoepoxide (3,4-Epoxy-3-methyl-1-buten und 3,4-Epoxy-2-methyl-1-buten) um, was zu den entsprechenden Diolen führt. Es wurde über eine geringfügige Oxidation des stabileren Metaboliten (3,4-Epoxy-2-methyl-1-buten) zu einem Diepoxid berichtet.
Isopren unterliegt einem erheblichen Stoffwechsel im Atemtrakt. Bis zu 300 ppm atmosphärische Isopren-Exposition zeigt eine direkte Proportionalität zwischen Expositionskonzentration und Metabolismus. Sättigungseffekte treten oberhalb von 300–500 ppm auf. Mäuse verstoffwechseln Isopren schneller als Ratten.
Es wurde eine endogene Isoprensynthese beobachtet. Die Syntheseraten bei nicht exponierten Mäusen und Ratten werden auf 0,4 mmol h⁻¹ kg⁻¹ bzw. 1,9 mmol h⁻¹ kg⁻¹ geschätzt.
Menschliche Auswirkungen
Bei sehr hoher Exposition wirkt Isopren beim Menschen als Narkotikum. Es kann auch zu Reizungen der Haut, Augen, Schleimhäute und Atemwege führen.
Hygienestandards
Für Isopren wurde kein Grenzwert (TLV) oder maximal zulässige Konzentration (MAK) festgelegt. Die ehemalige Sowjetunion legte einen Grenzwert von 40 mg/m³ fest.
Verweise
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812


