Alcool isopropylique : propriétés, réactions chimiques, production industrielle, applications et toxicologie
Qu’est-ce que l’alcool isopropylique ?
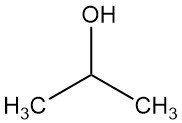
L’alcool isopropylique, également appelé isopropanol ou 2-propanol, est l’alcool secondaire le plus simple, de formule chimique C3H7OH. C’est un liquide incolore, volatil et inflammable, au goût légèrement amer et à l’odeur subtile, semblable à celle d’un mélange d’éthanol et d’acétone.
L’isopropanol est présent naturellement dans les huiles de fusel brutes et comme produit de fermentation et de décomposition de divers végétaux. Il est considéré comme le premier alcool dérivé de la pétrochimie et, parmi les alcools inférieurs (C1-C5), il se classe au troisième rang mondial de la production, après le méthanol et l’éthanol.
Table des matières
1. Propriétés physiques de l’alcool isopropylique
L’alcool isopropylique (2-propanol) est un alcool secondaire parfaitement miscible à l’eau et facilement soluble dans un large éventail de solvants organiques courants, notamment les éthers, les esters, les cétones, les acides et autres alcools.
La solubilité de l’isopropanol dans l’eau diminue en présence de sels dissous, et l’ajout de sels tels que le chlorure de sodium ou le sulfate de sodium induit une séparation de phases, produisant une couche organique non miscible. Cette propriété est exploitée pour l’extraction de composés polaires à partir de solutions aqueuses.
Les propriétés physiques de l’alcool isopropylique sont influencées par son groupe hydroxyle polaire (–OH) et sa structure d’alcool secondaire. Ses points d’ébullition et d’éclair sont inférieurs à ceux du n-propanol, tandis que sa pression de vapeur et son point de congélation sont plus élevés.
Le tableau 1 présente les propriétés physiques de l’alcool isopropylique anhydre ainsi que de son mélange azéotropique à 91 % vol. avec l’eau.
| Propriété | Anhydre | 91 Vol % |
|---|---|---|
| Poids moléculaire | 60,10 | |
| Point d’ébullition, à 101,3 kPa, °C | 82,3 | 80,4 |
| Point de congélation, °C | −88,5 | −50,0 |
| Densité relative, 20/20 | 0,7864 | 0,8183 |
| Masse volumique à 20 °C, g/cm3 | 0,7854 | 0,8173 |
| Tension superficielle à 20 °C, mN/m(= dyn/cm) | 21,32 | 21,40 |
| Chaleur massique, liquide à 20 °C, J/(kg·K) | 2510,4 | |
| Indice de réfraction | 1,3772 | 1,3769 |
| Chaleur de combustion, à 25 °C, kJ/mol | 2005,8 | |
| Chaleur latente de vaporisation, à 101,3 kPa, kJ/mol | 39,8 | |
| Pression de vapeur, à 20 °C, kPa | 4,4 | 4,5 |
| Température critique, °C | 235,2 | |
| Pression critique à 20 °C, kPa | 4764 | |
| Viscosité, mPa·s(= cP) à 0 °C | 4,6 | |
| Viscosité, mPa·s(= cP) à 20 °C | 2,4 | 2,1 |
| Viscosité, mPa·s(= cP) à 40 °C | 1,4 | |
| Limite d'inflammabilité dans l'air, % vol. | Inférieure : 2,5 Supérieure : 12 |
|
| Point d'éclair, °C (vase ouvert) | 17,2 | 21,7 |
| Point d'éclair, °C (vase fermé) | 11,7 | 18,3 |
| Température d'auto-inflammation, °C | 399 |
Aux États-Unis, les qualités commerciales d’isopropanol sont principalement constituées d’alcool isopropylique anhydre et d’un azéotrope aqueux à 91 % vol. Les préparations d’alcool isopropylique contiennent généralement 70 % ou plus d’alcool isopropylique dans l’eau.
L’alcool isopropylique forme également des azéotropes avec divers composés, notamment des hydrocarbures, des esters, des halocarbures, des amines, des cétones et des hydrocarbures aromatiques. Il ne forme pas d’azéotropes binaires avec l’acétone, l’éthanol, l’éthylbenzène, l’hexylamine ou la méthylisobutylcétone, mais il peut former des systèmes azéotropiques ternaires avec certains de ces composés.
Des exemples d’azéotropes binaires d’alcool isopropylique sont présentés dans le tableau 2.
| Composant | Point d'ébullition, °C | Point d'ébullition de l'azéotrope, °C | Composition de l'alcool isopropylique, % en poids |
|---|---|---|---|
| eau | 100 | 80,3 | 87,4 |
| toluène | 110,6 | 80,6 | 69 |
| propionate de méthyle | 79,6 | 77 | 28 |
| méthyléthylcétone | 79,6 | 77,9 | 32 |
| acétate d'éthyle | 77,05 | 75,9 | 25 |
| 2-chlorobutane | 68,25 | 64 | 18 |
| hexane | 68,9 | 62,7 | 23 |
| cyclohexane | 80,8 | 68,6 | 33 |
| butylamine | 77,8 | 84,7 | 60 |
| éther diisopropylique | 69 | 66,2 | 16,3 |
2. Réactions chimiques de l’alcool isopropylique
Les propriétés chimiques de l’alcool isopropylique sont déterminées par la présence d’un groupe hydroxyle secondaire. Sa réactivité, caractéristique des alcools secondaires, est généralement plus élevée au niveau de la fraction hydroxyle que celle des alcools primaires tels que l’alcool n-propylique ou l’alcool éthylique. La plupart des réactions impliquent la rupture de la liaison C–OH ou O–H.
L’alcool isopropylique subit un large éventail de transformations, notamment la déshydrogénation, l’oxydation, l’estérification, l’éthérification, l’amination et l’halogénation. Parmi les exemples industriels importants, on peut citer la préparation de l’isopropoxyde d’aluminium et des halogénures d’isopropyle.
L’isopropoxyde d’aluminium est produit quantitativement par chauffage à reflux de l’alcool isopropylique avec de l’aluminium métallique, en présence de quantités catalytiques de chlorure mercurique :
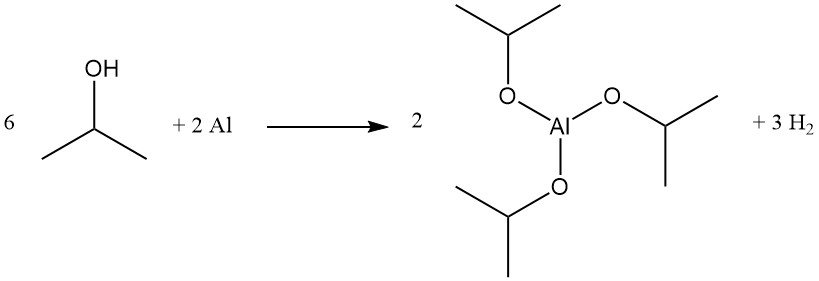
Ce composé est un réducteur efficace de Meerwein-Ponndorf-Verley pour certaines réactions d’échange d’esters et de réduction de carbonyles. Il est également utilisé comme précurseur du glycinate d’aluminium, un agent tampon.
Les halogénures d’isopropyle, comme le bromure d’isopropyle, sont obtenus par déplacement du groupe hydroxyle par réaction avec des halogénures d’hydrogène. Le reflux de l’alcool isopropylique avec de l’acide bromhydrique produit du bromure d’isopropyle et de l’eau :
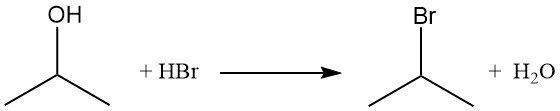
L’ordre de réactivité avec les halogénures d’hydrogène est HI > HBr > HCl. La réaction avec l’acide chlorhydrique pour former du chlorure d’isopropyle est catalysée par la présence de chlorure de zinc.
L’alcool isopropylique peut être déprotoné pour produire des sels d’isopropoxyde, largement utilisés comme bases fortes non nucléophiles en synthèse organique.
Dans les réactions d’hydrogénation par transfert catalytique, il est utilisé comme réducteur terminal pour la réduction des aldéhydes, des cétones et d’autres groupes fonctionnels. Au cours de ces réactions, le 2-propanol est oxydé en acétone.
Ce processus est réversible et un contact prolongé entre le produit et le catalyseur peut diminuer l’énantiopureté lors des réductions asymétriques. L’équilibre peut être déplacé vers la formation du produit en utilisant un excès d’isopropanol, en éliminant l’acétone par distillation ou en séparant le produit réduit du milieu réactionnel.
2.1. Déshydrogénation de l’alcool isopropylique
La déshydrogénation de l’alcool isopropylique est une réaction industrielle importante pour la production d’acétone. Avant la coproduction à grande échelle d’acétone dans les procédés de fabrication du phénol, elle constituait la principale méthode commerciale de synthèse d’acétone.
Ce procédé est endothermique, nécessitant un apport calorifique de 66,5 kJ/mol à 327 °C. Il est réalisé en phase vapeur à des températures de 300 à 500 °C et sous des pressions modérées d’environ 207 kPa, ce qui permet d’obtenir une sélectivité en acétone d’environ 90 % et une conversion en 2-propanol de 98 %.
Les catalyseurs couramment utilisés sont le cuivre, le chrome, le zinc et le nickel, appliqués individuellement, sous forme d’oxydes ou sous forme mixte sur des supports inertes. Une réaction représentative est la suivante :

La sélectivité pour l’acétone est élevée, mais de faibles quantités de sous-produits sont formées par déshydratation, condensation ou oxydation. Parmi ceux-ci figurent le propylène, l’éther diisopropylique, l’oxyde de mésityle, l’acétaldéhyde et le propionaldéhyde.
La réaction peut également se dérouler en phase liquide.
La déshydrogénation de l’alcool isopropylique peut également être réalisée par oxydation à l’aide de catalyseurs à base d’argent ou de cuivre, à des températures comprises entre 400 et 600 °C. Des procédés brevetés décrivent la déshydrogénation oxydative en phase vapeur pour la production de cétones mixtes, notamment l’acétone, la méthylisobutylcétone et les cétones supérieures.
Dans un exemple, la déshydrogénation en phase vapeur d’un mélange azéotropique de 2-propanol et d’eau sur un catalyseur à base de cuivre à 220 °C produit un mélange contenant de l’acétone (52,4 %), du 2-propanol non réagi (11,4 %), de la méthylisobutylcétone (21,6 %), de la diisobutylcétone (6,5 %) et du 4-méthyl-2-pentanol (2,2 %).
2.2. Oxydation de l’alcool isopropylique
L’alcool isopropylique subit une oxydation catalytique avec de l’air ou de l’oxygène à 400–600 °C pour produire de l’acétone et de l’eau :
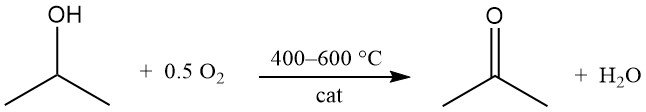
Les catalyseurs sont similaires à ceux utilisés dans les procédés de déshydrogénation. Contrairement à la déshydrogénation, la réaction d’oxydation est fortement exothermique et libère 180 kJ/mol à 295 °C. Un contrôle rigoureux des conditions du procédé est nécessaire pour limiter la formation de sous-produits, notamment issus des voies de déshydratation.
L’oxydation et la déshydrogénation peuvent être réalisées simultanément avec un catalyseur et des conditions opératoires appropriés, bien que l’utilisation industrielle de l’oxydation pour la production d’acétone soit limitée par rapport à la déshydrogénation.
L’oxydation partielle de l’alcool isopropylique peut être réalisée en phase liquide sans catalyseur pour produire du peroxyde d’hydrogène et de l’acétone :
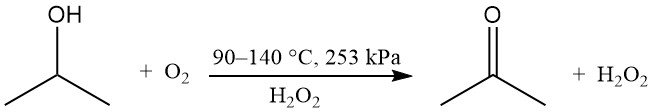
On utilise de l’oxygène ou de l’air avec un initiateur peroxyde, tel que le peroxyde d’hydrogène. La vitesse de réaction est influencée par la concentration de l’acide acétique, sous-produit. Le rapport pondéral théorique entre l’acétone et le peroxyde d’hydrogène est de 1,7. Cette méthode est utilisée lorsque le peroxyde d’hydrogène est le produit souhaité, tandis que l’acétone et l’isopropanol non réagi sont recyclés.
Dans le procédé Shell, le peroxyde d’hydrogène ainsi produit est utilisé pour oxyder l’alcool allylique en acroléine, tandis que dans le procédé Burmah Oil, il est converti en acide peracétique.
Le 2-propanol réagit également avec les aldéhydes ou cétones α,β-insaturés sur des catalyseurs à base d’oxyde métallique à températures élevées. Dans un procédé Shell de production d’alcool allylique, un mélange en phase vapeur d’isopropanol et d’acroléine est passé sur de l’oxyde de magnésium et de l’oxyde de zinc non calcinés à 400 °C pour produire environ 77 % d’alcool allylique basé sur l’acroléine.
2.3. Estérification de l’alcool isopropylique
L’alcool isopropylique est estérifié par des acides carboxyliques en présence de catalyseurs acides tels que l’acide p-toluènesulfonique. La réaction est généralement réalisée à une température de 100 à 160 °C et à pression atmosphérique, en utilisant un excès d’alcool pour favoriser l’équilibre vers la formation d’esters.
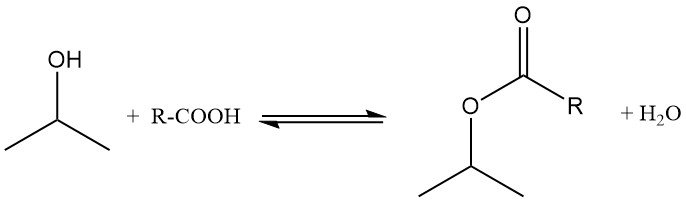
L’eau formée pendant la réaction est éliminée sous forme d’azéotrope afin de modifier l’équilibre. L’excès d’isopropanol est distillé et recyclé, et les productions d’esters atteignent des niveaux quasi quantitatifs. Par exemple, l’acétate d’isopropyle est préparé à partir d’isopropanol et d’acide acétique en présence d’acide sulfurique, le toluène étant utilisé comme agent azéotrope.
Des études cinétiques ont été menées sur l’estérification de l’isopropanol avec divers acides organiques à l’aide de résines échangeuses de cations sulfonées. La réaction avec l’acide myristique produit du myristate d’isopropyle, un émollient et lubrifiant utilisé dans les cosmétiques et les produits pharmaceutiques topiques. Une forme gélifiée de cet ester est commercialisée sous le nom d’Estergel.
L’alcool isopropylique réagit avec le disulfure de carbone pour produire des esters xanthates. L’isopropyl xanthate de sodium est utilisé dans les procédés de flottation des minéraux et comme herbicide dans la culture des haricots et des pois.
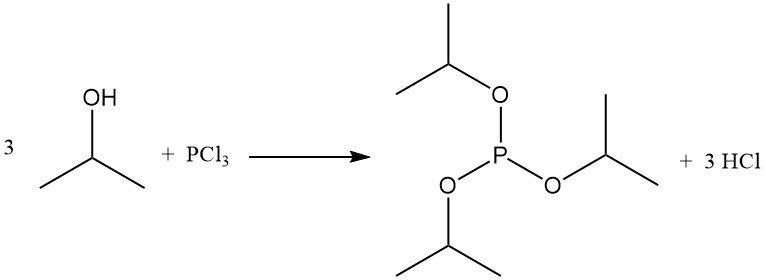
La réaction du 2-propanol avec les halogénures de phosphore forme des esters de phosphite. Le phosphite de triisopropyle est obtenu à partir de trichlorure de phosphore et d’alcool isopropylique à basse température, en présence d’un capteur d’acide tel que la pyridine.
Le tétrachlorure de titane réagit avec l’isopropanol pour produire du tétra(isopropyl)titanate, un catalyseur de polymérisation commercial.
Le nitrate d’isopropyle est préparé par réaction de l’isopropanol avec de l’acide nitrique. Les réactifs sont introduits séparément dans un alambic et le produit est éliminé en continu par distillation.
Le nitrate d’isopropyle est utilisé comme carburant de démarrage et dans les formulations explosives. L’ester nitritique, le nitrite d’isopropyle, est formé à température ambiante à partir d’isopropanol et de chlorure de nitrosyle ou d’acide nitreux et sert de propulseur pour les moteurs à réaction.
2.4. Éthérification de l’alcool isopropylique
L’alcool isopropylique peut être déshydraté en phase liquide sur des catalyseurs acides forts, comme l’acide sulfurique, ou en phase vapeur sur de l’alumine acide pour produire de l’éther diisopropylique (DIPE) ou du propylène.
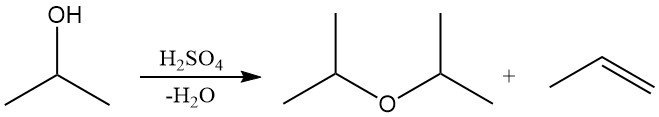
La sélectivité en DIPE ou en propylène dépend du choix du catalyseur et des conditions de réaction. Industriellement, le DIPE est principalement obtenu comme sous-produit de la production d’alcool isopropylique. L’excédent de DIPE est souvent recyclé sur des catalyseurs acides pour régénérer l’alcool isopropylique par hydratation. Le DIPE est utilisé en quantités limitées comme solvant et dans les procédés d’extraction industriels.
La loi américaine sur la qualité de l’air de 1990, qui a rendu obligatoire l’utilisation de composés oxygénés dans l’essence, a créé une demande potentielle de DIPE comme composé oxygéné des carburants. Le DIPE peut être synthétisé par réaction de l’alcool isopropylique avec du propylène sur des catalyseurs d’échange d’ions acides à basse température.
Les éthers de glycol peuvent également être préparés à partir d’alcool isopropylique par réaction avec des oxydes d’oléfines tels que l’oxyde d’éthylène ou l’oxyde de propylène. Par exemple, la réaction avec l’oxyde d’éthylène produit du 2-isopropoxyéthanol (commercialisé sous le nom d’isopropyl Cellosolve), généralement catalysé par des hydroxydes alcalins.
L’alcoxylation secondaire du produit initial avec un oxyde d’oléfine supplémentaire forme des dérivés fortement alcoxylés (oligomères). Cette réaction compétitive est particulièrement importante lorsque l’on utilise de l’oxyde d’éthylène, car le groupe hydroxy primaire terminal produit est plus réactif.
Les éthers de glycol dérivés de l’alcool isopropylique sont utilisés comme solvants dans les laques, les émaux et les revêtements hydrodiluables pour améliorer la brillance, l’écoulement et les propriétés du film.
2.5. Amination de l’alcool isopropylique
L’alcool isopropylique subit une amination par ammonolyse avec des catalyseurs de déshydratation ou par ammonolyse réductrice avec des catalyseurs d’hydrogénation. Les deux méthodes produisent de l’isopropylamine et de la diisopropylamine. La triisopropylamine n’est formée qu’en quantités négligeables.
Le rapport entre mono- et diisopropylamine dépend du rapport molaire alcool isopropylique/ammoniac, qui varie généralement de 2:1 à 5:1.
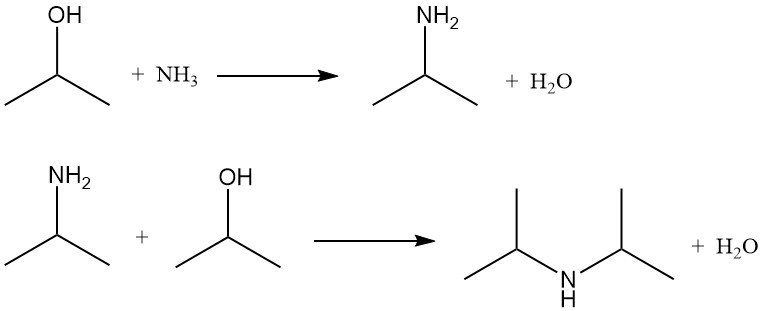
Dans l’ammonolyse réductrice, l’hydrogène est présent pour prolonger la durée de vie du catalyseur en empêchant la cokéfaction et la formation de goudron, mais sa consommation est faible. La réaction est généralement réalisée à 150–250 °C et 790–2860 kPa dans un réacteur à lit fixe, avec des catalyseurs à base de cuivre, de chrome ou de nickel supportés sur alumine.
La conversion de l’alcool isopropylique dépasse 85 %, et les rendements en amines sont supérieurs à 90 %. Les sous-produits tels que les nitriles et les amides sont recyclés pour améliorer le rendement.
L’ammonolyse directe avec des catalyseurs de déshydratation est réalisée à 300–500 °C et à des pressions similaires. Les catalyseurs utilisés comprennent l’alumine, la silice, le dioxyde de titane et le phosphate d’aluminium. Les rendements dépassent 80 %, avec une cokéfaction et une formation de nitrile minimales, mais le contrôle de la composition en amines est limité.
L’isopropylamine est principalement utilisée dans la production d’herbicides, notamment pour la 2-chloro-4-éthyl-6-isopropylamino-s-triazine, et, dans une moindre mesure, dans la fabrication de pesticides. La diisopropylamine est utilisée dans les pesticides et comme inhibiteur de corrosion, comme le nitrate de diisopropylammonium.
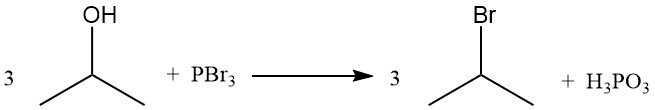
2.6. Halogénation de l’alcool isopropylique
Les dérivés du 2-halopropane peuvent être synthétisés à partir de l’alcool isopropylique par réaction avec l’halogénure d’acide correspondant, ce qui constitue la méthode la plus économique. Les halogénures de phosphore et les halogènes élémentaires peuvent également réagir dans des conditions appropriées pour remplacer le groupe hydroxyle et produire l’halogénure.
L’halogénation en solution aqueuse s’accompagne d’une oxydation. La chloration à 65 °C produit des dérivés de la chloroacétone, principalement la 1,3-dichloroacétone et la 1,1,3-trichloroacétone. Une chloration supplémentaire à 70–100 °C conduit à une conversion presque complète en produits plus chlorés, notamment la 1,1,1,3,3-pentachloroacétone et l’hexachloroacétone.
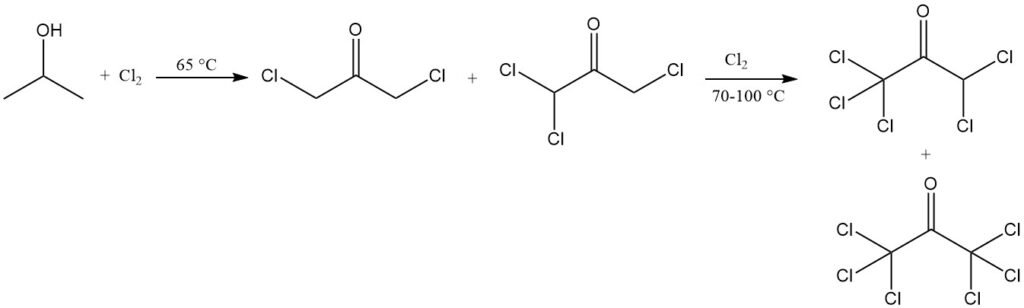
La chloration de l’isopropanol dans des conditions spécifiques peut produire de la 1,1,1,3-tétrachloroacétone, qui peut être convertie en 1,1,1-trichloro-2,3-époxypropane, un intermédiaire pour les produits chimiques agricoles et pharmaceutiques, ainsi que pour les plastiques peu inflammables.
2.7. Réactions diverses de l’isopropanol
L’alcool isopropylique subit une acylation avec le cétène pour produire de l’acétate d’isopropyle :
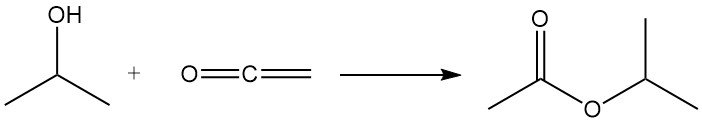
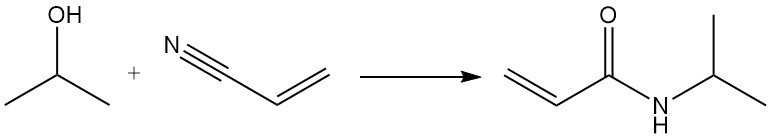
La réaction de Ritter de l’isopropanol avec l’acrylonitrile donne du N-isopropylacrylamide :
L’alcool isopropylique peut également se condenser avec des composés aromatiques tels que le toluène et le phénol pour former des dérivés isopropoxylés utilisés comme intermédiaires dans la synthèse de résines, de tensioactifs et de produits chimiques de spécialité.
3. Production industrielle d’alcool isopropylique
L’alcool isopropylique est produit industriellement par deux procédés principaux : l’hydratation indirecte et l’hydratation directe du propène. De plus petites quantités sont obtenues par hydrogénation de l’acétone.
La production industrielle d’alcool isopropylique a débuté en 1920 à l’usine pétrochimique de Standard Oil (Exxon) à Bayway, dans le New Jersey. En 1921, Union Carbide (Carbide and Carbon Chemicals Corporation) a démarré sa production à Clendenin, en Virginie-Occidentale. Shell Oil Company a démarré ses activités dans les années 1930 à Dominguez, en Californie. Ces sociétés sont restées les principaux producteurs américains jusqu’au milieu des années 1990.
Le procédé d’hydratation indirecte, également appelé procédé à l’acide sulfurique, était historiquement la seule méthode commerciale jusqu’en 1951, année où Imperial Chemical Industries (ICI) a mis en service le premier procédé commercial d’hydratation directe.
Les deux méthodes utilisent du propylène et de l’eau comme matières premières. Le procédé indirect peut traiter les flux de gaz résiduaires C3 des raffineries contenant 40 à 60 % en poids de propylène, ce qui le rend adapté à l’intégration dans les raffineries américaines. La voie d’hydratation directe a été développée pour surmonter les problèmes de corrosion, de forte consommation d’énergie et d’émissions atmosphériques associés à la méthode indirecte ; cependant, elle nécessite du propylène de haute pureté.
D’autres méthodes de synthèse potentielles incluent la fermentation des glucides, l’oxydation du propane et l’hydrolyse de l’acétate d’isopropyle. Parmi celles-ci, l’hydrogénation de l’acétone, sous-produit de la production de phénol, est le seul procédé alternatif d’importance commerciale.
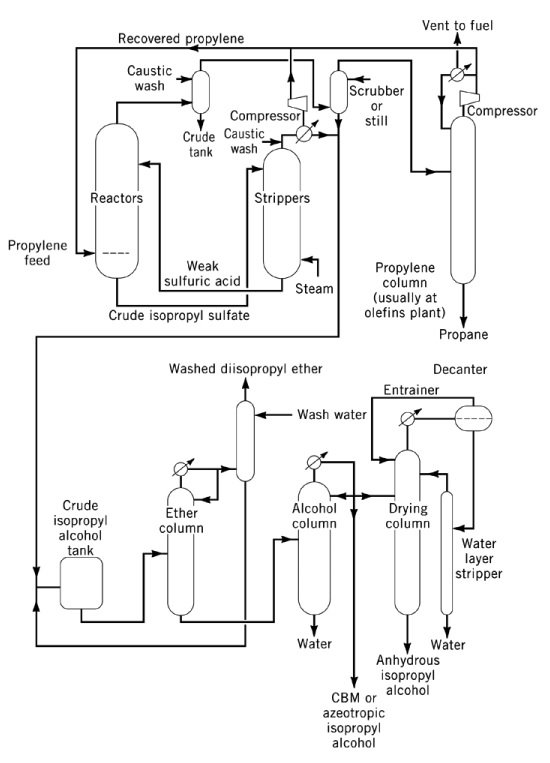
3.1. Production d’alcool isopropylique par hydratation indirecte du propylène
L’hydratation indirecte du propylène en alcool isopropylique est un procédé en deux étapes qui utilise l’acide sulfurique concentré comme catalyseur. Lors de la première étape, l’estérification produit des esters sulfates, principalement de l’hydrogénosulfate d’isopropyle, ainsi que de plus petites quantités de sulfate de diisopropyle. Lors de la deuxième étape, l’hydrolyse de ces esters produit de l’isopropanol et régénère l’acide sulfurique.
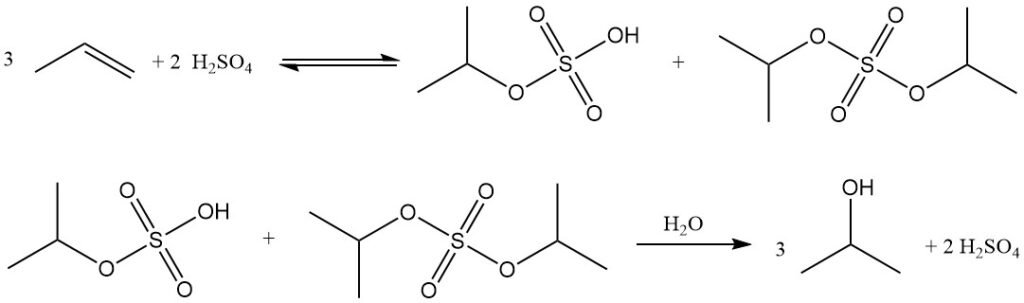
Le principal sous-produit de ce procédé est l’éther diisopropylique (DIPE), formé par la réaction d’esters sulfates intermédiaires avec l’isopropanol. Parmi les autres sous-produits figurent l’acétone (issue de la décomposition thermique des esters sulfates), l’oxyde de mésityle, les oligomères de propylène (dimères, trimères) et des alcools mineurs tels que l’éthanol, le 2-butanol et le n-propanol provenant des impuretés de l’alimentation.
Les composés soufrés associés à des oligomères insaturés peuvent provoquer des odeurs indésirables, qui sont atténuées par des conditions de réaction optimisées et un post-traitement sur des métaux tels que le cuivre ou le nickel.
La réaction est réalisée à une pression de 0,7 à 2,8 MPa et à une température de 20 à 80 °C, avec des concentrations d’acide sulfurique supérieures à 60 % en poids. Deux modes opératoires sont courants :
- Le procédé à l’acide fort est une opération en deux étapes qui utilise > 80 % en poids de H2SO4 à 1–1,2 MPa et 20–30 °C.
- Le procédé à l’acide faible est une opération en une seule étape qui utilise 60–80 % en poids de H2SO4 à environ 2,5 MPa et 60–65 °C.
Les deux procédés atteignent une sélectivité de plus de 98 % en 2-propanol et en DIPE.
L’hydrolysat est épuré pour produire un mélange d’isopropanol, de DIPE et d’eau en tête, avec de l’acide sulfurique dilué en queue. Le DIPE est généralement recyclé dans le réacteur pour hydratation. L’isopropanol humide (87 % en poids, 91 % en volume) est obtenu après distillation, avec une conversion du propylène supérieure à 93 %. La déshydratation finale jusqu’à l’état anhydre est réalisée par distillation azéotropique utilisant du DIPE ou du cyclohexane comme agents d’entraînement.
Le contrôle de la corrosion nécessite des réacteurs en acier pour l’acide concentré à température modérée, et en acier inoxydable, en tantale ou en Hastelloy pour l’acide dilué à température plus élevée. L’alcool isopropylique de haute pureté, ou alcool isopropylique de qualité essence, est produit par post-traitement sur charbon actif, tamis moléculaires ou lits fixes contenant des métaux, suivi d’une distillation finale dans des équipements non ferreux.
L’hydratation indirecte reste la principale voie commerciale aux États-Unis et est également pratiquée par plusieurs producteurs européens et japonais.
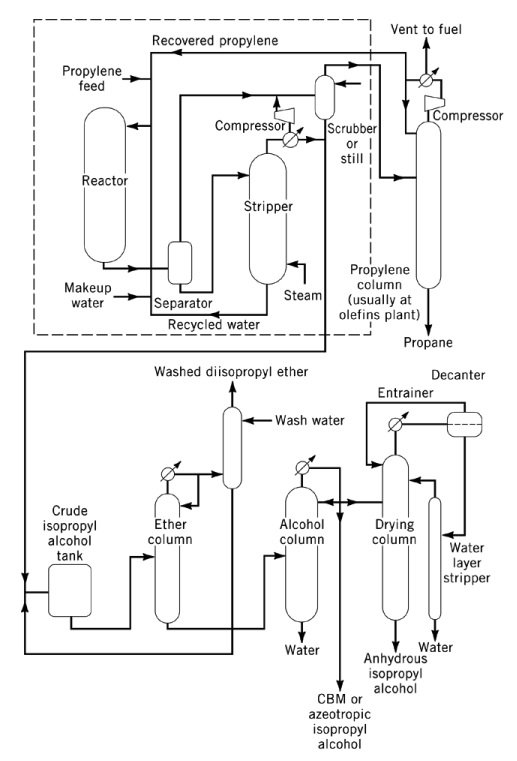
3.2. Production d’alcool isopropylique par hydratation directe du propylène
L’hydratation directe du propylène en 2-propanol est une réaction exothermique, catalysée par un acide, dont la chaleur de réaction est de −50 kJ/mol. D’un point de vue thermodynamique, des pressions élevées et des températures basses favorisent la formation d’alcool isopropylique, bien que la plupart des catalyseurs nécessitent des températures modérées à élevées pour atteindre des rendements commerciaux.
Les procédés commerciaux d’hydratation directe sont classés en trois principaux types : l’hydratation en phase vapeur, l’hydratation mixte vapeur-liquide et l’hydratation en phase liquide.
Dans les procédés en phase vapeur, tels que les procédés Veba-Chemie et ICI, le propylène et la vapeur d’eau passent sur un catalyseur acide à lit fixe. Le procédé Veba-Chemie utilise de l’acide phosphorique sur support silice à 240–260 °C et 2,5–6,6 MPa pour atteindre une sélectivité de 96 % avec une conversion de 5–6 % par passe.
Le procédé ICI utilise un catalyseur oxyde de tungstène–oxyde de zinc sur silice à 230–290 °C et 20,3–25,3 MPa. Dans les deux cas, la température élevée et la faible pression de conversion nécessitent un recyclage important du propylène. Les exigences de pureté de la matière première sont généralement d’environ 99 % en poids.
L’hydratation en phase mixte vapeur–liquide, développée par Deutsche Texaco AG, est réalisée dans un réacteur à lit fluidisé utilisant un catalyseur à base de résine échangeuse de cations acide sulfonique. La réaction se déroule à 130–160 °C et 8–10 MPa, avec un rapport molaire propylène/eau de 1:12–15.
Ce procédé atteint une conversion de plus de 75 % par passe et une sélectivité de 93 % lorsque la pureté de la matière première est d’au moins 92 % en poids. Les sous-produits formés au cours de la réaction comprennent environ 5 % d’éther diisopropylique (DIPE) et de faibles quantités d’alcools oligomères supérieurs. La durée de vie du catalyseur dépasse huit mois en fonctionnement normal.
L’hydratation en phase liquide, développée par Tokuyama Soda, utilise un catalyseur aqueux faiblement acide à base de silicotungstate à 270 °C et 20,3 MPa. Le procédé permet une conversion de 60 à 70 % par passe et une sélectivité de 98 à 99 % en moles.
Le catalyseur est recyclé avec des pertes minimales, et le procédé présente une faible corrosion et des émissions négligeables. La pureté de la matière première est de 95 % en poids ou plus. L’isopropanol brut, obtenu par distillation azéotropique, contient 88 % en poids d’isopropanol et est ensuite purifié à plus de 99,99 % de pureté.
Les catalyseurs utilisés en hydratation directe sont des acides forts capables de protoner le propylène pour former un carbocation secondaire. Parmi ces catalyseurs, on peut citer l’acide phosphorique supporté, l’oxyde de tungstène, l’acide molybdophosphorique, l’oxyde de titane, l’oxyde de zinc, l’oxyde de zirconium, les silicotungstates, l’oxalate de molybdène et diverses zéolites.
Les résines échangeuses d’ions fortement acides sont privilégiées pour les opérations à température modérée. Il a été démontré que certains anions polyacides, tels que le phosphomolybdate et le phosphotungstate, améliorent les taux d’hydratation par rapport au sulfate ou au phosphate, probablement en raison d’effets d’association ionique spécifiques avec le carbocation.
Le mécanisme réactionnel implique la protonation du propylène pour générer un ion carbonium secondaire, suivie d’une attaque nucléophile par l’eau pour produire de l’alcool isopropylique protoné, qui se déprotone ensuite pour former l’alcool neutre. La vitesse de réaction est proportionnelle à la concentration en ions hydronium et indépendante du contre-anion, bien que les anions polyacides puissent l’accélérer.
D’un point de vue thermodynamique, la constante d’équilibre en phase vapeur est donnée par log K = 2624/T – 7,584, et en phase liquide, l’énergie libre standard est ΔF° = 23,25T – 9352 (où T est en K).
Les basses températures réduisent la formation de DIPE, mais l’activité du catalyseur fixe une limite inférieure pratique. Les pressions élevées augmentent la concentration en alcool et réduisent le besoin de recyclage important du propylène.
3.3. Production d’alcool isopropylique par hydrogénation de l’acétone
L’hydrogénation de l’acétone est utilisée aux États-Unis, en Russie, en Asie et en Amérique du Sud. Ce procédé peut être réalisé en phase liquide sur un catalyseur au nickel de Raney à lit fixe et permet d’atteindre une sélectivité et une conversion de l’acétone de 99,9 %.
L’hydrogénation sur un catalyseur à base d’oxyde de cuivre et d’oxyde de chrome à 120 °C et 196 kPa permet d’obtenir des sélectivités inférieures d’environ 98 % et des conversions d’environ 94 %. Ce procédé ne nécessite pas d’acétone de haute pureté, ce qui le rend particulièrement avantageux dans les installations où un excès d’acétone est généré comme sous-produit, comme dans le procédé cumène-phénol.
4. Applications de l’alcool isopropylique
L’alcool isopropylique (2-propanol) est principalement utilisé comme solvant industriel, intermédiaire chimique et antiseptique.
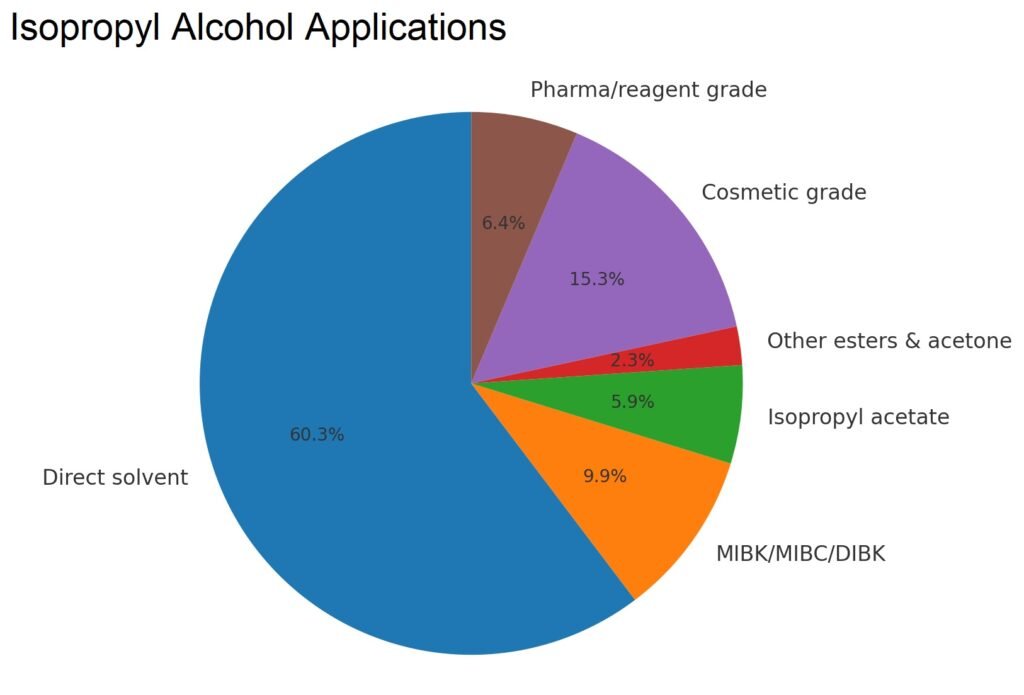
4.1. Utilisations de l’alcool isopropylique dans l’industrie chimique
Les principaux dérivés chimiques de l’isopropanol sont la méthylisobutylcétone (MIBK), le méthylisobutylcarbinol (MIBC), la diisobutylcétone (DIBK) et l’acétate d’isopropyle. Le 2-propanol est également une matière première pour la production d’isopropylamines, utilisées dans la fabrication d’herbicides et de pesticides. Une partie de la diisopropylamine est utilisée dans la synthèse du nitrate de diisopropylammonium, un inhibiteur de corrosion.
L’utilisation de l’alcool isopropylique pour la production d’acétone a considérablement diminué en raison de la prévalence du processus d’oxydation du cumène.
4.2. Utilisations de l’alcool isopropylique comme solvant
En tant que solvant, l’alcool isopropylique présente des propriétés équilibrées entre l’alcool, l’eau et les hydrocarbures, ce qui le rend efficace pour dissoudre les huiles, les gommes, les cires, les résines et les alcaloïdes. Il est utilisé dans la formulation de ciments, d’apprêts, de vernis, de peintures, d’encres d’impression, de revêtements et dans les procédés d’extraction.
Dans les cosmétiques et les produits de soins personnels, il est utilisé comme solvant pour les lotions, les parfums, les shampoings, les nettoyants pour la peau, les vernis à ongles, les démaquillants, les déodorants et les huiles corporelles, avec ajout de parfum pour masquer son odeur.
Les formulations aérosols contenant de l’alcool isopropylique comprennent les laques capillaires, les produits de nettoyage, les insecticides, les dégivreurs automobiles, les assainisseurs d’air, les désinfectants et divers sprays ménagers et industriels.
4.3. Usage médical de l’alcool isopropylique
Dans le secteur pharmaceutique, l’alcool isopropylique est utilisé comme solvant de traitement et comme antiseptique et désinfectant actif à domicile, en milieu hospitalier et industriel. Il est plus efficace que l’éthanol pour la lutte microbienne et est largement utilisé en solutions aqueuses à 70 % comme alcool à friction.
On le trouve également dans les liniments médicinaux, les teintures, les toniques pour le cuir chevelu, les bains de suture chirurgicale et les solutions de pansement, ainsi que dans des formulations telles que la teinture d’iode et le savon vert.
4.4. Autres utilisations
L’alcool isopropylique de haute pureté (99,99 %) est utilisé dans l’industrie électronique pour le nettoyage des dispositifs d’intégration à grande échelle (LSI) et des plaquettes de silicium. Parmi ses autres applications, on peut citer son utilisation comme additif antigivrage pour carburateurs et comme cosolvant avec le méthanol dans les mélanges d’essence.
Dans les procédés d’extraction, des solutions aqueuses d’alcool isopropylique sont utilisées pour l’extraction liquide-liquide d’acides gras à partir d’huiles végétales à basse température.
Les données de consommation aux États-Unis présentées dans le tableau 3 montrent les principales utilisations de l’isopropanol dans les solvants, les revêtements, les dérivés chimiques, les cosmétiques, les produits pharmaceutiques et les applications spécialisées. Les tendances indiquent une baisse de la production d’acétone et d’isopropylamine, mais une utilisation stable dans les cosmétiques, les produits pharmaceutiques et les solvants haute performance.
| Année | |||
|---|---|---|---|
| 2002 | 2008 | 2014 | |
| Solvant direct | 243 | 269 | 237 |
| Dérivés chimiques | |||
| MIBK/MIBC/DIBK | 71 | 45 | 39 |
| Isopropylamines | 85 | 50 | – |
| Acétate d'isopropyle | 24 | 17 | 23 |
| Autres esters et acétone | 17 | 17 | 9 |
| Qualité cosmétique | 52 | 56 | 60 |
| Qualité pharmaceutique (qualité USP)/réactif | 21 | 25 | 25 |
| Total | 513 | 479 | 393 |
5. Toxicologie de l’alcool isopropylique
L’alcool isopropylique est largement présent dans les produits ménagers et industriels, notamment l’alcool isopropylique, les désinfectants, les nettoyants, les cosmétiques, les produits pharmaceutiques et les solvants. Sa toxicité est supérieure à celle de l’éthanol, environ deux fois supérieure, mais inférieure à celle du méthanol. La principale voie d’exposition est l’ingestion, les cas étant plus rares par inhalation ou exposition cutanée.
L’alcool isopropylique est rapidement absorbé après ingestion, les concentrations plasmatiques maximales étant atteintes en 30 minutes. Il est largement distribué dans l’eau corporelle, avec un volume de distribution de 0,45 à 0,55 L/kg.
Le métabolisme se fait principalement dans le foie par l’alcool déshydrogénase en acétone, acétol, méthylglyoxal, propylène glycol, acétate et formiate, puis converti en glucose et autres produits métaboliques.
L’acétone est le principal métabolite et est présente dans l’haleine dans les 15 minutes suivant l’ingestion. L’élimination se fait principalement par voie rénale, 20 % étant excrétés sous forme inchangée et le reste sous forme d’acétone et de ses métabolites. La demi-vie d’élimination de l’alcool isopropylique est de 2,5 à 8 heures, tandis que celle de l’acétone est plus lente, avec une demi-vie de 7,7 à 27 heures.
Le mécanisme de toxicité est principalement une dépression du tronc cérébral causée à la fois par l’alcool isopropylique et, dans une moindre mesure, par l’acétone. Les manifestations cliniques vont d’une intoxication légère à une dépression sévère du système nerveux central (SNC) et respiratoire, en passant par un collapsus circulatoire, un choc et le coma. Les premiers symptômes incluent l’ataxie, les vomissements, les douleurs abdominales et l’hématémèse, évoluant dans les cas graves vers une hypotension, une hypothermie et une perte des réflexes.
Contrairement au méthanol et à l’éthylène glycol, l’alcool isopropylique et l’acétone n’entraînent pas d’acidose métabolique à trou anionique élevé, mais produisent une cétonémie, une cétonurie et un trou osmolaire élevé. Une haleine fruitée est caractéristique.
La dose toxique d’alcool isopropylique à 70 % est d’environ 1 mL/kg, et l’ingestion de 100 à 250 mL peut être mortelle. La mort résulte d’une paralysie du système nerveux central. L’inhalation de fortes concentrations de vapeurs peut provoquer des effets anesthésiques et une légère irritation des yeux, du nez et de la gorge.
Les limites d’exposition professionnelle sont fixées par l’OSHA et l’ACGIH à 400 ppm (TWA sur 8 h) et 500 ppm (STEL). Le seuil olfactif varie de 3 à 200 ppm. L’utilisation industrielle dans des conditions normales ne présente pas de risque sanitaire significatif.
Les études animales, notamment l’inhalation subchronique, la neurotoxicité, les tests sur le développement, la reproduction et l’oncogénicité, n’ont pas démontré d’effets indésirables.
Le diagnostic d’intoxication à l’isopropanol repose sur l’historique de l’exposition, les observations cliniques et les résultats de laboratoire montrant un trou osmolaire avec cétose en l’absence d’acidose métabolique. La mesure des concentrations sériques d’alcool isopropylique peut confirmer l’exposition, mais elle n’est pas toujours disponible.
La prise en charge de l’intoxication à l’isopropanol consiste principalement à maintenir les fonctions vitales, notamment la protection des voies respiratoires, la stabilisation cardiovasculaire (pour traiter une hypotension potentielle) et la surveillance de l’équilibre acido-basique et électrolytique du patient. Le charbon actif est inefficace dans ce type d’intoxication et n’est donc pas recommandé.
L’hémodialyse améliore l’élimination de l’alcool isopropylique et de l’acétone, mais elle est généralement réservée aux cas graves, potentiellement mortels, présentant une hypotension profonde, un coma ou des concentrations sériques très élevées. La plupart des patients se rétablissent complètement grâce à des soins de soutien rapides.
Références
- Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
- Logsdon, J.E. and Loke, R.A. (2000). Isopropyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0919151612150719.a01
- Jolliff, H.A. (2017). Isopropyl Alcohol. In: Brent, J., et al. Critical Care Toxicology. Springer, Cham. https://doi.org/10.1007/978-3-319-17900-1_53
- Co, I. N.; Gunnerson, K. J. Chapter 71 – Iatrogenic and Poison-Derived Acid Base Disorders. In Critical Care Nephrology, 3rd ed.; Ronco, C., Bellomo, R., Kellum, J. A., Ricci, Z., Eds.; Elsevier, 2019; pp 417-423.e2. DOI: 10.1016/B978-0-323-44942-7.00071-6
- Gwaltney-Brant, S. M. Chapter 24 – Miscellaneous Indoor Toxicants. In Small Animal Toxicology, 3rd ed.; Peterson, M. E., Talcott, P. A., Eds.; W.B. Saunders, 2013; pp 291-308. DOI: 10.1016/B978-1-4557-0717-1.00024-7
- Slaughter, R. J., Mason, R. W., Beasley, D. M. G., Vale, J. A., & Schep, L. J. (2014). Isopropanol poisoning. Clinical Toxicology, 52(5), 470–478. https://doi.org/10.3109/15563650.2014.914527
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical Agents and Related Occupations. Lyon (FR): International Agency for Research on Cancer; 2012. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100F.) ISOPROPYL ALCOHOL MANUFACTURE BY THE STRONG-ACID PROCESS. Available from: https://www.ncbi.nlm.nih.gov/books/NBK304434/
- Carls, R.-R.; Osterburg, G.; Prezelj, M.; Webers, W. « Process for the production of isopropyl alcohol. » U.S. Patent 4,760,203, 1988. Available from: https://patents.google.com/patent/US4760203A/en
- Hirata, S.; Ogawa, S. « Process for producing isopropyl alcohol. » U.S. Patent 5,763,693, 1998. Available from: https://patents.google.com/patent/US5763693A/en
- Gershbein, L. L.; Pines, H.; Ipatieff, V. N. « Reactions of Isopropyl Alcohol in the Presence of Catalysts Containing Magnesium Oxide. » J. Am. Chem. Soc., 1947, 69 (11), 2888–2893. DOI: 10.1021/ja01203a074
