Acide méthacrylique : propriétés, production et utilisations
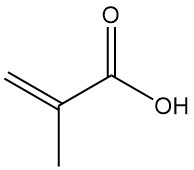
L’acide méthacrylique, également connu sous le nom d’acide α-méthylacrylique ou acide 2-méthylpropénoïque, est un acide organique de formule CH2=C(CH3)COOH. C’est un liquide incolore, modérément volatil et corrosif avec une odeur fortement âcre.
L’acide méthacrylique a été produit pour la première fois en 1865 à partir de méthacrylate d’éthyle, préparé par déshydratation de l’α-hydroxyisobutyrate d’éthyle.
Table des matières
1. Histoire de l’acide méthacrylique et des méthacrylates
L’exploration scientifique des acrylates et méthacrylates pour des applications commerciales a commencé avec la thèse de doctorat d’OTTO ROEHΜ en 1901. Il a étudié les produits de polymérisation des dérivés de l’acide acrylique et envisagé leur utilisation industrielle potentielle.
Roehml a signalé la synthèse de matériaux transparents et caoutchouteux, mais il manquait à l’époque des méthodes de production efficaces. En 1907, il s’associe à OTTO HAAS pour créer une entreprise axée sur les enzymes de traitement du cuir.
Des progrès significatifs dans la production commerciale d’acrylates et de méthacrylates ont eu lieu dans les années 1920. Après la Première Guerre mondiale, Roehml a développé un procédé de production d’acrylate à grande échelle utilisant de l’éthylène cyanhydrine, un intermédiaire dérivé de la chlorhydrine d’éthylène.
Plus tard, il a collaboré avec Walter Bauer pour établir un procédé similaire pour le méthacrylate de méthyle utilisant de l’acétone cyanhydrine. En 1931, Bauer avait réussi à produire un polymère de méthacrylate de méthyle clair et transparent qui se ramollissait au-dessus de 100 °C.
Les années 1930 ont été marquées par des recherches intensives sur la fabrication de tôles coulées à partir de méthacrylate de méthyle par Rohm et Haas et Du Pont (États-Unis), Rohm et Haas AG (Allemagne) et ICI (Angleterre).
La première production commerciale de monomère de méthacrylate de méthyle a commencé à Darmstadt, en Allemagne (1933), via la voie du cyanhydrine d’acetone, qui impliquait la conversion de la cyanhydrine en α-hydroxyisobutyrate d’éthyle, suivie d’une déshydratation à l’aide de P2O5.
ICI a obtenu un brevet en 1934 pour une méthode alternative qui transformait l’acétone cyanhydrine en sulfate de méthacrylamide à l’aide d’acide sulfurique concentré. L’acide méthacrylique, obtenu en hydrolysant le sulfate de méthacrylamide, pourrait ensuite être estérifié pour former du méthacrylate de méthyle.
Reconnaissant l’efficacité du procédé ICI, Rohm and Haas AG a conclu un accord de licence croisée pour la production de feuilles acryliques coulées. Par la suite, ICI et Rohm and Haas AG ont lancé la production commerciale de méthacrylate de méthyle en utilisant la voie du sulfate de méthacrylamide en 1937.
Rohm and Haas aux États-Unis, alors société indépendante depuis 1917, a continué à utiliser le procédé original pendant plusieurs années en raison de limitations de licence.
La voie du sulfate de méthacrylamide est restée le principal procédé commercial pour la production de méthacrylate de méthyle et d’acide méthacrylique jusqu’à l’introduction des procédés d’oxydation de l’isobutène en 1983. Ces procédés ont été développés indépendamment au Japon par Japan Catalytic Chemical et Mitsubishi Rayon.
Bien qu’une capacité supplémentaire d’acide méthacrylique à base d’isobutène soit prévue au Japon et qu’une nouvelle usine à base d’éthylène soit en construction par BASF, la voie du cyanhydrine d’acetone est toujours utilisée pour une partie importante de la demande mondiale de méthacrylate de méthyle.
Les opérations à base d’acétone-cyanhydrine produisent principalement du méthacrylate de méthyle, le dérivé de méthacrylate le plus important. L’acide méthacrylique produit par d’autres voies est également utilisé comme intermédiaire pour la synthèse du méthacrylate de méthyle.
De plus petites quantités d’autres méthacrylates, notamment le méthacrylate d’éthyle, le méthacrylate de n-butyle, le méthacrylate d’isobutyle et ses homologues supérieurs comme le méthacrylate de lauryle et le méthacrylate de stéaryle, sont fabriquées par estérification directe de l’acide méthacrylique ou transestérification du méthacrylate de méthyle.
De plus, des monomères spéciaux tels que le méthacrylate de 2-hydroxyéthyle, le méthacrylate de 2-hydroxypropyle, les méthacrylates d’aminoalkyle (par exemple, le méthacrylate de 2-diméthylaminoéthyle) et le méthacrylamide sont disponibles dans le commerce. Le sulfate de méthacrylamide intermédiaire est le précurseur de la production de méthacrylamide.
2. Propriétés physiques de l’acide méthacrylique
L’acide méthacrylique est un acide organique faible avec un pKa de 4,65. C’est un liquide clair et incolore ou des cristaux incolores avec une odeur âcre et repoussante. Il est soluble dans le chloroforme et miscible à l’eau, éthanol et éther.
Les propriétés physiques les plus importantes de l’acide méthacrylique sont répertoriées dans le Tableau 1.
| Propriété | Valeur |
|---|---|
| Poids moléculaire | 86,09 g/mol |
| Point de fusion, °C | 15,8 |
| Point d'ébullition (101,3 kPa), °C | 162 |
| Densité, g/cm3 | 1.015 |
| Indice de réfraction | 1.4288 |
| Pression de vapeur, kPa |
à 20 °C : 0,09 à 60 °C : 1,33 |
| Viscosité (24 °C), mPa·s | 1.38 |
| Solubilité dans l'eau | Miscible |
| Température critique, °C | 370 |
| Pression critique, Pa | 4,70 |
| Volume critique, cm3/mol | 270 |
| Chaleur de vaporisation (101,3 kPa), kJ/mol | 0,418 |
| Capacité thermique spécifique, J g-1 K-1 | 2.1 |
| Point d'éclair, °C |
Coupe ouverte : 77 Coupe fermée : 67 |
| Température d'auto-inflammation, °C | 400 |
3. Réactions chimiques de l’acide méthacrylique
L’acide méthacrylique est très réactif, présentant des réactions typiques à la fois de l’alcène et de l’acide carboxylique.
L’effet attracteur d’électrons de l’acide carboxylique polarise la double liaison et améliore sa réactivité, mais cette réactivité est moins prononcée que dans l’acide acrylique en raison du groupe méthyle donneur d’électrons.
En conséquence, les ajouts nucléophiles de Michael et de type Michael à la double liaison n’ont lieu qu’avec des réactifs riches en électrons.
3.1. Addition à la double liaison carbone-carbone
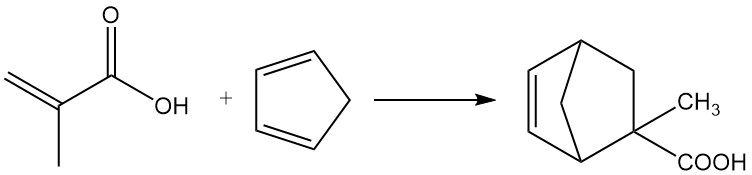
L’acide méthacrylique réagit avec le cyanure d’hydrogène, les halogénures d’hydrogène, le sulfure d’hydrogène, les mercaptans, les alkylamines, les alcools, les phénols ou les phosphines pour produire des propionates d’α-méthyle β-substitués.
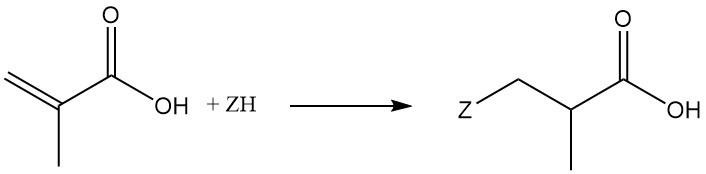
3.2. Réactions Diels-Alder
L’acide méthacrylique subit des réactions de Diels-Alder avec des diènes tels que le butadiène et le cyclopentadiène.
3.3. Réactions de la fonction acide carboxylique
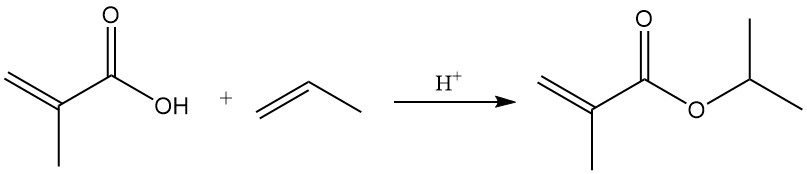
Les esters de l’acide méthacrylique sont formés par réactions avec des alcools en présence de quantités catalytiques d’acides sulfurique ou sulfonique. L’addition d’oléfines catalysée par un acide produit également des esters.
La réaction du groupe acide méthacrylique avec des époxydes en présence de catalyseurs tels que des résines échangeuses d’anions, du chlorure ferrique ou des sels de lithium donne des méthacrylates d’hydroxyéthyle et d’hydroxypropyle.
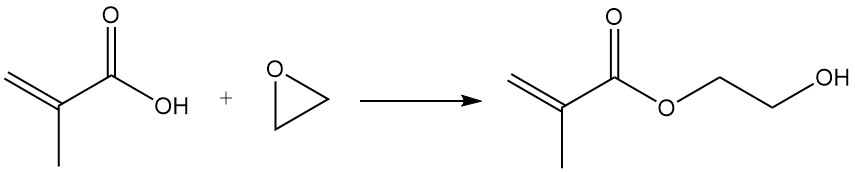
Le chlorure de méthacryloyle est synthétisé par la réaction de l’acide méthacrylique avec le chlorure de thionyle ou le trichlorure de phosphore.
L’acide méthacrylique réagit avec l’anhydride acétique pour produire de l’anhydride méthacrylique.
3.4. Polymérisation
Les polymères d’acide méthacrylique et de ses dérivés se forment facilement lors du chauffage en présence d’initiateurs de radicaux libres comme les peroxydes, la lumière UV ou les rayonnements ionisants.
Les inhibiteurs phénoliques courants ciblent les radicaux peroxy et n’inhibent pas le processus de polymérisation initié. Cependant, l’exclusion de l’oxygène est essentielle pendant la polymérisation pour empêcher la conversion des radicaux alkyles en radicaux hydroperoxy.
4. Production industrielle d’acide méthacrylique
Cette section se concentre sur les méthodes commercialement viables pour produire de l’acide méthacrylique. Différentes matières premières sont utilisées pour ces procédés, classées selon la longueur de leur chaîne carbonée : éthylène (voie C2), propène ou acétone (voie C3) et isobutène (voie C4).
La faisabilité économique de chaque procédé dépend de la disponibilité régionale et du prix des matières premières. À l’heure actuelle, aucune alternative ne surpasse la voie établie de l’acétone et de la cyanhydrine en termes économiques, ce qui justifie la poursuite de l’exploitation des usines existantes à base de cyanhydrine.
4.1. Production d’acide méthacrylique par voie acétone cyanhydrine
La méthode la plus courante de synthèse de l’acide méthacrylique implique l’hydrolyse du sulfate de méthacrylamide, dérivé de l’acétone cyanhydrine.
L’acétone cyanhydrine est formée en faisant réagir de l’acétone sèche avec du cyanure d’hydrogène en présence d’un catalyseur basique. Cet intermédiaire réagit ensuite avec un excès d’acide sulfurique concentré pour donner du sulfate de méthacrylamide.
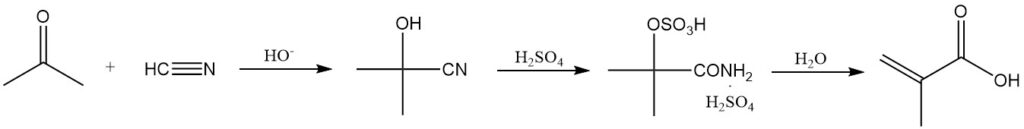
L’acide sulfurique remplit une double fonction : comme réactif et comme solvant de réaction. Une quantité insuffisante d’acide sulfurique entraîne un mélange réactionnel difficile à manipuler. L’acide et l’acétone cyanhydrine doivent être anhydres pour minimiser la formation de sous-produits.
La réaction initiale, réalisée dans une série de réacteurs à cuve agitée, nécessite un bon transfert de chaleur pour gérer le processus exothermique. Un mélange minutieux est crucial pour empêcher la décomposition de la cyanhydrine en ses matières premières, qui peuvent former des sous-produits indésirables.
Après la réaction initiale (80 à 110 °C), le mélange subit un bref craquage thermique (125 à 160 °C) pour convertir la majeure partie du sous-produit a-hydroxyisobutyramide en sulfate de méthacrylamide souhaité, ainsi qu’un peu d’acétone, de monoxyde de carbone et d’eau.
La deuxième étape consiste soit à hydrolyser le flux de sulfate de méthacrylamide avec un excès d’eau pour produire de l’acide méthacrylique et du bisulfate d’ammonium, soit à le traiter avec du méthanol aqueux dans une étape combinée d’hydrolyse-estérification pour produire un mélange de méthacrylate de méthyle et d’acide méthacrylique.
Le rendement global basé sur l’acétone cyanhydrine se situe généralement entre 80 et 90 %.
Pour la production d’acide méthacrylique, l’hydrolyse donne lieu à un mélange en deux phases qui permet une purification séparée de l’acide méthacrylique de la couche organique supérieure et une dilution de l’acide méthacrylique aqueux de la couche inférieure par distillation et extraction à la vapeur, respectivement.
Le désir d’éliminer la régénération de l’acide sulfurique et les dangers associés au transport du cyanure d’hydrogène sont des facteurs clés pour explorer des méthodes de production alternatives.
Cependant, la voie établie de l’acétone et de la cyanhydrine bénéficie de l’avantage économique de l’utilisation de l’acétone (un sous-produit de la production de phénol) et du cyanure d’hydrogène (un sous-produit de la production d’acrylonitrile) comme matières premières.
4.2. Production d’acide méthacrylique à partir d’isobutène
Ces dernières années, des sociétés comme Nihon Methacryl Monomer (une coentreprise Sumitomo et Nippon Shokubai) et Mitsubishi Rayon ont développé un procédé d’oxydation catalytique en deux étapes pour produire de l’acide méthacrylique à partir d’isobutène ou de tert-butanol.
Le processus implique l’oxydation de l’isobutène en méthacroléine, qui est ensuite oxydée en acide méthacrylique.
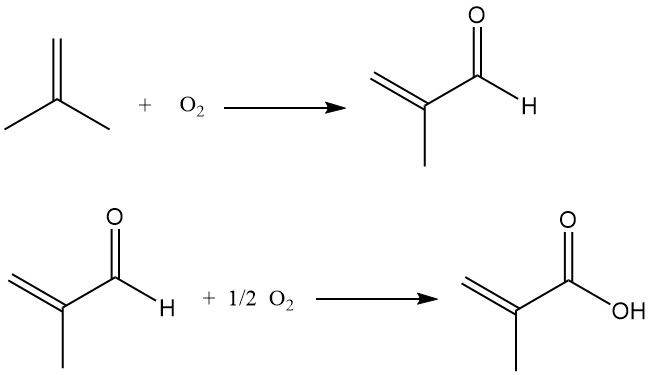
Les rapports publiés comparent ce procédé de production d’acide méthacrylique à partir d’isobutène avec un procédé similaire de production d’acide acrylique à partir de propène. Le principal défi réside dans le maintien d’une sélectivité élevée du catalyseur pendant la deuxième étape d’oxydation, qui fonctionne généralement mieux à des taux de conversion modérés (65 à 85 %).
Le procédé Sumitomo-Nippon Shokubai (Figure 1) surmonte ce défi en faisant fonctionner le réacteur du premier étage à haute conversion et en alimentant directement son effluent dans le deuxième réacteur d’oxydation. La deuxième étape fonctionne à un taux de conversion inférieur pour optimiser la sélectivité et la durée de vie du catalyseur.
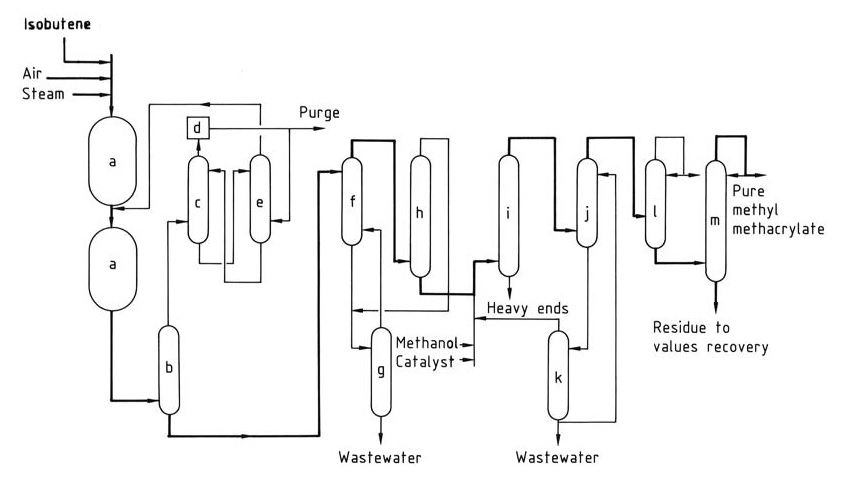
a) Réacteurs d'oxydation ; b) Extincteur ; c) Absorbeur ; d) Unité de combustion ; e) Tour de récupération de méthacroléine ; f) Unité d'extraction de solvant ; g) Tour de décapage des solvants ; h) Tour de récupération/déshydratation des solvants ; i) Réacteur d'estérification ; j) Extracteur ; k) Unité de distillation ; l) Dénudeur d'extrémités légères ; m) Colonne de distillation du produit.
La méthacroléine n’ayant pas réagi provenant de la deuxième étape est ensuite séparée et recyclée, ce qui permet d’obtenir un rendement global en acide méthacrylique à partir de l’isobutène d’environ 65 à 70 %.
Les catalyseurs de la première oxydation sont généralement des oxydes métalliques à plusieurs composants contenant du bismuth, du molybdène et d’autres métaux pour améliorer l’activité et contrôler la sélectivité. Pour la deuxième oxydation, des catalyseurs à base d’acide phosphomolybdique sont utilisés. Des éléments supplémentaires comme le cuivre et le vanadium peuvent également être présents.
L’effluent du réacteur d’oxydation de la deuxième étape est trempé (b) pour obtenir de l’acide méthacrylique aqueux brut. Le flux gazeux restant passe à travers un absorbeur (c), où la méthacroléine n’ayant pas réagi est absorbée (généralement en utilisant de l’acide carboxylique aqueux).
Les gaz dégagés par l’absorbeur sont incinérés (d) avant d’être rejetés. Une partie des gaz incinérés peut être recyclée vers la première étape comme diluant inerte. L’absorbant chargé de méthacroléine est transféré vers une tour de récupération (e) pour être recyclé vers le réacteur de deuxième étage. La solution absorbante récupérée est renvoyée vers l’absorbeur.
L’acide méthacrylique brut subit une extraction par solvant (f) suivie d’une déshydratation dans une tour de récupération/déshydratation de solvant (h) pour donner de l’acide méthacrylique brut comme produit de fond.
Le solvant organique recyclé est renvoyé à l’étape d’extraction, tandis que le produit de tête aqueux est combiné avec le raffinat de l’extracteur et envoyé pour extraction du solvant (g) avant le traitement des eaux usées.
L’acide méthacrylique brut et sec peut être soit purifié davantage, soit directement envoyé dans un réacteur d’estérification (i) avec du méthanol et un catalyseur pour être converti en méthacrylate de méthyle.
Plusieurs entreprises, dont Nippon Shokubai, Mitsubishi Rayon, Mitsui Toatsu, Kyowa Gas, Nippon Kayaku, Rohm and Haas et Oxirane, ont investi dans la recherche, le développement et la commercialisation de ce procédé.
4.3. Production d’acide méthacrylique à partir d’acide isobutyrique
Une méthode alternative pour la production d’acide méthacrylique est la carbonylation catalysée par un acide du propène en acide isobutyrique, suivie d’une déshydrogénation oxydative. Contrairement au procédé à l’acétone et à la cyanhydrine, ce procédé utilise le propène comme matière première.
Bien qu’il ne soit pas encore opérationnel commercialement, plusieurs grands producteurs de méthacrylate de méthyle recherchent activement son potentiel de commercialisation.
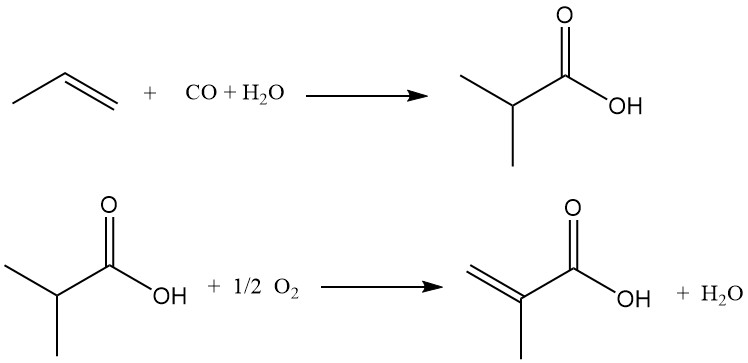
La première étape consiste à faire réagir le propène, le monoxyde de carbone et l’eau en présence d’un catalyseur acide fort (acide sulfurique, fluorure d’hydrogène ou fluorure de bore) pour produire de l’acide isobutyrique. L’ajout contrôlé d’eau pendant la carbonylation permet la synthèse directe de l’acide isobutyrique.
Le fluorure d’hydrogène peut agir à la fois comme solvant et comme catalyseur dans ce processus. La réaction s’est déroulée de 30 °C à 20 MPa à 120 °C à 14 MPa, avec un léger déficit en eau par rapport au propène. Après la réaction, le flux de produit subit une séparation flash par étapes :
- Étape 1 : récupère l’excès de monoxyde de carbone pour le recyclage.
- Étape 2 : élimine les gaz inertes et tout fluorure d’hydrogène ou fluorure d’isopropyle par lavage avec une solution caustique.
La majeure partie du fluorure d’hydrogène est ensuite séparée et recyclée, tous les matériaux contenant du fluor restants dans le flux de fond étant hydrolysés et le fluorure d’hydrogène libéré recyclé.
Une étape finale de distillation purifie l’acide isobutyrique pour l’étape suivante. Des sous-produits issus de multiples condensations du propène avant la carbonylation sont présents dans les fonds de distillation, mais la sélectivité globale du propène serait de 95 à 97 %.
Dans la deuxième étape, l’acide isobutyrique, la vapeur et l’air passent sur un catalyseur à lit fixe dans un réacteur multitubulaire, subissant une déshydrogénation oxydative en acide méthacrylique.
L’effluent du réacteur est trempé pour obtenir un flux aqueux d’acide méthacrylique. Ce produit brut contient des sous-produits comme l’acétone et l’acide acétique, ainsi que du monoxyde de carbone, du dioxyde de carbone et des gaz non condensables qui sont incinérés.
L’acide méthacrylique est isolé par extraction au solvant et déshydratation, suivies d’une distillation. Les acides isobutyrique et acétique sont ensuite séparés sous forme de fractions légères avant la distillation finale de l’acide méthacrylique. La séparation de l’acide isobutyrique de l’acide méthacrylique est un défi en raison des points d’ébullition proches des deux acides.
Deux principaux types de catalyseurs sont utilisés pour la déshydrogénation de l’acide isobutyrique en acide méthacrylique :
- Catalyseurs à oxydes mixtes Mo-P-V développés par Mitsubishi Chemical Industries, R€ohm et d’autres. Ces dérivés de l’acide phosphomolybdique atteignent souvent des conversions de 99,8 % avec des sélectivités supérieures à 74 %.
- Catalyseurs au phosphate de fer d’Ashland Oil. Ces catalyseurs offrent des sélectivités de 84 à 85 % pour des conversions de 85 à 95 %, mais nécessitent un fonctionnement à des températures plus élevées (400 °C) par rapport aux catalyseurs phosphomolybdate.
4.4. Production d’acide méthacrylique à partir d’éthylène
Au-delà des procédés dominants décrits précédemment, d’autres méthodes alternatives existent pour la production d’acide méthacrylique. L’acide méthacrylique peut être préparé par condensation du formaldéhyde avec de l’acide propionique ou par condensation du formaldéhyde avec du propanal pour former de la méthacroléine, qui est ensuite oxydée en acide méthacrylique.
BASF a commercialisé un procédé basé sur la condensation du formaldéhyde avec du propanal, utilisant de l’éthylène, du gaz de synthèse et du formaldéhyde comme matières premières. Leur usine, opérationnelle depuis 1990, a une capacité de production de 40 000 tonnes par an.
Dans le procédé BASF, l’éthylène est hydroformylé en propanal, qui subit une condensation avec le formaldéhyde pour former de la méthacroléine. La méthacroléine est oxydée catalytiquement par l’air en acide méthacrylique.
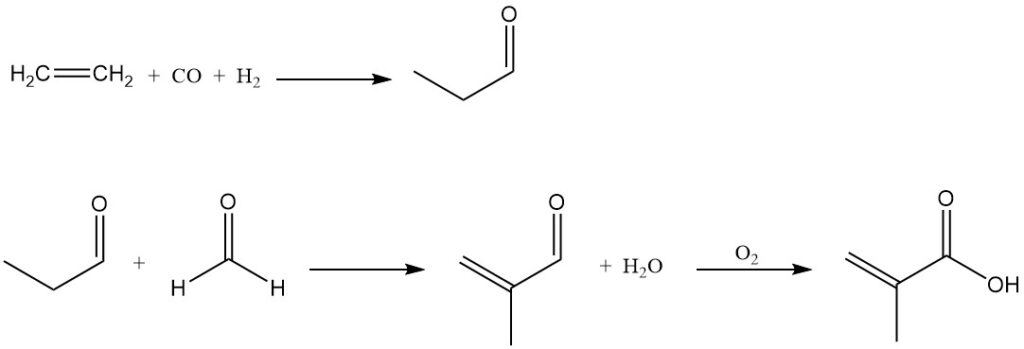
Un procédé alternatif est proposé, impliquant l’oxydation du propanal en acide propionique, suivie de sa condensation avec du formaldéhyde pour produire directement de l’acide méthacrylique.
5. Utilisations de l’acide méthacrylique
L’acide méthacrylique est utilisé pour préparer une large gamme de polymères, notamment les méthacrylates, et pour produire ses esters. Ces polymères fournissent des plastiques résistants et transparents qui sont utilisés sous forme de feuilles dans les vitrages, les panneaux, les affichages et les panneaux d’éclairage.
En moulant des pastilles de polymère, des lentilles d’éclairage automobile et des produits similaires peuvent être préparés.
Les polymères de méthacrylate supérieur sont utilisés dans la fabrication d’additifs pour huiles, d’encres et de revêtements sans solvant et de liants pour la xérographie.
L’acide méthacrylique est utilisé dans les peintures, les adhésifs, les agents de traitement du cuir et comme matière première dans la fabrication de résines échangeuses d’ions.
Les sels de poly(acide méthacrylique) sont utilisés comme additifs dans les détergents et comme épaississants solubles dans l’eau.
6. Toxicologie de l’acide méthacrylique
L’acide méthacrylique est considéré comme légèrement à modérément dangereux sur la base d’études d’exposition orale et cutanée chez le rat et le lapin.
Les muqueuses sont très sensibles à l’acide méthacrylique. L’exposition peut provoquer une irritation allant de légère à corrosive, pouvant entraîner des lésions oculaires permanentes ou la cécité. Une protection oculaire complète est obligatoire lors de la manipulation.
Le contact direct peut provoquer des rougeurs et des irritations cutanées, allant de légères à graves, y compris une corrosion potentielle. L’acide méthacrylique est plus corrosif que ses esters. Des gants et des vêtements de protection sont requis.
La surexposition aux vapeurs d’acide méthacrylique peut irriter le nez et la gorge et provoquer des étourdissements, de la somnolence ou une dépression du système nerveux central.
L’ingestion d’acide méthacrylique peut gravement irriter la bouche, la gorge, l’œsophage et l’estomac, provoquant une gêne, des vomissements, de la diarrhée, des étourdissements et un effondrement potentiel.
Une exposition répétée à la peau peut entraîner une dermatite allergique (éruption cutanée, démangeaisons et gonflement). Les individus peuvent développer une sensibilité après exposition, entraînant des réactions lors d’expositions ultérieures au même monomère acrylique ou à d’autres monomères acryliques.
Des études sur des animaux exposés à des concentrations de vapeur extrêmement élevées d’acide méthacrylique ont montré une inflammation des voies respiratoires et des modifications dégénératives des organes (foie, reins et cœur) à des niveaux dépassant de loin les seuils d’irritation. Aucun effet de ce type n’a été signalé chez l’homme.
Références
- Methacrylic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_441.pub2
- https://www.m-chemical.co.jp/en/products/departments/mcc/mma_pmma/product/1201254_9386.html
- https://www.basf.com/global/documents/en/products-and-industries/acrylic-monomers/technical-information/TI_CP_1574_e_Methacrylic_acid_technical_190419_SCREEN_02.pdf
