Acétylène
L’acétylène, également connu sous le nom d’éthyne, est un gaz incolore et inflammable de formule chimique C2H2. C’est l’hydrocarbure le plus simple avec une triple liaison. Il est largement utilisé comme combustible dans le soudage et le découpage oxyacétylène en raison de sa flamme incroyablement chaude, et comme élément de base chimique pour divers produits chimiques organiques et plastiques.
L’acétylène était le principal élément constitutif de la chimie organique industrielle avant l’adoption généralisée du pétrole comme matière première principale. Le procédé carbure de calcium a dominé exclusivement la production d’acétylène jusque dans les années 1940, lorsque les méthodes de craquage thermique utilisant le méthane et d’autres hydrocarbures ont émergé.
Les premières mises en œuvre utilisaient des arcs électriques, mais les années 1950 ont vu le développement de processus d’oxydation partielle et de régénération.
Malgré des initiatives prometteuses telles que le procédé à flamme immergée de BASF, le HTP de Hoechst et le procédé au plasma de Hüls, la tendance vers l’éthylène en tant que produit chimique fondamental est restée inébranlable.
Tous les procédés à l’acétylène, y compris les méthodes au carbure, sont gourmands en énergie et nécessitent une génération et un transfert de chaleur importants. Ils diffèrent principalement par la manière dont cette énergie est générée et appliquée.
- Pour un article complet sur la production industrielle d’acétylène, visitez le lien suivant.
- Pour des informations détaillées sur les utilisations de l’acétylène, visitez le lien suivant.
Table des matières
1. Propriétés physiques de l’acétylène
L’acétylène possède une triple liaison carbone-carbone (C≡C), caractérisée par une courte longueur (0,1205 nm) et une énergie de formation élevée. Cette configuration rend l’acétylène très instable et réactif en raison de sa nature insaturée.
L’hydrogène acide des liaisons C-H (pKa=25) contribue à la réactivité de l’acétylène. Il est plus acide que l’éthylène (pKa=44) et peut former des acétylures avec des bases fortes.
Dans des conditions standard, l’acétylène est un gaz incolore et non toxique doté de propriétés narcotiques. Légèrement plus léger que l’air, il possède des propriétés physiques distinctes décrites dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Masse moléculaire | 26.0379 |
| Température critique | 308,32 K (35,17 °C) |
| Pression critique | 6,139 MPa |
| Volume critique | 0,113 m3/kmol |
| Triple-point | 192,4 K (−80,75 °C) |
| Pression triple point | 128,3 kPa |
| Point de sublimation normal et point d'ébullition normal | 189,15 K (−84,0 °C) |
| Point de transition cristalline | 133,0 K (−140,15 °C) |
| Enthalpie de transition | 2,54 kJ/mol |
| Densité |
760,2 kg/m3 (131 K) 764,3 kg/m3 (141 K) |
| Densité (C2H2 liquide) | 465,2 kg/m3 (273,15 K) |
| Densité (C2H2 gazeux à 1 bar) | 1,095 kg/m3 (288,15 K) |
| Volume moléculaire (0 °C, 1,013 bar) | 22,223 m3/kmol |
| Enthalpie de vaporisation (calculée) | 10,65 kJ/mol (273,15 K) |
| Enthalpie de sublimation | 21,168 kJ/mol (5,55 K) |
| Enthalpie de formation | 227,5 ± 1,0 kJ/mol (298,15 K) |
| Énergie libre de formation de Gibbs | 209,2 ± 1,0 kJ/mol (298,15 K) |
| Entropie de formation | 200,8 J mol−1 K−1 (298,15 K) |
| Enthalpie de combustion | −1255,6 kJ/mol (298,15 K) |
| Pouvoir calorifique plus élevé | 50 400 kJ/kg |
| Pouvoir calorifique inférieur | 48 700 kJ/kg |
| Pression de vapeur | 2,6633 MPa (273,15 K) |
| Conductivité thermique (0 °C, 1,013 bar) | 0,0184 W m−1 K−1 |
| Capacité thermique (état gaz parfait) | 43,990 J mol−1 K−1 (298,15 K) |
2. Réactions chimiques de l’acétylène
L’acétylène est très réactif envers divers éléments et composés en raison de sa forte insaturation et de son énergie de formation libre positive. Cette caractéristique en fait une matière première polyvalente pour de nombreuses substances. Les principaux types de réactions comprennent les réactions d’addition, les substitutions d’hydrogène, la polymérisation et la cyclisation.
L’acétylène est plus sensible aux attaques nucléophiles que l’éthylène. De plus, sa liaison C-H polarisée (pKa ≈ 25) lui confère des propriétés acides, facilitant la solubilité dans les solvants basiques et la formation de liaisons hydrogène. Ce comportement s’écarte de la loi de Raoult pour les solutions contenant de l’acétylène.
Le développement des réactions sous pression de l’acétylène par W. Reppe a marqué une percée dans la chimie de l’acétylène. Les groupes réactionnels notables comprennent la vinylation, l’éthynylation, la carbonylation et la polymérisation cyclique et linéaire.
2.1. Réactions industriellement importantes
1. Vinylation :
La vinylation implique l’ajout de composés à atomes d’hydrogène mobiles (eau, alcools, thiols, amines, etc.) à l’acétylène, donnant des dérivés vinyliques principalement utilisés pour la polymérisation.
Il existe deux types : l’hétérovinalation (hydrogène à partir de O, S ou N) et la C-vinylation (hydrogène carboné directement lié). Les exemples incluent la dimérisation de l’acétylène, la trimérisation, la synthèse de l’acrylonitrile et l’ajout d’hydrocarbures insaturés réactifs comme le cyclopentadiène.
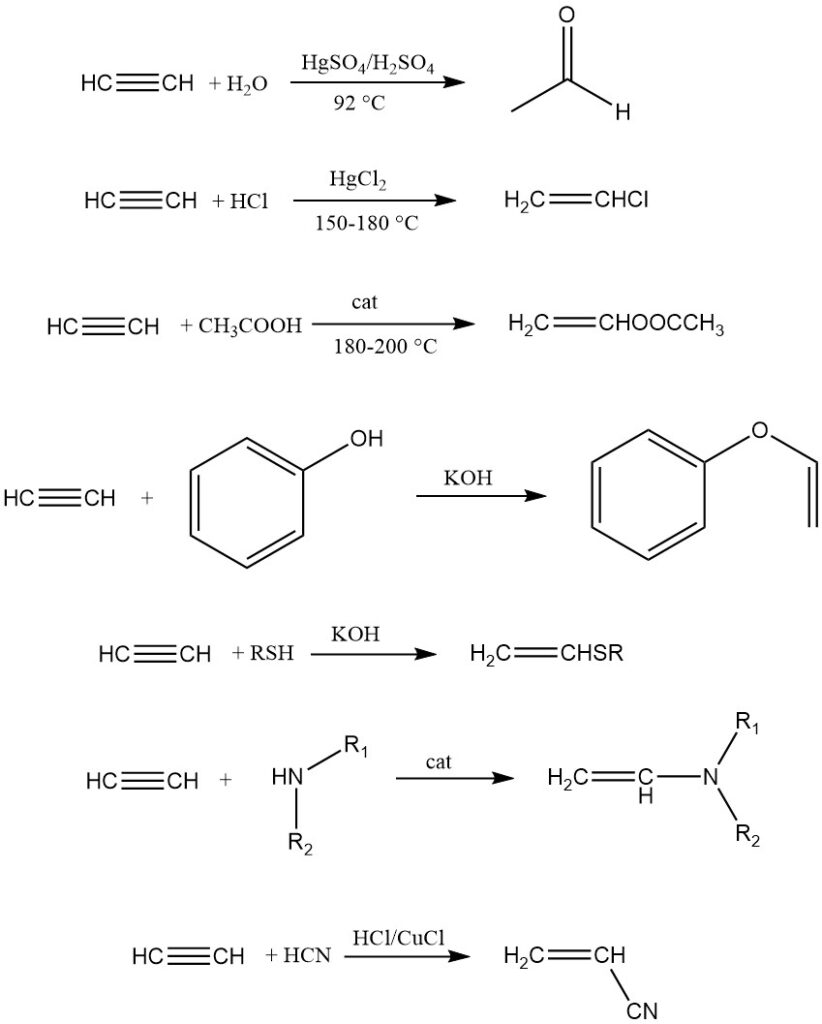
2. Éthynylation :
L’éthynylation ajoute des composés carbonylés à l’acétylène tout en préservant la triple liaison. Reppe a découvert que les acétylures de métaux lourds, en particulier Cu₂C₂·2H₂O·2C₂H₂, catalysent efficacement la réaction avec les aldéhydes.
L’éthynylation des cétones est catalysée avec des catalyseurs alcalins. Le schéma réactionnel général est le suivant :

L’alcool propargylique et le butynediol sont les produits clés de cette réaction.

3. Carbonylation :
La carbonylation implique la réaction de l’acétylène et du monoxyde de carbone avec des composés possédant des atomes d’hydrogène mobiles, catalysée par des métaux carbonyles (par exemple, Ni(CO)₄). Des halogénures métalliques capables de former des carbonyles peuvent également être utilisés.
L’acide acrylique est un produit important obtenu à partir d’acétylène, d’eau et de monoxyde de carbone en utilisant du Ni(CO )₄ catalyseur. Les autres produits de la carbonylation de l’acétylène comprennent les thioesters de l’acide acrylique, les amides acryliques, les anhydrides d’acide carboxylique et l’hydroquinone.

4. Cyclisation et polymérisation :
L’acétylène, sous des catalyseurs appropriés, peut subir une cyclisation et une polymérisation linéaire. Berthelot a observé pour la première fois la cyclisation, donnant un mélange de composés aromatiques comme le benzène et le naphtalène. Reppe a ensuite synthétisé le 1,3,5,7-cyclooctatétraène avec un rendement élevé (70 %).
La polymérisation linéaire se produit avec les sels de cuivre (I), ce qui donne du vinylacétylène, du divinylacétylène, etc. Un exemple notable est le cuprène, formé en chauffant de l’acétylène avec une éponge de cuivre. Les catalyseurs Ziegler-Natta facilitent la formation de polyacétylène, qui présente des propriétés uniques telles que la conductivité lors du dopage.

2.2. Autres réactions et dérivés
1. Acétylures métalliques :
L’acétylène forme des acétylures métalliques en remplaçant ses atomes d’hydrogène par des atomes métalliques (M). Les acétylures alcalins et alcalino-terreux sont préparés via des amides métalliques ou par réaction directe avec des métaux fondus ou finement divisés.

Les acétylures de cuivre explosifs (Cu₂C₂·H₂O) sont formés par réaction de sels de cuivre (I) avec de l’acétylène dans de l’ammoniac liquide ou de sels de cuivre (II) avec de l’acétylène dans une solution basique avec des agents réducteurs comme hydroxylamine.
De plus, les oxydes de cuivre et autres sels de cuivre peuvent facilement se transformer en acétylures. En raison de cette réactivité, la plomberie en cuivre doit être strictement évitée dans les systèmes à acétylène. Il existe d’autres acétylures de métaux explosifs pour l’argent, l’or et le mercure.
2. Halogénation :
Le chlore s’ajoute à l’acétylène avec FeCl₃ comme catalyseur pour produire du 1,1,2,2-tétrachloroéthane, un intermédiaire important dans la production de solvants. Le brome et l’iode peuvent également participer à des réactions d’addition, l’iode s’arrêtant au 1,2-diiodoéthylène.
3. Hydrogénation :
L’acétylène subit une hydrogénation partielle ou complète sur des catalyseurs Pt, Pd ou Ni, ce qui donne de l’éthylène ou de l’éthane.
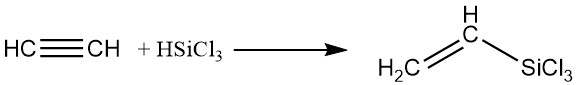
4. Composés de silicium organique :
Des silanes peuvent être ajoutés à l’acétylène à l’aide de catalyseurs au platine en phase liquide, produisant des dérivés contenant du silicium.
5. Oxydation :
L’acétylène résiste à l’oxydation à température ambiante mais forme des mélanges explosifs avec l’air ou l’oxygène. Les agents oxydants comme l’ozone ou l’acide chromique le convertissent en acide formique, en dioxyde de carbone et en d’autres produits. La réaction avec l’ozone dilué donne du glyoxal.
6. Hydrate :
Sous pression et à des températures inférieures à environ 15°C, l’acétylène forme des hydrates cireux de composition C₂H₂.6H₂O. Ces structures de type clathrate incorporent des molécules d’eau dans leur réseau cristallin, ce qui a un impact sur le stockage et la manipulation de l’acétylène. La formation d’hydrates peut provoquer des blocages d’équipements et présenter des risques de décomposition dus aux ondes de choc.
7. Chloroacétylènes :
7.1. Monochloroacétylène (HC≡CCl) :
Le monochloroacétylène est un gaz à l’odeur nauséabonde qui irrite les muqueuses. Il est obtenu en faisant réagir du 1,2-dichloroéthylène avec un NaOH alcoolique en présence de Hg(CN)₂. Il est hautement inflammable et explose facilement en présence même de traces d’oxygène ou d’air et est extrêmement toxique.
7.2. Dichloroacétylène (ClC≡CCl) :
Le dichloroacétylène est une huile incolore avec une odeur désagréable qui explose à l’air ou lorsqu’elle est chauffée. Il est préparé à partir d’acétylène dans une solution d’hypochlorite de potassium fortement alcaline ou en faisant réagir de la vapeur de trichloréthylène avec un alcali caustique. Il est hautement explosif et se décompose facilement, ce qui présente d’importants problèmes de sécurité.
3. Toxicologie de l’acétylène
L’acétylène pur agit comme un simple asphyxiant en déplaçant l’oxygène dans l’atmosphère. Cependant, l’acétylène commercial ne contient plus de quantités significatives d’impuretés toxiques comme l’arsine, le sulfure d’hydrogène et la phosphine, qui contribuaient historiquement aux effets néfastes sur la santé liés à l’exposition à l’acétylène produit à partir de carbure de calcium.
La concentration létale (CL) la plus faible documentée pour les rats est de 9 % en volume dans l’air. Les chiens présentent une plus grande tolérance, nécessitant 80 % d’acétylène pour induire une narcose avec une augmentation de la pression artérielle et une diminution du pouls (indiquant une stimulation vasomotrice et du nerf vague).
Chez l’homme, l’inhalation de 10 % d’acétylène produit une légère intoxication, tandis que 20 % provoque une intoxication importante et 30 % entraîne une incoordination. La perte de conscience survient dans les 5 minutes à une exposition de 35 %.
L’inhalation mortelle implique 35 % pendant 5 à 10 minutes ou 10 % pendant 30 à 60 minutes. Les symptômes d’intoxication comprennent l’excitation, le coma, la cyanose, un pouls faible/irrégulier et une perte de mémoire.
Aucune preuve ne suggère des effets néfastes sur la santé résultant d’une exposition répétée à des niveaux d’acétylène tolérables. Il est intéressant de noter que des études humaines ont révélé une diminution de la sensibilité lors d’expositions répétées.
Alors que 33 % d’acétylène provoquaient initialement une perte de conscience dans les 6 minutes, les expositions ultérieures au cours de la même semaine nécessitaient des durées plus longues (9 minutes pour la deuxième et plus de 33 minutes pour la troisième). pour obtenir le même effet.
Contrairement à certains autres gaz, l’acétylène n’irrite pas les muqueuses. Notamment, aucune valeur limite seuil (TLV) ni concentration maximale admissible (MAK) n’a été établie pour l’acétylène.
L’actuelle Administration de la sécurité et de la santé au travail (OSHA) et l’Institut national pour la sécurité et la santé au travail ( NIOSH) la limite d’exposition admissible (PEL) est de 2 500 ppm (parties par million) dans l’air.
Référence
- Acétylène ; Encyclopédie Ullmann de chimie industrielle. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_097.pub4
