Acilación de compuestos aromáticos
1. Acilación de Friedel-Crafts
La acilación de Friedel-Crafts implica la producción de una cetona aromática mediante la reacción entre un compuesto aromático y un agente acilante, que podría ser un haluro de acilo, un anhídrido de ácido, un ácido o un éster. Esta reacción tiene lugar en presencia de un catalizador ácido.
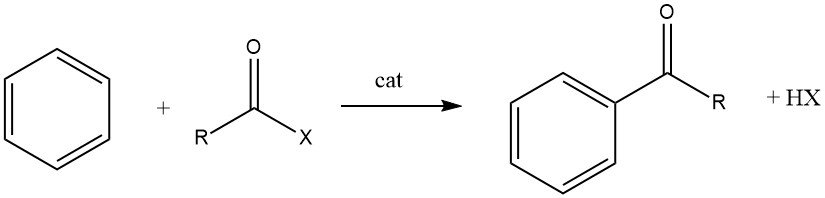
Tabla de contenido
La acilación de sustratos aromáticos tiene una importancia industrial significativa, ya que se utiliza para la síntesis de intermedios aromáticos ampliamente empleados en la fabricación de productos farmacéuticos, insecticidas, plastificantes, tintes, perfumes y otros productos comerciales. Estos compuestos especiales suelen producirse a menor escala en comparación con los productos alquilados.
| Agente acilante | Compuesto aromático | Producto | Uso final |
|---|---|---|---|
| Anhídrido acético | benceno | acetofenona | perfumes, productos farmacéuticos, disolventes, plastificantes |
| Anhídrido acético | tolueno | 4-metilacetofenona | perfumes |
| Anhídrido acético | anisol | 4-metoxiacetofenona | perfumes |
| Anhídrido acético | isobutilbenceno | 4-isobutilactofenona | productos farmacéuticos |
| Cloruro de dicloroacetilo | 1,2-diclorobenceno | α,α,2,4-tetracloroacetofenona | insecticidas |
| Cloruro de clorobutiroilo | fluorobenceno | cloropropil 4-fluorofenilcetona | productos farmacéuticos |
| Tetraclorometano | benceno | benzofenona | productos farmacéuticos, insecticidas, perfumes |
| Cloruro de benzoilo | benceno | benzofenona | |
| Fosgeno | N,N-dimetilanilina | 4,4'-bis-dimetilaminobenzofenona | tintes |
| Anhídrido ftálico | benceno | ácido 2-benzoilbenzoico | antraquinona |
La acilación demuestra una notable versatilidad, dando lugar a diversos productos, incluidos aldehídos aromáticos, alquilarilcetonas, diarilcetonas simétricas y asimétricas, así como productos de ciclación.
Los agentes acilantes generalmente exhiben una mayor reactividad que los agentes alquilantes, lo que permite que las acilaciones se realicen en condiciones relativamente suaves. Los sustratos aromáticos con sustituyentes donadores de electrones, como grupos alquilo, hidroxilo o alcoxi, exhiben una reactividad mejorada.
Por el contrario, los compuestos aromáticos que contienen sustituyentes aceptores de electrones como grupos nitro, acilo, carboxilo o nitrilo son mucho más difíciles de reaccionar, incluso con agentes acilantes altamente activos.
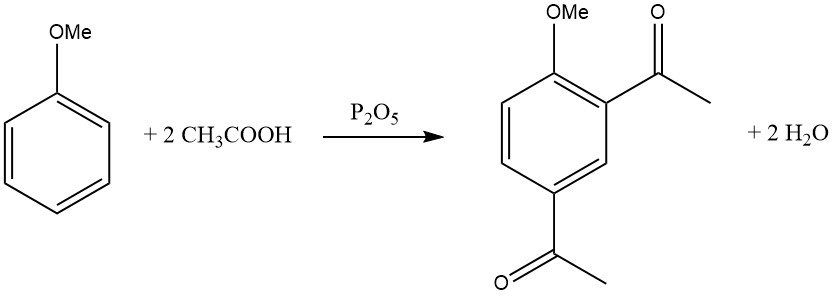
La introducción del primer grupo acilo inhibe la entrada de un segundo grupo acilo, lo que hace que la disustitución en el mismo anillo sea rara. Sin embargo, existen algunas excepciones, como la diacilación de mesitileno, dureno y anisol utilizando una mezcla de ácido acético glacial y pentóxido de fósforo.
Los sustituyentes donadores de electrones facilitan la acilación y la mejora de la reactividad debido a la polisustitución es notable.
Además del benceno y sus derivados, los compuestos aromáticos carbocíclicos polinucleares como naftaleno, difenilo, antraceno, fenantreno y pireno también pueden servir como sustratos en reacciones de acilación.
Los heterociclos ricos en electrones, como el pirrol, el furano y el tiofeno, junto con sus derivados policíclicos, presentan una alta reactividad.
Por el contrario, la piridina y la quinolina no reaccionan a menos que sean activadas por sustituyentes. Los sustratos aromáticos no bencenoideos activos en la acilación incluyen azulenos, ferrocenos e indolizinas.
A pesar de compartir algunas similitudes con la alquilación de Friedel-Crafts, la acilación muestra diferencias características.
Por ejemplo, el consumo del catalizador ácido es típicamente al menos estequiométrico, aunque hay casos en la literatura en los que se utilizan cantidades subestequiométricas de ácidos de Lewis. La reacción procede con mayor regioselectividad y más uniformidad en comparación con la alquilación de Friedel-Crafts, lo que resulta en menos isomerizaciones y reacciones secundarias.
1.1. Catalizadores de acilación
Los catalizadores empleados en la alquilación de Friedel-Crafts también se pueden utilizar para reacciones de acilación. El catalizador elegido en la mayoría de los casos es AlCl3. Las impurezas presentes en AlCl3, como FeCl3 o trazas de agua, mejoran los rendimientos de la reacción y la reactividad del sistema, particularmente en los casos en que las reacciones son lentas.
Sin embargo, en ciertos casos, la alta actividad del AlCl3 puede provocar reacciones secundarias no deseadas, como la descomposición de heterociclos reactivos como el benzofurano, la descomposición del éter o la transposición de grupos alquilo.
Para moderar la actividad del AlCl3 en tales casos, se pueden usar disolventes complejantes como el nitrobenceno para formar aductos 1:1. Además, BF3 y SnCl4 son catalizadores de acilación adecuados para heterociclos sensibles.
Cuando se emplean agentes acilantes tales como anhídridos, ésteres o ácidos carboxílicos, también se pueden aplicar ácidos protónicos fuertes como ácido sulfúrico, ácido perclórico, ácido ortofosfórico y ácido polifosfórico.
El ácido polifosfórico, que inicialmente se usaba principalmente para reacciones de ciclación intramolecular, ahora se usa cada vez más en acilaciones intermoleculares.
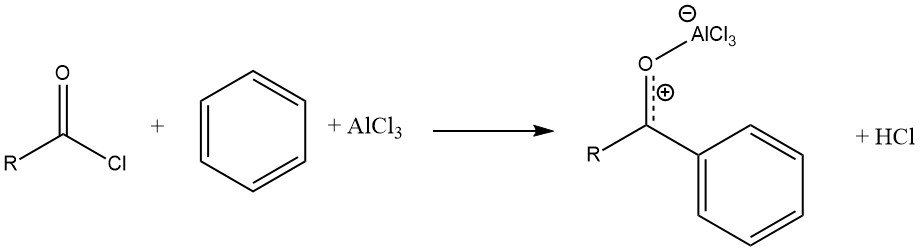
La reacción de un haluro de acilo con un sustrato aromático, catalizada por AlCl3, da como resultado la formación de un complejo estable del ácido de Lewis con la cetona aromática. A continuación, el producto se libera mediante hidrólisis.
A diferencia de las alquilaciones de Friedel-Crafts, el catalizador normalmente debe aplicarse en cantidades al menos estequiométricas con respecto al haluro de acilo. Sin embargo, existen algunas excepciones en las que se utilizan cantidades «verdaderamente catalíticas» (subestequiométricas) de ácidos de Lewis, como cloruro ferroso, óxidos de zinc o hierro, cloruro de cobalto y triflatos de metales de tierras raras.
Para agentes acilantes como ácidos carboxílicos o ésteres, se requiere al menos el doble de cantidad de catalizador y, en el caso de anhídridos, el triple (pero 1,5 moles por mol de producto).
El fluoruro de hidrógeno, a veces en combinación con fluoruro de boro, es un catalizador de importancia industrial. Ofrece la ventaja de la recuperación del catalizador mediante destilación, reduciendo así la formación de residuos.
Esta tecnología se utiliza comercialmente para la acilación de isobutilbenceno a 4-isobutiacetofenona, un intermediario en la producción de ibuprofeno, un fármaco antiinflamatorio ampliamente utilizado.
1.1.1. Catalizadores heterogéneos
Si bien la síntesis clásica de Friedel-Crafts con catalizadores homogéneos sigue siendo el método principal para preparar cetonas aromáticas, tiene varios inconvenientes:
1. A menudo requiere cantidades estequiométricas o incluso excesivas de «catalizador» debido a la formación de complejos estables con los productos. Estos catalizadores, como el AlCl3, actúan más como reactivos que como verdaderos catalizadores, lo que contribuye significativamente a los costos de producción. Es necesario separarlos y eliminarlos del producto mediante lavado y no se pueden reciclar fácilmente.
2. El sistema de reacción es altamente corrosivo y requiere reactores y equipos costosos para la purificación de los gases residuales, que contienen no sólo HCl sino también hidrocarburos clorados.
3. El catalizador debe neutralizarse y eliminarse junto con un gran volumen de aguas residuales, lo que aumenta el impacto medioambiental.
En los últimos años se han realizado esfuerzos para sustituir los catalizadores homogéneos por catalizadores heterogéneos. Los catalizadores heterogéneos ofrecen ventajas como no requerir cantidades estequiométricas, ser no corrosivos, fácil separación sin neutralización y la posibilidad de reciclarlos o utilizarlos en procesos continuos de lecho fijo.
Los catalizadores de acilación heterogéneos deben ser ácidos de Lewis o Brønsted fuertes. Algunas clases importantes de ácidos sólidos que pueden catalizar esta reacción son:
- Zeolitas: Alumosilicatos cristalinos microporosos con fuertes centros de Brønsted o Lewis. Los sistemas de poros medios como H-ZSM-5 o sistemas de poros grandes como la zeolita HY, la zeolita beta o la mordenita se han utilizado con éxito para reacciones de acilación con compuestos aromáticos ricos en electrones.
- Arcillas modificadas: Los minerales arcillosos, cuando se modifican, pueden aumentar el número de sitios ácidos. Las arcillas tratadas con ácido (catalizadores ácidos de Brønsted) y las arcillas de intercambio iónico (catalizadores ácidos de Lewis) se utilizan comercialmente para diversas reacciones catalizadas por ácidos.
- Superácidos sólidos: Los ácidos fuertes que son más fuertes que el ácido sulfúrico al 100%, incluidos los óxidos sulfatados como ZrO2, TiO2, HfO2, Fe2O3 y SnO2, se han estudiado como superácidos sólidos para reacciones de acilación.
- Varios: También se han investigado otros catalizadores como heteropoliácidos, ácidos montados en superficie (ácidos de protones o de Lewis sobre un soporte) y Nafion para reacciones de acilación, pero aún no se encuentran en uso comercial.
Al emplear catalizadores heterogéneos, los investigadores pretenden superar las limitaciones de los catalizadores homogéneos y desarrollar procesos más sostenibles y eficientes para la síntesis de cetonas aromáticas.
1.2. Disolventes en la reacción de acilación
Para las reacciones de acilación que utilizan un sistema catalizador de haluro de acilo y ácido de Lewis, la elección del disolvente juega un papel crucial. Como sustrato aromático se pueden utilizar disolventes no polares como CCl4 o CS2, así como disolventes de polaridad media como diclorometano o 1,2-dicloroetano.
Con AlCl3 como catalizador se forman en estos disolventes sistemas heterogéneos. Sin embargo, el uso de disolventes como nitrometano o nitrobenceno da como resultado soluciones homogéneas y una reactividad reducida debido a la formación de complejos. La elección del disolvente también puede influir en la regioselectividad de la reacción de acilación.
Un peligro a considerar es que los aductos de AlCl3 y nitrobenceno pueden descomponerse explosivamente a temperaturas elevadas.
Hay tres procedimientos comunes para llevar a cabo la acilación utilizando un sistema catalizador de haluro de acilo – ácido de Lewis:
- El agente acilante se añade a una solución o suspensión enfriada del catalizador en un disolvente, seguido de la adición del sustrato aromático al complejo acilante preformado (método de Perrier).
- Se mezclan y enfrían todos los reactivos y se añade lentamente el catalizador (método de Elbs).
- El sustrato aromático actúa como disolvente para el catalizador y luego se añade lentamente el agente acilante (método de Bouveault).
A menudo se prefiere el método de Perrier ya que mantiene una proporción constante de catalizador a agente acilante durante toda la reacción.
Si se utiliza ácido sulfúrico como catalizador, se requiere un gran exceso de ácido y se le añaden los reactivos. Para evitar reacciones de sulfonación o aldolización del anillo, la temperatura debe mantenerse por debajo de 100 °C.
1.3. Agentes acilantes
La acilación de Friedel-Crafts exhibe una notable versatilidad debido a la variación sistemática que se puede introducir tanto en el agente acilante como en el sustrato aromático. La reactividad de los agentes acilantes sigue la siguiente tendencia:
[RCO]+[BF4]− > [RCO]+[ClO4]− > RCOO-SO3H > RCOX (RCO)2 O > RCO2R’ > RCONR’2
Los percloratos y tetrafluoroboratos de acilo iónicos son agentes potentes, mientras que los ésteres ácidos y las amidas son casi inactivos sin catalizadores. La reactividad de los haluros de acilo disminuye en el orden: RCOI > RCOBr > RCOCl > RCOF.
La reactividad de los haluros de acilo también está influenciada por el sustituyente R, que puede ser alquilo o arilo y puede contener grupos halógeno, alquilo, alcoxi o nitro. La reactividad está influenciada además por el tipo de sustrato aromático y el catalizador utilizado.
Los haluros de acilo aromáticos pueden contener sustituyentes nitro o ser del tipo piridina, como se demuestra en la síntesis de 3-benzoilpiridina a partir de benceno y cloruro de nicotinilo.
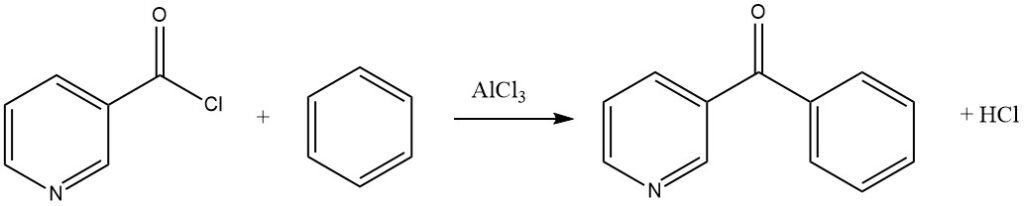
Los haluros de acilo bifuncionales también pueden actuar como agentes acilantes, como se ve en la reacción del cloruro de oxalilo con un sustrato aromático activado como el anisol, lo que conduce al correspondiente derivado de bencilo.
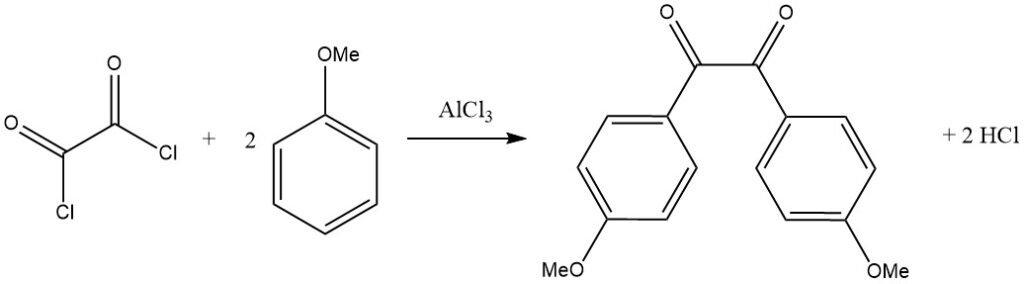
El fosgeno, un reactivo comercialmente importante, puede reaccionar con N,N-dimetilanilina para producir 4,4′-bis(dimetilamino)benzofenona (cetona de Michler), utilizada en la producción de tintes.
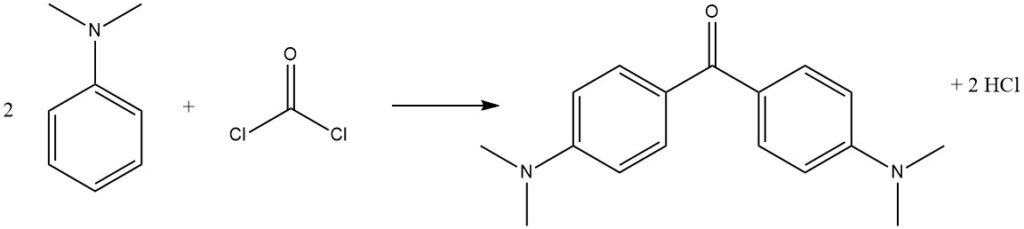
Al reemplazar un halógeno de fosgeno con un grupo amido, la amida resultante se puede hidrolizar para formar el ácido, que se considera para la síntesis industrial de ácido tereftálico.
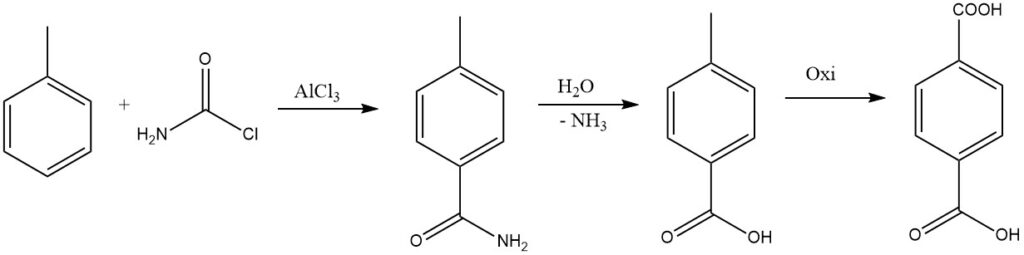
Los isocianatos, isotiocianatos y CO2 también pueden servir como agentes acilantes en presencia de AlCl3 para producir ácidos carboxílicos aromáticos o sus derivados.
Los agentes acilantes bifuncionales asimétricos, como los cloruros de ácido que contienen un grupo éster, reaccionan selectivamente con el grupo acilo más activo.
De manera similar, los anhídridos de ácido, como los anhídridos succínico, glutárico o maleico, en presencia de 2 moles de AlCl3 por mol de anhídrido, pueden producir ácidos 4-aril-4-oxobutanoico, que son intermedios en la síntesis de Haworth de aromáticos polinucleares.
La síntesis de antraquinona a partir de anhídrido ftálico y benceno tiene importancia comercial. En condiciones fuertemente ácidas también se puede formar 3,3-difenilftalida.
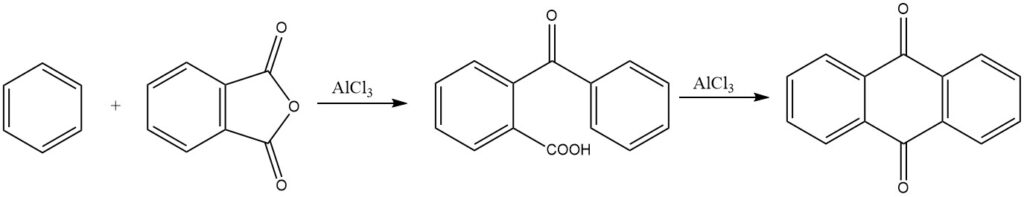
Con catalizadores de zeolita, se pueden usar ácidos carboxílicos no activados en la fase líquida para reaccionar con tolueno, produciendo p-aciltoluenos con altos rendimientos. Este proceso ha resultado muy prometedor, con rendimientos que alcanzan hasta el 96%.
2. Acilación de benceno y derivados del benceno
2.1. Acilación del benceno
La acilación industrial del benceno con anhídrido acético, utilizando AlCl3 como catalizador y manteniendo una temperatura de 30 °C mediante enfriamiento, da como resultado acetofenona con un rendimiento del 85%. Sin embargo, hoy en día la acetofenona se produce predominantemente industrialmente mediante la oxidación de etilbenceno o cumeno.
Otro método implica la acilación en fase gaseosa del benceno con ácido benzoico a temperaturas elevadas, produciendo benzofenona.
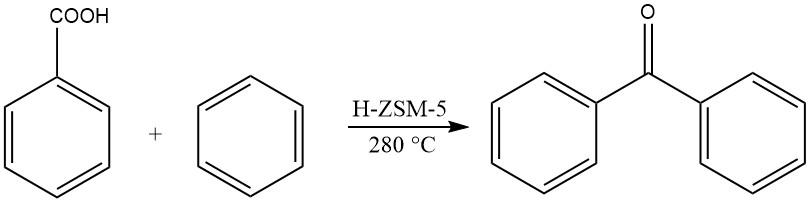
2.2. Acilación de tolueno
La acilación de tolueno, utilizando cloruro de acetilo y cloruro de aluminio como catalizador, da como resultado la formación de 4-metilacetofenona con una impresionante selectividad del 97,6%. Este compuesto encuentra aplicación en la producción de perfumes.
2.3. Acilación de sustratos desactivados
Los compuestos aromáticos bencenoideos que contienen sustituyentes nitro, carboxilo, nitrilo y acilo presentan un obstáculo para la sustitución electrófila. Sin embargo, la acilación de estos compuestos sólo resulta factible en presencia de un segundo sustituyente activador, tal como un grupo hidroxi o alcoxi.
Por otro lado, sustratos desactivados como el clorobenceno pueden someterse a acilación para formar p-clorobenzofenonas, utilizando catalizadores heterogéneos comerciales como zeolitas o circonia sulfatada, conocidos por sus propiedades como superácidos sólidos.
2.4. Acilación de sustratos activados
La acilación de sustratos activados, como el fenol, se puede lograr utilizando varios catalizadores, incluido el ácido carboxílico (ZnCl2), el ácido carboxílico (BF3) o el ácido carboxílico (ácido polifosforoso). La acilación de fenoles demuestra hasta un 25% de selectividad por la sustitución orto, estando fuertemente influenciada la relación orto a para por la elección de catalizadores y disolventes.
Los alquilfenoles lineales se pueden sintetizar mediante acilación seguida de reducción. Un ejemplo ilustrativo es la producción de hexilresorcinol, muy utilizado como desinfectante:
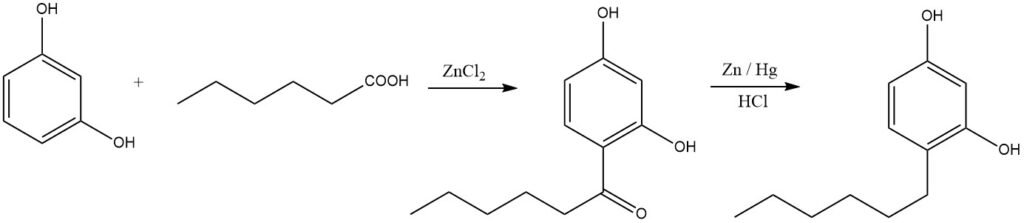
Tanto los fenoles como los éteres fenílicos son sustratos altamente reactivos y exhiben reactividad en condiciones relativamente suaves. Por ejemplo, el anisol se puede acilar convenientemente a 40 – 50 °C en presencia de ácido polifosfórico. Los feniléteres, por el contrario, se acilan predominantemente en la posición 4.
Una alternativa respetuosa con el medio ambiente a los sistemas de acilación convencionales de Friedel: Craft evita la formación de sales residuales y subproductos. Este enfoque implica el uso de anhídridos mixtos de ácido trifluoroacético, que se generan in situ al reaccionar con ácidos carboxílicos. Bajas concentraciones de H3PO4 sirven como catalizador y el ácido trifluoroacético se puede reciclar después de la deshidratación.
2.5. Acilación de aminas aromáticas
Después de la N-acilación, las aminas aromáticas exhiben un patrón de reactividad similar al de los compuestos alquilaromáticos en las reacciones de acilación. Las aminas aromáticas terciarias, como la N,N-dimetilanilina, pueden sufrir acilación en la posición 4, empleando P2O5 como catalizador. Esto es bien conocido en la síntesis de la cetona de Michler.
2.6. Reacciones de ciclación
La 6-metoxi-1-tetralona se obtiene con un impresionante rendimiento del 96% haciendo reaccionar ácido 4-(3-metoxifenil)butírico.
Las ciclizaciones intermoleculares se demuestran de manera destacada en reacciones de anhídrido ftálico con benceno y sus derivados, lo que da como resultado antraquinona y antraquinonas sustituidas, respectivamente.
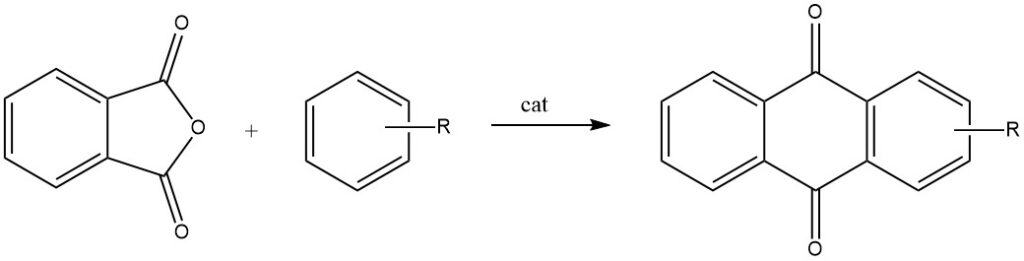
Cuando el anhídrido ftálico reacciona con tolueno o clorobenceno, se somete a un proceso de dos pasos que conduce a la formación de antraquinonas 2-sustituidas.
Por el contrario, la reacción con 4-clorofenol produce directamente 1,4-dihidroxiantraquinona (chinizarina). La oxidación, nitración, cloración o aminación posterior de estos productos genera intermediarios esenciales para la química fina.
Además, la acilación Friedel – Crafts de etilbenceno con anhídrido ftálico produce, mediante un proceso de dos pasos, 2-etilantraquinona, un componente importante utilizado en la síntesis de H2O2.
3. Acilación de compuestos aromáticos polinucleares
3.1. Acilación de naftaleno
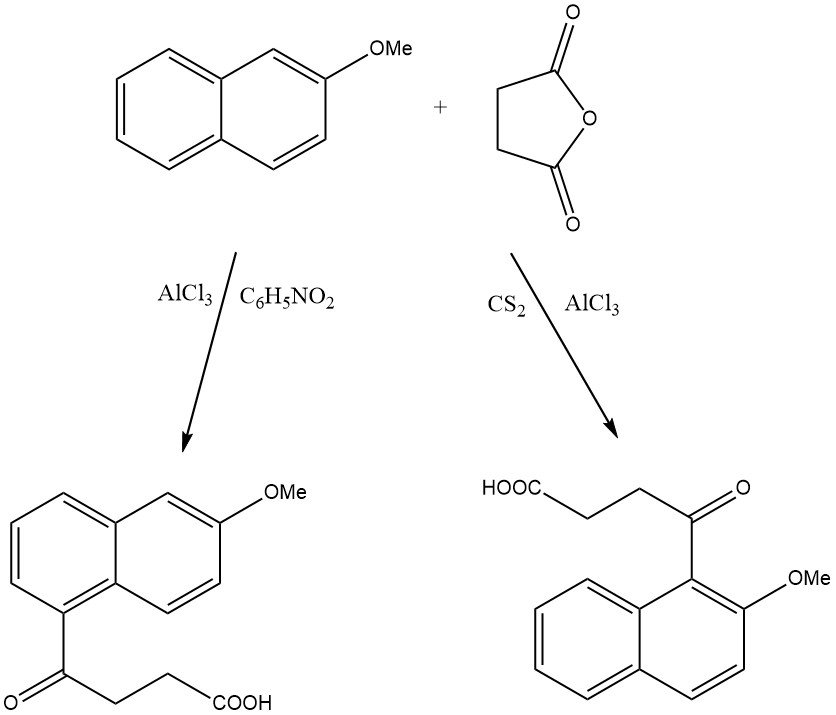
La acilación de naftaleno normalmente da como resultado mezclas de derivados de 1 y 2 acilo, y las proporciones relativas de estos derivados están influenciadas principalmente por la elección del disolvente. Cuando se utilizan disolventes no polares como CS2 o CCl4, la acilación se produce principalmente en la posición 1. Por el contrario, en disolventes polares como CH3NO2 o C6H5NO2 se favorece la formación de 2-acetilnaftalenos.
3.2. Acilación de naftalenos sustituidos
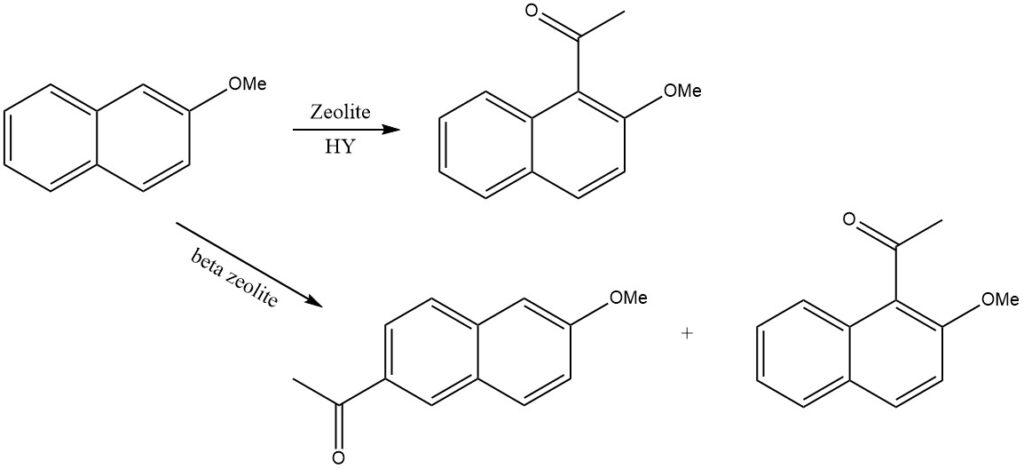
La acilación de naftalenos sustituidos produce a menudo mezclas complejas de productos. Normalmente, el anillo más activado es más propenso a la acilación. Sin embargo, la regioselectividad puede controlarse mediante la selectividad de forma de las zeolitas.
Por ejemplo, cuando se acila 2-metoxinaftaleno en la zeolita HY, solo se produce 1-acetil-2-metoxinaftaleno, mientras que en la zeolita beta, se forma 2-acetil-6-metoxinaftaleno.
La 1,5-diacilación requiere condiciones más estrictas, como se ve en la síntesis de 1,5-dibenzoilnaftaleno. Este compuesto se puede fusionar aún más en cloruro de aluminio y sodio para producir dibenzopirenoquinona, un tinte comercializado como Indanthren Goldgelb GK.
Cuando la naftaleno reacciona con compuestos diacilo, a menudo se forman productos 1,8-diacilados.
3.3. Acilación de bifenilos
Cuando un anillo de una molécula de bifenilo es desactivado por un sustituyente aceptor de electrones, el otro anillo se vuelve más reactivo y puede sufrir acilación en la posición 4. La desactivación de un anillo mejora la reactividad del otro anillo, haciéndolo más susceptible a la sustitución electrófila y, por tanto, la acilación se produce preferentemente en la posición 4.
3.4. Acilación de antraceno
En presencia de AlCl3 y en condiciones suaves en disolventes no polares (0 °C, benceno), el antraceno sufre acilación en la posición 9 más reactiva. La isomerización del complejo cetona-AlCl3 se evita mediante precipitación.
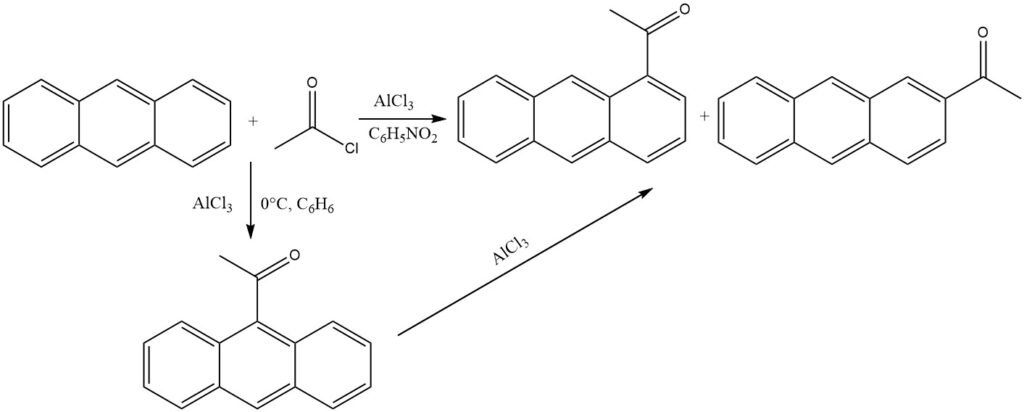
Sin embargo, cuando se utilizan disolventes polares como el nitrobenceno, se forma una mezcla compuesta principalmente de 1-acilantraceno y algo de 2-acilantraceno. También en este escenario, es probable que el 9-acilantraceno sea el producto inicial, que posteriormente sufre una isomerización.
3.5. Acilación de fenantreno
Asimismo, cuando se acila fenantreno en nitrobenceno, los principales productos que se obtienen son los isómeros 2 y 3 acilo. Por otra parte, el uso del disolvente menos polar dicloroetano conduce predominantemente a la formación del isómero 9-acilo como producto primario. La elección del disolvente juega un papel crucial en la determinación de la regioselectividad de la reacción de acilación del fenantreno.
4. Acilación de compuestos heteroaromáticos
El furano, el tiofeno y el pirrol poseen una alta densidad electrónica, lo que los vuelve altamente activados en reacciones de sustitución electrófila, lo que permite su acilación en condiciones de reacción suaves.
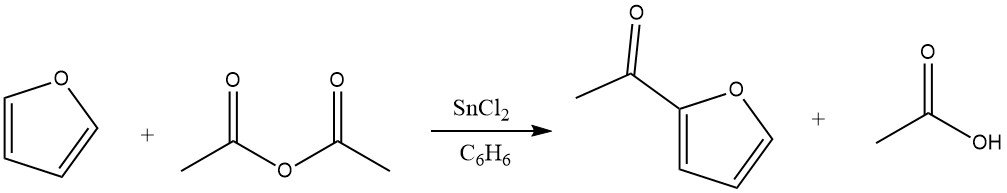
4.1. Acilación de furano
La acilación de furano da como resultado rendimientos significativos del derivado 2-acilo, particularmente cuando los anhídridos sirven como agentes acilantes. La excelente reactividad del furano permite el uso de benceno como disolvente. Los catalizadores adecuados para esta reacción incluyen cloruro de zinc, trifluoruro de boro y ácido fosfórico. Además, la acilación también puede tener lugar en la posición 5.
4.2. Acilación de tiofeno
La reactividad del tiofeno se puede comparar con la del anisol. El tiofeno se puede acilar eficientemente, produciendo altos rendimientos de los productos deseados, cuando se usan haluros de acilo en presencia de SnCl4 o se emplean anhídridos con ácido fosfórico o ZnCl2 como agente acilante.
4.3. Acilación de pirrol
La acilación del pirrol puede tener lugar incluso en ausencia de catalizadores, aunque comúnmente se usan ZnCl2, BF3 y AlCl3 junto con anhídridos como agentes acilantes. Generalmente, la acilación se produce en la posición 2 del anillo pirrol, pero también es factible la 2,5-diacilación. Sin embargo, la 3-acilación se observa sólo cuando las posiciones 2 y 5 del anillo pirrol están bloqueadas.
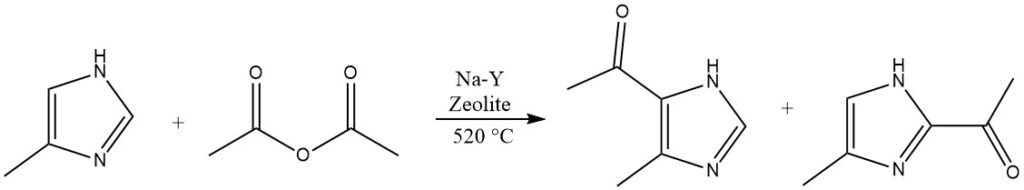
4.4. Acilación de imidazoles
Los heterociclos que están altamente desactivados y no pueden acilarse en fases líquidas homogéneas, como el imidazol o los pirazoles, son capaces de reaccionar con zeolitas Na-Y a temperaturas elevadas que superan los 500 °C.
4.5. Acilación de benzofuranos
Los heterociclos altamente reactivos pueden sufrir acilaciones utilizando zeolitas en un proceso continuo en fase líquida. Por ejemplo, la acilación de 2-metilbenzofurano con anhídrido acético es un ejemplo representativo:
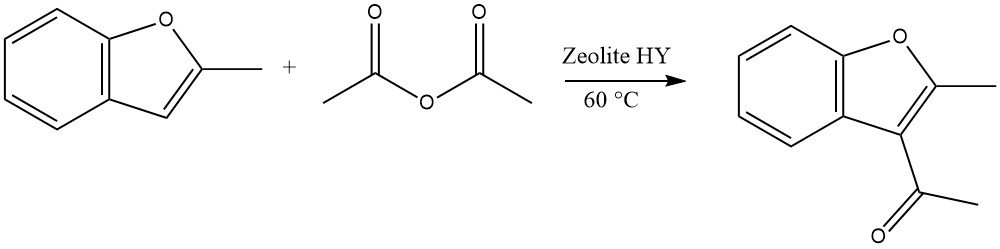
En el caso del dibenzofurano y el dibenzotiofeno, la acilación o diacilación puede ocurrir en la posición 2 u 8. Para el carbazol, la acilación o diacilación normalmente ocurre en la posición 3 o 6.
4.6. Misceláneas
Las 4H-pironas sustituidas han demostrado excelentes rendimientos en reacciones de acilación cuando se utiliza ácido trifluoroacético como catalizador. En particular, incluso se pueden lograr reacciones de diacilación.
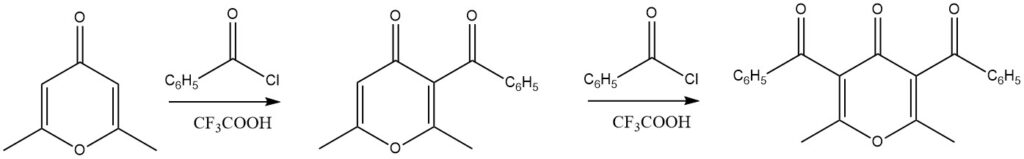
También se han sometido con éxito a reacciones de acilación una amplia gama de otros compuestos heteroaromáticos, incluidos cromano, xantenos, 1,3-benzodioxol y dibenzodioxinas.
5. Acilación de compuestos aromáticos no bencenoideos
El ferroceno se acila fácilmente con haluros de acilo en presencia de cloruro de aluminio, mostrando una reactividad comparable a la de los fenoles. Los anhídridos también pueden servir como agentes acilantes. Con BF3 como catalizador, se puede lograr la monoacilación del ferroceno. Cuando se utiliza un exceso tanto del agente acilante como de AlCl3, la diacetilación heteroanular se convierte en la reacción predominante.
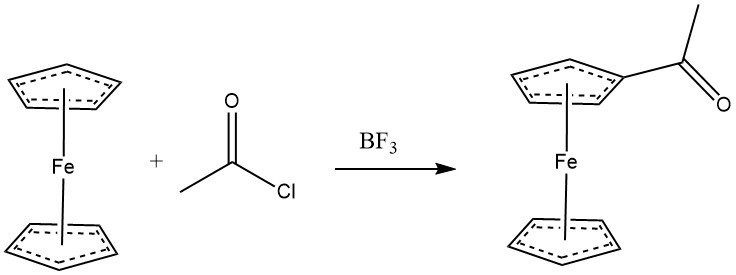
Varios derivados de ciclopentadienilo son susceptibles de acilación. La reactividad de algunos sustratos aromáticos sigue este orden: C6H5OH•(C5H5)2Fe > C6H5OCH3 > CH3C5H4Mn(CO)3 > C5H5Mn(CO)3 > C6H6.
El azuleno reacciona suavemente con anhídrido acético en presencia de SnCl4 como catalizador, lo que lleva a la acilación de la parte ciclopentadienilo y da como resultado 1-acetilazuleno. En condiciones más rigurosas y en presencia de AlCl3 o SnCl4, se forma 1,3-diacetilazuleno utilizando cloruro de acetilo o anhídrido acético como agente acilante.
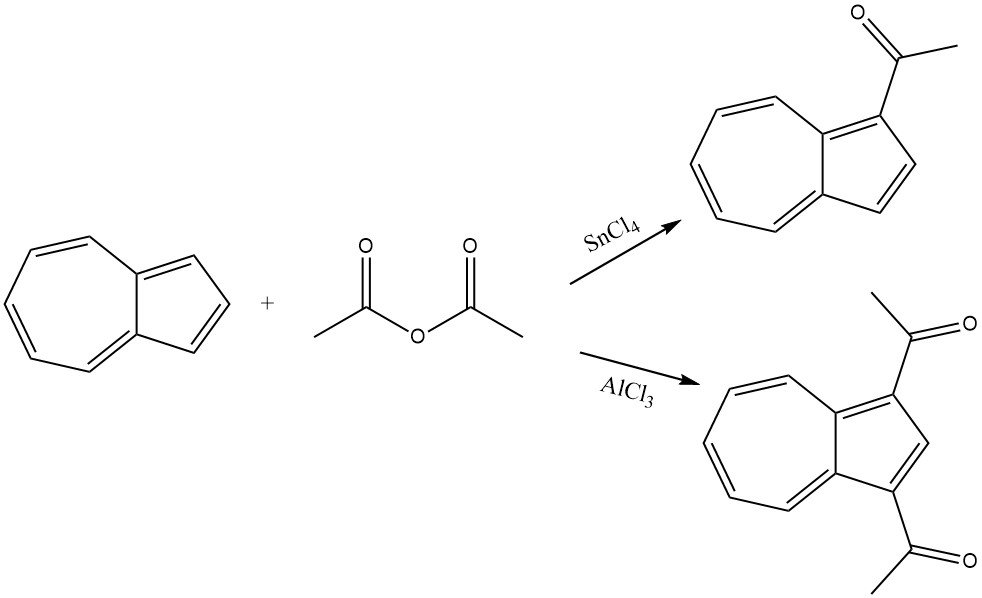
6. Reacciones diversas de acilación
Entre las numerosas reacciones que conducen a productos aromáticos de acilación C, son particularmente importantes las reacciones de formilación, la síntesis de Houben-Hoesch y la transposición de Fries.
6.1. Formilación
La formilación de compuestos aromáticos es un tipo específico de reacción de acilación que ocurre cuando un haluro de formilo o anhídrido fórmico reacciona con un compuesto aromático en presencia de un catalizador de Friedel-Crafts, como AlCl3. Sin embargo, la aplicación de esta reacción es limitada debido a la inestabilidad de la mayoría de los agentes formilantes.
La síntesis de Gattermann-Koch utiliza una mezcla de cloruro de hidrógeno y monóxido de carbono con AlCl3 y cloruro de cobre (I) como agente formilante de compuestos aromáticos. El benceno, así como los bencenos sustituidos o los aromáticos policíclicos, se someten a formilación para producir aldehídos aromáticos, con preferencia por los isómeros para.
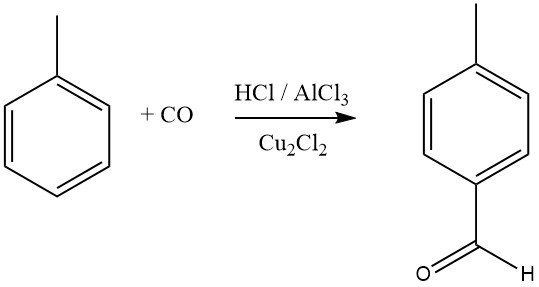
Los compuestos aromáticos con sustituyentes metadirectores no reaccionan en este proceso de formilación. Mitsubishi Gas Chemical está explorando una síntesis modificada de Gattermann-Koch para la síntesis industrial de ácido tereftálico.
En este proceso, el tolueno reacciona con CO y HF-BF3 para producir p-tolualdehído con alto rendimiento, que luego se oxida a ácido tereftálico. Estudios recientes sugieren que el agente acilante real en estas reacciones es el [CHO]+, formado por la protonación del CO o sus complejos.
Para la síntesis de aldehídos de Vilsmeier, los sustratos aromáticos y heterocíclicos se formilan mediante reacción con dialquil o arilalquilformamidas en presencia de POCl3. Esta reacción permite la formilación de una variedad de compuestos, incluidos compuestos aromáticos polinucleares reactivos, éteres de fenol, dialquilaminas y N-heterociclos como pirrol e indol.
La regioselectividad de la formilación sigue los principios de las reacciones de Friedel-Crafts, que normalmente conducen a la formación de compuestos aromáticos 4-sustituidos. Además, los sustratos aromáticos se pueden formilar usando diclorometil metil éter u ortoformiato de trialquilo en presencia de TiCl4 o AlCl3, respectivamente.
6.2. Síntesis de Houben-Hoesch
La síntesis de Houben-Hoesch, estrechamente relacionada con la reacción de Gattermann, implica la acilación de sustratos aromáticos reactivos como fenoles, éteres fenílicos, pirroles, tiofenos e indoles utilizando nitrilos. Estas reacciones tienen lugar en presencia de cloruro de hidrógeno (HCl) y cloruro de zinc (ZnCl2).
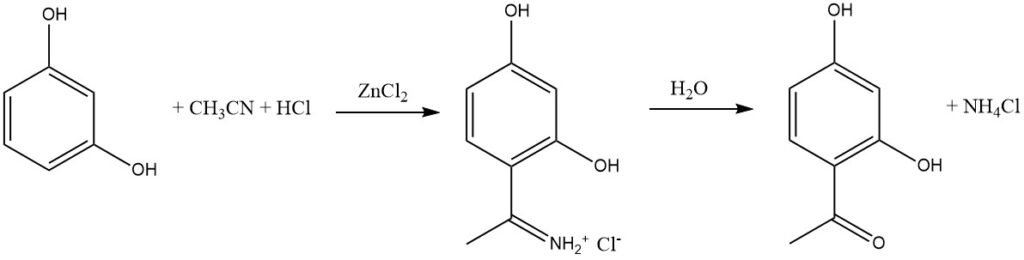
En esta síntesis, el electrófilo activo es el ion imminio, que se forma mediante la adición de HCl al nitrilo y luego forma complejo con el ácido de Lewis (ZnCl2). Este intermedio voluminoso conduce predominantemente a la acilación en la posición 4 del sustrato aromático en lugar de en la posición 2.
En comparación con la acilación de Friedel-Crafts con haluros o anhídridos de acilo, la síntesis de Houben-Hoesch es a menudo un método más sencillo para acilar fenoles activados.
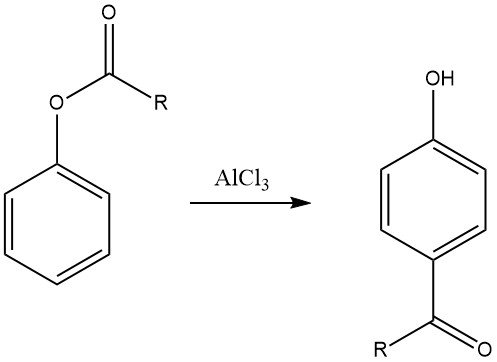
6.3. Reordenamiento de Fries
La transposición de Fries de ésteres arílicos, que se puede preparar mediante la acilación de fenoles, es un método valioso para sintetizar cetonas fenólicas utilizadas en la producción de productos químicos finos. Esta reacción se emplea ampliamente en la industria farmacéutica para la síntesis de fármacos como adrenalón, sinefrina, bufenina y acebutolol.
La regioselectividad del reordenamiento de Fries se puede controlar ajustando las condiciones de reacción. Generalmente, la sustitución para se ve favorecida a bajas temperaturas, mientras que la sustitución orto se ve favorecida a altas temperaturas. Sin embargo, la elección del disolvente y el tipo y cantidad de catalizadores también influyen en la regioselectividad.
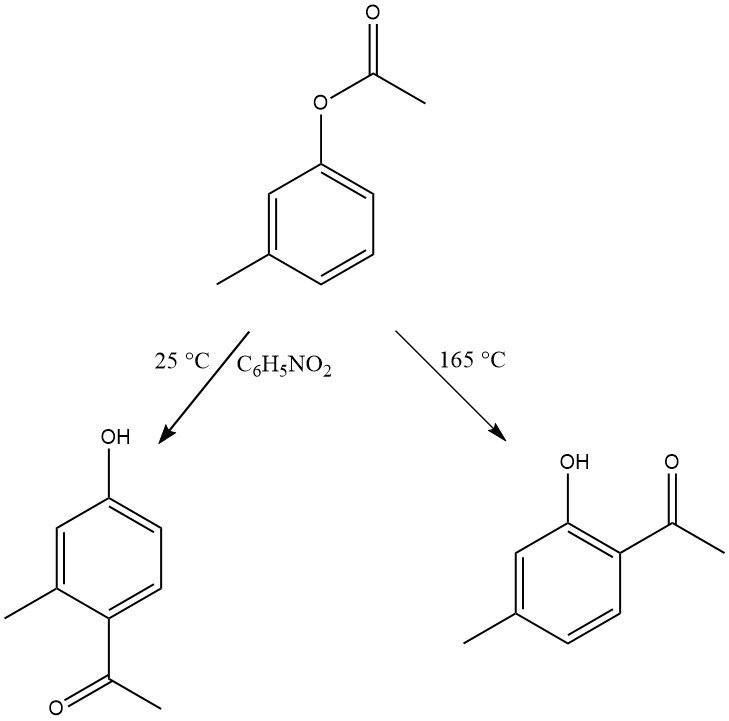
Una amplia gama de sustratos con diversas sustituciones tanto en los restos fenólicos como en los ácidos pueden sufrir este reordenamiento. Incluso los derivados del fenol con grupos aceptores de electrones, como el grupo nitro, así como el naftol y los ésteres de hidroxi o dihidroxifenilo, son reactivos en esta transformación.
Las N-acilanilinas también se pueden reorganizar para producir 4-acilanilinas a temperaturas elevadas. La parte ácida de los ésteres puede variarse, permitiendo el uso de diferentes ácidos alquílicos o arílicos, incluidos ésteres de diarildicarboxilo y ésteres de ácido sulfónico, que conducen a la formación de 4-hidroxifenilsulfonas.
AlCl3 es el catalizador más utilizado, aunque SnCl4, TiCl4, FeCl3 y ZnCl2 también son eficaces y, en ocasiones, más convenientes. La transposición se realiza normalmente calentando una mezcla de ésteres fenólicos y el catalizador a temperaturas que oscilan entre 80 y 180 °C.
Dependiendo de la reactividad del sustrato, la reacción puede completarse en unos pocos minutos o unas pocas horas. Es posible realizar la reacción a temperaturas más bajas en disolventes como C6H6NO2, (CH2Cl)2, CS2, C6H5Cl o éter de petróleo, pero esto requiere tiempos de reacción más largos.
Alternativamente, la transposición se puede iniciar en CS2, seguida de destilación para eliminar el disolvente y luego completarse a temperaturas más altas.
Para aislar el isómero orto de las mezclas de productos, a menudo se emplea destilación al vapor. Por otro lado, los productos volátiles se pueden separar mediante destilación fraccionada y el isómero para se puede obtener a partir de mezclas de productos no volátiles mediante cristalización.
Referencia
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
Preguntas frecuentes sobre la acilación
La acilación de Friedel-Crafts es un tipo de reacción química orgánica que implica la introducción de un grupo acilo (R-CO-) en un anillo aromático. Lleva el nombre de los químicos Charles Friedel y James Crafts, quienes desarrollaron la reacción en el siglo XIX.
A menudo es necesaria la acidificación de la mezcla de reacción antes de la acilación para generar un electrófilo apropiado que pueda reaccionar con el sustrato aromático. Este paso ayuda en la activación del agente acilante (p. ej., haluro o anhídrido de acilo) y lo prepara para sufrir una sustitución aromática electrófila, un paso clave en la acilación de Friedel-Crafts. El proceso de acidificación implica la adición de un catalizador ácido de Lewis como AlCl3 o FeCl3 para generar el ion acilio reactivo (RCO+), que facilita la reacción de acilación.
La acilación de Friedel-Crafts implica la sustitución electrófila de un grupo acilo en un anillo aromático. La reacción tiene lugar generando primero un electrófilo fuerte (ion acilio) a partir del agente acilante en presencia de un catalizador ácido de Lewis. Luego, este electrófilo ataca el anillo aromático rico en electrones, lo que lleva a la formación de un carbocatión intermedio. La reacción se completa con la desprotonación de este carbocatión, lo que da como resultado la introducción del grupo acilo en el anillo aromático, produciendo el producto acilado.
Las reacciones de acilación se pueden realizar en una variedad de solventes dependiendo de las condiciones de reacción específicas y la reactividad de los sustratos y reactivos involucrados. Los disolventes no polares como CCl4, CS2, benceno y tolueno se utilizan habitualmente para las reacciones de acilación de Friedel-Crafts. Además, se pueden emplear disolventes polares como diclorometano y nitrobenceno para reacciones específicas. La elección del disolvente puede influir en la reactividad, la regioselectividad y el rendimiento de la reacción de acilación.
El fuerte efecto desactivante del grupo acilo conduce predominantemente a la formación de productos de monosustitución y la naturaleza voluminosa del grupo acilante también restringe una mayor sustitución, lo que lleva a la monosustitución como producto principal.
Las reacciones de acilación tienen amplias aplicaciones en la síntesis orgánica y la producción de diversos compuestos químicos. Algunos usos comunes de la acilación incluyen:
- Síntesis de cetonas aromáticas, intermediarios esenciales en productos farmacéuticos y agroquímicos.
- Elaboración de química fina, colorantes y perfumes.
- Formación de intermedios reactivos para una mayor funcionalización de moléculas orgánicas.
- Producción de productos químicos industriales como ácido tereftálico y antraquinonas.
- Síntesis de compuestos biológicamente activos, como fármacos y productos naturales.
Si bien la acilación de Friedel-Crafts es un método sintético valioso, tiene algunas limitaciones. Una limitación importante es la posibilidad de que se produzcan reacciones secundarias, como la poliacilación, que pueden dar lugar a productos indeseables y disminuir el rendimiento general. Además, es posible que algunos sustratos no se acilen de manera eficiente debido al impedimento estérico o la desactivación causada por ciertos sustituyentes. Además, el uso de catalizadores ácidos de Lewis fuertes puede provocar reacciones secundarias no deseadas o envenenamiento del catalizador.
Sí, la acilación de Friedel-Crafts se ha utilizado ampliamente en la síntesis de diversos productos naturales y compuestos biológicamente activos. Permite la introducción de grupos funcionales específicos en anillos aromáticos, facilitando la creación de diversas estructuras químicas que se encuentran en productos naturales. La regioselectividad y las suaves condiciones de reacción lo convierten en una herramienta valiosa para la síntesis eficiente de moléculas complejas con restos aromáticos.
Las reacciones de acilación de Friedel-Crafts a menudo implican el uso de ácidos de Lewis fuertes y agentes acilantes, que pueden ser peligrosos y reactivos. Se deben seguir las precauciones de seguridad adecuadas, incluido el uso de equipo de protección adecuado, como guantes, batas de laboratorio y gafas de seguridad. Las reacciones deben realizarse en una campana extractora bien ventilada para evitar la inhalación de vapores ácidos.
