Crotonaldéhyde : propriétés, réactions, production et utilisations
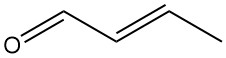
Le crotonaldéhyde [4170-30-3], également connu sous le nom de 2-buténal, est un liquide incolore doté d’une odeur âcre et de fortes propriétés lacrymatoires. Il a une formule chimique CH3CH=CHCHO et existe sous forme de deux stéréoisomères : cis-crotonaldéhyde [15798-64-8] et trans-crotonaldéhyde [123-73-9].
Le crotonaldéhyde disponible dans le commerce contient un mélange des deux isomères, l’isomère trans étant la forme dominante (> 95 %) en raison de sa plus grande stabilité thermodynamique.
Le crotonaldéhyde se trouve naturellement dans diverses plantes et produits végétaux, notamment les haricots verts, l’huile de colza et l’huile de soja.
Table des matières
1. Propriétés physiques du crotonaldéhyde
Le crotonaldéhyde est soluble dans l’eau et miscible avec les solvants organiques, notamment l’acétone, le benzène, l’éther diéthylique et l’éthanol. Certaines propriétés physiques du crotonaldéhyde sont résumées dans le tableau 1 suivant :
| Propriété | Valeur |
|---|---|
| Masse moléculaire | 70,09 g/mol |
| Point d'ébullition | 102,2 °C |
| Point de fusion | -76 °C |
| Densité (20°C) | 0,852 g/cm3 |
| Indice de réfraction (n20D) | 1.438 |
| Chaleur de vaporisation | 515 J/g |
| Azéotrope crotonaldéhyde-eau | 24,8 % en poids H2O |
| Point d'ébullition de l'azéotrope | 84 °C |
| Solubilité dans l'eau (20°C) | 181 g/L |
| Solubilité de l'eau dans le crotonaldéhyde (20°C) | 9,5 g/100 g |
| Pression de vapeur (à 20 °C) | 4,3 kPa |
| Point éclair | 13 °C |
| Température d'auto-inflammation | 165 °C |
| Limites d'explosion dans l'air |
Inférieur : 2,1 % en volume Supérieur : 15,5 vol% |
2. Réactions chimiques du crotonaldéhyde
Le crotonaldéhyde est très réactif en raison de la présence à la fois d’un groupe carbonyle et d’une double liaison carbone-carbone dans sa structure. La contamination par des acides ou des alcalis forts déclenche facilement des réactions de condensation exothermiques.
L’exposition à des acides forts catalyse la dimérisation du crotonaldéhyde en dicrotonaldéhyde (5,6-dihydro-2,6-diméthyl-2H-pyran-3-carboxaldéhyde).
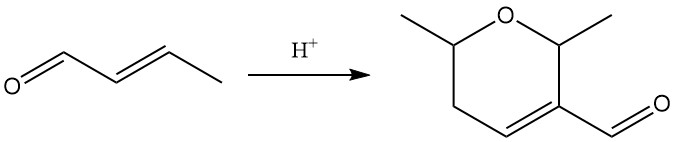
Les principales réactions du crotonaldéhyde comprennent l’hydrogénation, la réduction, l’oxydation et l’addition.
Le groupe carbonyle et la double liaison C-C peuvent subir une réduction. L’hydrogénation catalytique, utilisant généralement des catalyseurs au nickel ou au cuivre, offre l’approche la plus économique.
L’hydrogénation sélective du fragment oléfinique à des températures et des pressions de réaction plus basses était un procédé autrefois utilisé pour la production de n-butanal. Actuellement, l’hydroformylation du propène est la méthode privilégiée pour la synthèse du butyraldéhyde.
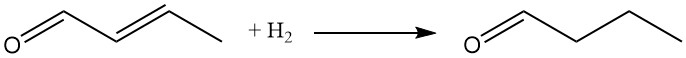
L’hydrogénation des deux groupes fonctionnels produit du n-butanol, couramment produit aujourd’hui par hydrogénation du n-butyraldéhyde.
L’hydrogénation catalytique sélective au niveau du groupe carbonyle conduit à l’alcool crotylique (CH3CH=CHCH2OH).

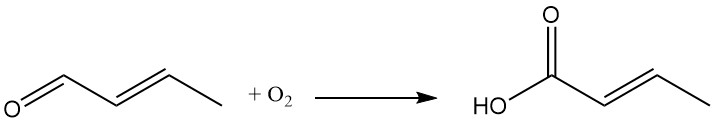
L’oxydation du crotonaldéhyde entraîne la formation d’acide crotonique.
L’ajout de diverses molécules au double liaison du crotonaldéhyde produit des intermédiaires chimiques précieux. Par exemple, l’ajout d’alcools ou de thiols à la double liaison oléfinique, catalysée par un catalyseur basique, est important pour la synthèse des 3-alcoxybutyraldéhydes.
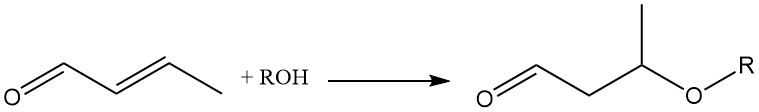
L’ajout de méthanol au crotonaldéhyde forme le 3-méthoxybutyraldéhyde intermédiaire, qui subit une hydrogénation et une estérification consécutives pour produire des solvants spéciaux comme le 3-méthoxybutanol (1) et l’acétate de 3-méthoxybutyle (2).

Le crotonaldéhyde peut également être utilisé comme diénophile dans les réactions de Diels-Alder.
3. Production de crotonaldéhyde
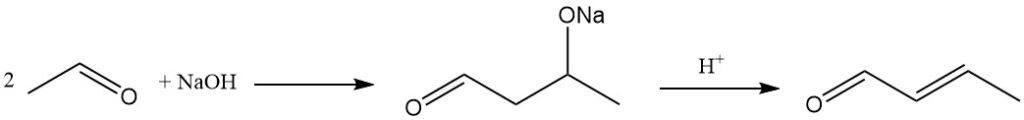
La méthode industrielle dominante pour la production de crotonaldéhyde est la condensation aldolée de l’acétaldéhyde, suivie de la déshydratation de l’aldol résultant et de la distillation ultérieure. Ce processus donne un produit d’une pureté d’environ 99 %.
La réaction d’aldolisation peut être catalysée par une large gamme de catalyseurs basiques, notamment des catalyseurs alcalins ou alcalino-terreux, des sels d’ammonium, des zéolites, des tamis moléculaires et des matériaux de type argile.
L’acide acétique, les acides minéraux ou les résines échangeuses de cations acides sont utilisés comme catalyseurs pour l’étape de déshydratation qui convertit l’aldol en crotonaldéhyde.
Celanese Chemicals et Daicel sont d’importants producteurs commerciaux de crotonaldéhyde. Une unité de production continue simplifiée de crotonaldéhyde est illustrée à la figure 1.
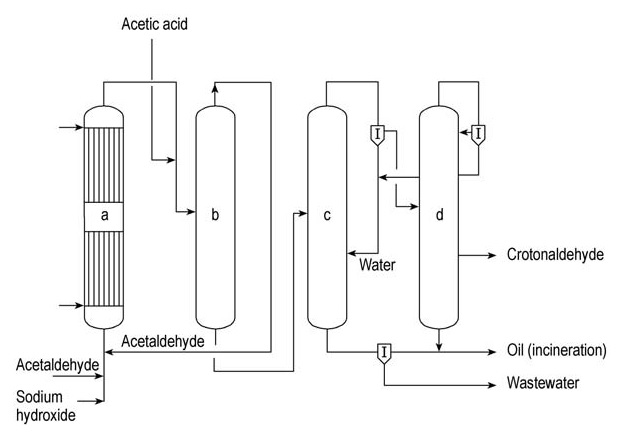
a) Réacteur Aldol ; b) Colonne de stripping d'acétaldéhyde ; c) Colonne de distillation azéotropique ; d) Colonne de rectification
Dans ce processus, l’acétaldéhyde subit une aldolisation dans un réacteur aldolique refroidi à l’eau (a) en utilisant une solution aqueuse d’hydroxyde de sodium comme catalyseur. Le produit est ensuite neutralisé avec de l’acide acétique avant d’être introduit dans une colonne de stripping (b).
L’acétaldéhyde n’ayant pas réagi est récupéré en tête de cette colonne et recyclé vers le réacteur aldol (a). Le produit de fond de la colonne (b), l’aldol intermédiaire, est introduit dans la colonne de distillation azéotrope (c). Ici, l’aldol subit une déshydratation et l’azéotrope crotonaldéhyde-eau est distillé.
Cet azéotrope est ensuite séparé en eau et en une phase aqueuse crotonaldéhyde contenant environ 10 % d’eau. L’eau est recyclée vers la colonne azéotrope (c), sortant comme produit de fond.
Le flux aqueux de crotonaldéhyde est ensuite introduit dans la colonne de rectification (d), où un autre azéotrope crotonaldéhyde-eau se forme et sort en tête. Cet azéotrope est séparé en eau, qui est recyclée vers la colonne d’azéotrope (c), et en crotonaldéhyde aqueux, qui est recyclé dans la colonne de rectification (d).
Le crotonaldéhyde pur est obtenu comme flux secondaire à partir de cette colonne.
Les fractions lourdes sont retirées du fond de la colonne (d) et combinées aux résidus organiques de la colonne azéotrope (c) avant d’être incinérées. Les eaux usées générées par la colonne (c) sont traitées dans une station d’épuration des eaux usées dédiée.
Méthodes de production alternatives
Bien que la condensation aldolique de l’acétaldéhyde reste la méthode industrielle dominante, des technologies alternatives ont été explorées. Une méthode est l’oxydation du butadiène en son monoépoxyde, suivie d’une isomérisation en crotonaldéhyde.
Ce procédé présente certaines similitudes avec le procédé Wacker-Hoechst pour la production d’acétaldéhyde à partir d’éthylène. Cependant, l’utilisation du paraldol comme alternative à l’aldol pour la production de 1,3-butylène glycol de qualité cosmétique semble être plus prometteuse que son application dans la synthèse du crotonaldéhyde.
Autres méthodes, telles que l’oxydation catalytique des oléfines, la déshydrogénation de l’alcool allylique avec des amines, l’hydratation en phase vapeur d’acétylène et l’oxydation enzymatique du 2-butène n’ont pas atteint une importance pratique pour la production de crotonaldéhyde.
Le crotonaldéhyde peut également être formé comme sous-produit lors de la synthèse du 1,3-butylène glycol et lors de la production d’acide acétique via la carbonylation du méthanol. De plus, les processus de combustion incomplète, tels que ceux qui se produisent dans les pots d’échappement des automobiles, génèrent du crotonaldéhyde comme composant des gaz d’échappement.
4. Utilisations du crotonaldéhyde
Le crotonaldéhyde est utilisé comme précurseur dans la synthèse de divers produits industriels.
De grandes quantités de crotonaldéhyde sont utilisées dans la production d’acide sorbique, un conservateur alimentaire courant. La synthèse implique la condensation du crotonaldéhyde avec le cétène en présence de sels organiques de zinc, suivie d’une dépolymérisation du polyester obtenu, soit thermiquement, soit à l’aide d’un acide minéral.
l’α-tocophérol, l’un des huit composants naturels ayant une activité en vitamine E, est synthétisé industriellement par condensation du phytol avec la 2,3,6-triméthylhydroquinone qui est formé à partir de crotonaldéhyde et de diéthylcétone selon un processus en quatre étapes.
Le 3-méthoxybutanol est produit par addition de méthanol au crotonaldéhyde suivi d’une hydrogénation. Ce produit et son ester acétate sont utilisés comme solvants spéciaux, particulièrement appréciés pour leur capacité à contrôler la viscosité, le comportement au séchage et la brillance des laques et vernis.
Le crotonaldéhyde est un précurseur d’un large éventail d’intermédiaires chimiques. Un exemple principal est l’acide crotonique, obtenu par oxydation du crotonaldéhyde. Ces intermédiaires dérivés du crotonaldéhyde sont utilisés dans divers secteurs, notamment :
- Produits pharmaceutiques et produits biocompatibles/médicaux
- Produits agrochimiques
- Résines, épaississants polymères
- Peintures et revêtements
- Colorants
- Caoutchoucs et antioxydants du caoutchouc
- Durcissement de la gélatine
- Adhésifs
- Tannage et encollage du cuir (cuir et papier)
- Azurants métalliques
- Lubrifiants
- Inhibiteurs de corrosion
5. Toxicologie du crotonaldéhyde
Le crotonaldéhyde présente un risque important pour la santé en raison de ses puissantes propriétés irritantes. Voici un aperçu de ses effets :
Effets sur la santé humaine
- Le crotonaldéhyde irrite les yeux, la peau et les voies respiratoires. Des études suggèrent différents seuils d’irritation, allant respectivement de 0,035 ppm à 0,56 ppm pour la détection des odeurs et l’irritation.
- L’inhalation peut provoquer des sensations de brûlure au niveau du nez et des voies respiratoires, des larmoiements, de la toux, une bronchoconstriction et potentiellement un œdème pulmonaire ou des lésions pulmonaires profondes.
- Le crotonaldéhyde est présent dans la fumée de tabac, les gaz d’échappement des moteurs et la combustion du bois. On le trouve également naturellement dans certains aliments.
Limites d’exposition professionnelle
En l’absence de niveaux d’exposition professionnelle spécifiques, des lignes directrices telles que les AEGL (niveaux guides d’exposition aiguë) et les ERPG (lignes directrices pour la planification des interventions d’urgence) peuvent être utilisées pour l’évaluation des risques lors d’accidents ou d’urgences.
Données toxicologiques
- Toxicité aiguë :
- DL50 orale (rat) : 174 mg/kg
- CL50 par inhalation (rat, mâle, 4h) : 336 mg/m3
- DL50 cutanée (cochon d’Inde) : 26 mg/kg
- Génotoxicité : Bien que le crotonaldéhyde forme des adduits in vitro (en laboratoire), les preuves de mutagénicité in vivo sont moins claires.
- Le crotonaldéhyde est classé comme mutagène selon le règlement CLP (CE) n° 1272/2008.
Effets sur les animaux et les micro-organismes
- Animaux :
- Les poissons sont les espèces les plus sensibles au crotonaldéhyde, avec une CL50 sur 96 heures (concentration mortelle pour 50 % de la population) de 0,65 mg/L pour la truite arc-en-ciel.
- Le crotonaldéhyde irrite les voies respiratoires chez divers animaux, les rats étant les plus sensibles (CL50 par inhalation sur 4 heures de 120 ppm).
- Les micro-organismes sont moins sensibles que les animaux, Pseudomonas putida présentant une CE10 sur 18 heures (concentration avec effet pour 10 % de la population) de 10,4 mg/L.
Le crotonaldéhyde est classé parmi les polluants marins malgré sa forte biodégradabilité (> 83 %).
Références
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
- CROTONALDEHYDE; IARC MONOGRAPHS VOLUME 63. – https://publications.iarc.fr/81
