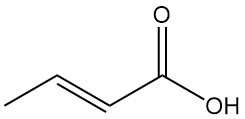
L’acide crotonique est l’isomère trans de l’acide 2-buténoïque. Il s’agit d’un acide carboxylique insaturé à chaîne courte de formule chimique CH3CH=CHCOOH. L’isomère cis de l’acide 2-buténoïque est connu sous le nom d’acide isocrotonique.
L’acide crotonique apparaît comme un solide blanc à jaunâtre avec une odeur piquante et suffocante, tandis que l’acide isocrotonique est un liquide huileux et incolore avec une odeur caractéristique ressemblant à la cassonade.
Le terme « acide crotonique » vient de l’huile de croton, une huile dérivée des graines de Croton tiglium. Initialement, l’acide crotonique a été identifié par erreur comme un produit formé lors de la saponification de cette huile.
L’acide crotonique peut être trouvé dans le distillat de bois brut et est produit comme métabolite lors de la dégradation des acides gras.
Table des matières
1. Propriétés physiques de l’acide crotonique
Une fois cristallisé, l’acide crotonique forme des aiguilles blanches, ou cristaux prismatiques, dans le système monoclinique. Il est légèrement soluble dans l’eau et soluble dans l’éthanol, l’acétone, l’acétate d’éthyle et le toluène, et forme un azéotrope avec l’eau contenant 96,86 % d’acide crotonique à 99,7 °C.
L’acide isocrotonique est miscible à l’eau et aux solvants polaires et forme un mélange eutectique avec l’acide crotonique (30 % d’acide crotonique), qui fond à -3°C.
Le tableau 1 résume certaines des propriétés physiques de l’acide crotonique et de l’acide isocrotonique.
| Propriété | Acide crotonique | Acide isocrotonique |
|---|---|---|
| Poids moléculaire | 86,09 g/mol | 86,09 g/mol |
| Point d'ébullition | 189 °C | 169°C |
| Point de fusion | 72°C | 15°C |
| Densité (20°C) | 1.018 | 1.0267 |
| Indice de réfraction | 1,4228 (80 °C) | 1,4456 (20 °C) |
| Solubilité dans l'eau, g/kg | 41,5 (0°C), 94 (25°C) | 656 (40°C), 1 260 (42°C) |
| Point d'éclair | 88 °C | - |
| Température d'auto-inflammation | 396 °C | - |
| Pression de vapeur | 24 Pa (20°C), 880 Pa (70°C) | - |
| Chaleur spécifique | 3,031 J g-1 K-1 (solide) 2,072 J g-1 K-1 (liquide) |
- |
| Chaleur de combustion | 2,00 MJ/mol | 2,03 MJ/mol |
| Chaleur de fusion | 150,9 J/g | - |
| pKa | 4,817 (25°C) | - |
2. Réactions chimiques de l’acide crotonique
L’acide crotonique est un acide faible dans les solutions aqueuses, il peut donc réagir avec des bases organiques et inorganiques.
L’acide crotonique subit diverses transformations lors du chauffage, de l’exposition à des acides, des bases, des rayons UV ou d’autres réactifs. Ces réactions comprennent l’isomérisation, l’oligomérisation et la polymérisation.
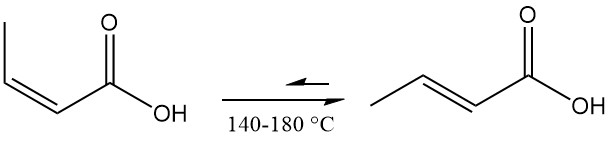
L’acide isocrotonique s’isomérise en acide crotonique, atteignant l’équilibre entre 140 et 180 °C. L’acide 3-buténoïque se forme comme sous-produit, le mélange final contenant un rapport acide isocrotonique/acide crotonique d’environ 0,17:1.
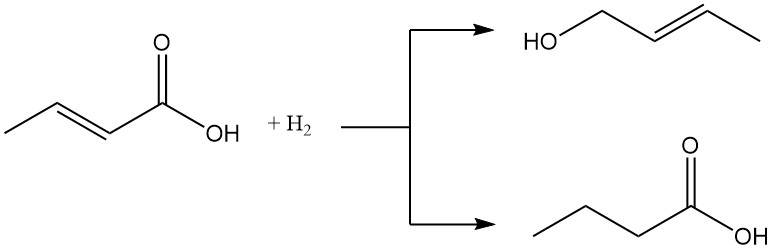
Les acides crotonique et isocrotonique peuvent être réduits en alcool crotylique ou en acide butyrique. A l’inverse, ils peuvent être oxydés en peracide correspondant.
L’acide crotonique copolymérise facilement avec divers monomères via un mécanisme radicalaire. Les copolymères avec l’acétate de vinyle sont importants sur le plan industriel.
Les réactions d’addition à la double liaison de l’acide crotonique donnent des acides butyriques 2-substitués ou 2,3-disubstitués.
L’hydrogénation catalytique convertit l’acide crotonique en acide butanoïque.
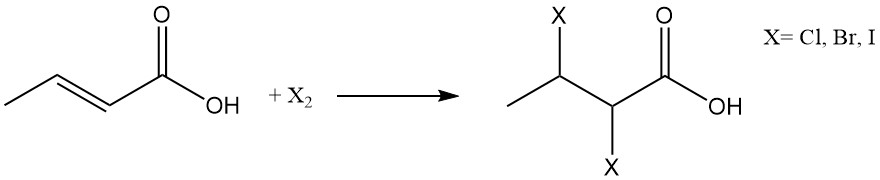
L’halogénation ou l’addition d’halogénures d’hydrogène conduit respectivement à la formation d’acides 2,3-dihalobutyriques ou d’acides 3-halobutyriques.
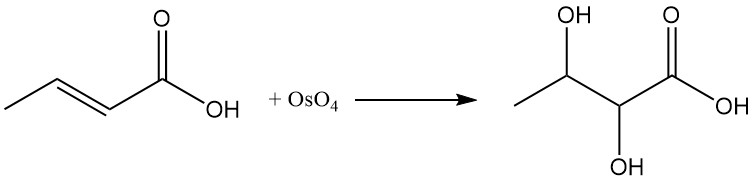
La réaction de l’acide crotonique avec le tétroxyde d’osmium (OsO4) ou l’acide peroxybenzoïque produit de l’acide 2,3-dihydroxybutanoïque.
Dans des conditions de réaction appropriées, l’addition d’ammoniac donne de l’acide β-aminobutyrique.
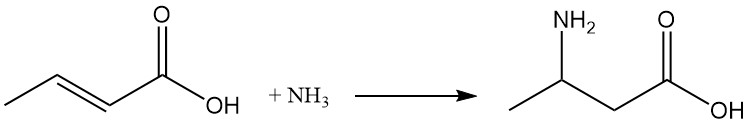
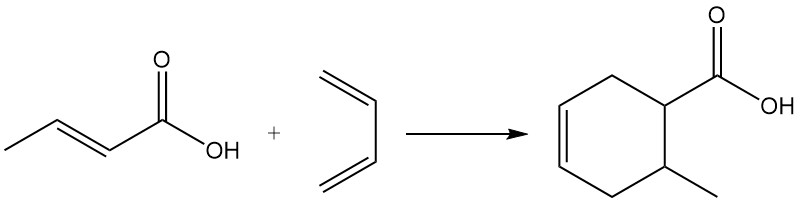
De par son caractère diénophile, l’acide crotonique participe aux réactions de Diels-Alder.
L’estérification de l’acide crotonique est possible en utilisant des méthodes conventionnelles. Cependant, la présence de la double liaison conjuguée conduit souvent à des vitesses de réaction plus lentes que celles de l’acide butyrique.
Les halogénures de crotonyle peuvent être synthétisés en faisant réagir l’acide crotonique avec l’halogénure d’acyle correspondant.
L’anhydride crotonique est obtenu soit par la réaction du chlorure de crotonyle avec le crotonate de sodium, soit par traitement de l’acide crotonique avec de l’anhydride acétique.
3. Production d’acide crotonique
L’acide crotonique est produit industriellement par oxydation du crotonaldéhyde. Ce processus est utilisé par des entreprises comme Weylchem Frankfurt et utilise une séquence de réaction en deux étapes :
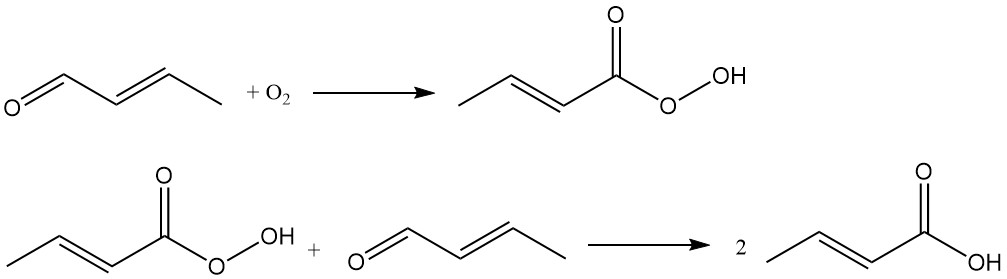
Le crotonaldéhyde subit une oxydation pour former de l’acide peroxocrotonique comme intermédiaire, qui réagit avec une autre molécule de crotonaldéhyde pour produire de l’acide crotonique.
La réaction se produit généralement à des températures et des pressions modérées (20 à 45 °C) (100 à 500 kPa). Des sels métalliques, notamment ceux de manganèse, de cobalt, de cuivre ou de thallium, sont ajoutés comme catalyseurs pour empêcher l’accumulation indésirable de peroxydes. Les sous-produits comprennent l’acide formique, l’acide acétique, l’eau et le dioxyde de carbone issus d’une oxydation complète.
Un procédé historique de Hoechst utilisait un catalyseur au sel de manganèse pour l’oxydation du crotonaldéhyde à 20-30 °C. Le mélange réactionnel résultant contenait environ :
- 20 à 30 % d’acide crotonique
- 1 à 3 % d’acide formique et acétique
- 3-5% d’eau
- Des traces d’acide 3-buténoïque, de composés inconnus et de 0,5 à 1 % d’acide isocrotonique
L’excès de crotonaldéhyde est récupéré par distillation sous vide et recyclé dans la réaction. Le résidu de distillation, riche en acide crotonique (60 à 70 %), subit une purification supplémentaire via une seconde distillation sous vide.
La fraction à bas point d’ébullition et les résidus sont jetés comme déchets. La fraction principale du produit contient de l’acide crotonique avec un peu d’acide isocrotonique (3 à 5 %). La cristallisation fractionnée est ensuite utilisée pour éliminer l’acide isocrotonique, produisant ainsi de l’acide crotonique de haute pureté (jusqu’à 99,9 %).
Alors que la production industrielle repose sur l’oxydation du crotonaldéhyde, plusieurs méthodes alternatives existent pour la synthèse de l’acide crotonique à l’échelle du laboratoire. Ceux-ci inclus:
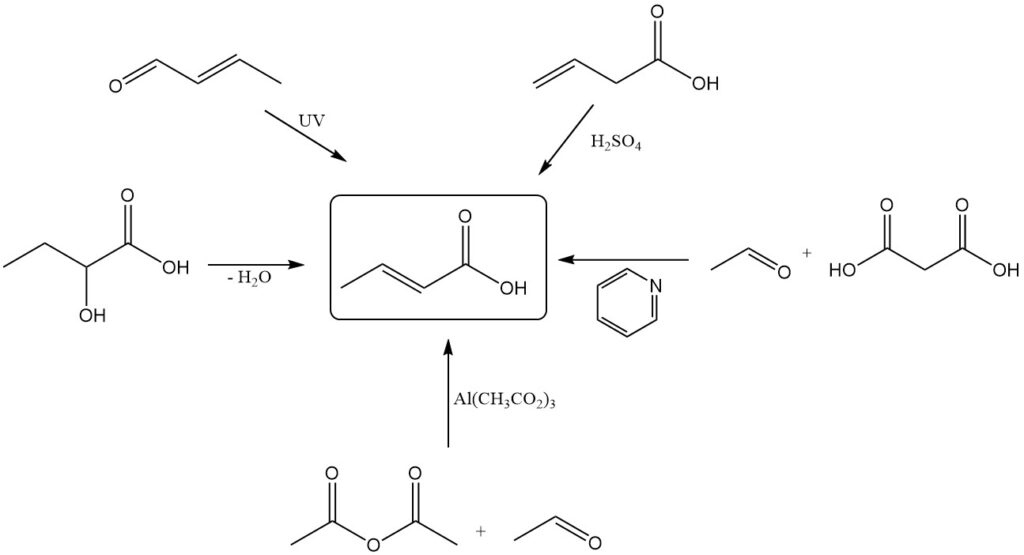
- Déshydratation de l’acide 2-hydroxybutanoïque
- Oxydation photochimique ou irradiation oxydative (avec ultrasons) du crotonaldéhyde
- Isomérisation de l’acide vinylacétique avec de l’acide sulfurique
- Condensation de l’acétaldéhyde et de l’acide malonique en utilisant la pyridine comme catalyseur
- Oxydation du butène avec un système catalyseur à base d’acide hétéropolymolybdique
- Oxycarbonylation du propène avec des catalyseurs complexes de métaux de transition
- Carbonylation de l’oxyde de propylène
- Réaction de l’anhydride acétique avec l’acétaldéhyde à l’aide d’un catalyseur basique à base d’acétate d’aluminium
- Carbonylation de l’alcool allylique avec des catalyseurs à base de nickel ou de palladium
L’acide isocrotonique peut être séparé de mélanges contenant de l’acide crotonique à l’aide de techniques telles que la cristallisation fractionnée, la rectification (distillation) ou la chromatographie par filtration sur gel.
Une méthode stéréospécifique pour la préparation en laboratoire de l’acide isocrotonique implique la bromation de 2-butanone (méthyléthylcétone), suivi d’un réarrangement de Favorskii.
4. Utilisations de l’acide crotonique
La principale application de l’acide crotonique est la production de copolymères avec divers comonomères. Les copolymères acide crotonique-acétate de vinyle revêtent une importance industrielle. Ces copolymères sont souvent commercialisés sous des noms commerciaux comme Mowilith, Vinnapas et Vinac.
Les copolymères d’acide crotonique sont utilisés dans les peintures, les revêtements, les peintures thermofusibles, les adhésifs et les adhésifs thermofusibles. Ils sont également utilisés pour le revêtement du papier et des textiles, comme floculants, liants pour explosifs, céramiques et produits agrochimiques, et comme additifs de forage.
Les autres applications de l’acide crotonique incluent :
- En tant qu’agent antimicrobien sous forme d’ester pour les déodorants.
- Dans les absorbeurs UV et les pigments interférentiels à effet métallique.
- Les esters d’alcool gras de l’acide crotonique sont utilisés dans l’industrie du cuir.
- L’acide libre a des applications dans les carburants automobiles, la gravure de surfaces métalliques, le dépôt électrochimique de métaux et la stabilisation thermique du PVC.
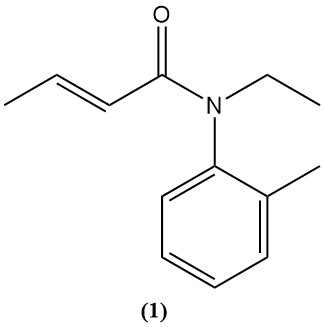
L’acide crotonique et ses dérivés, tels que l’anhydride et le chlorure, servent de précurseurs à divers produits agrochimiques et pharmaceutiques. Un exemple est le crotamiton (1), un médicament utilisé pour traiter la gale (scabicide) et soulager les démangeaisons (antiprurigineux).
5. Toxicologie de l’acide crotonique
L’acide crotonique est une substance corrosive et peut provoquer de graves irritations ou des brûlures au contact des yeux, de la peau ou des voies respiratoires.
L’inhalation peut entraîner une sensation de brûlure, de la toux, des maux de tête, des nausées, des maux de gorge et un essoufflement (les symptômes peuvent être retardés).
L’ingestion provoque des douleurs, une sensation de brûlure, des maux de gorge, de la diarrhée et des vomissements.
Les données toxicologiques issues d’études animales sont répertoriées ci-dessous :
- DL50 (rat, orale) : 1000 mg/kg
- DL50 (rat, i.p.) : 100 mg/kg
- DL50 (lapin, cutanée) : 600 mg/kg
Le corps peut produire naturellement de l’acide crotonique au cours du métabolisme des graisses et le décomposer rapidement par les enzymes du foie et d’autres tissus. Il est peu probable que l’exposition à des concentrations non irritantes provoque des effets cumulatifs.
L’acide crotonique peut affecter la croissance des plantes et la germination des graines.
Référence
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2


