Tétrahydrofurane (THF) : propriétés, réactions, production et utilisations
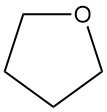
Le tétrahydrofurane (THF), également connu sous le nom d’oxolane, est un éther cyclique de formule chimique C4H8O. Il a une large application dans l’industrie chimique.
Table des matières
1. Propriétés physiques du tétrahydrofurane
Le tétrahydrofurane (THF) est un liquide polaire incolore, volatil disponible dans le commerce avec une pureté minimale de 99,9 % en poids (une fois distillé). Il possède une odeur caractéristique semblable à celle de l’acétone. Le THF est complètement miscible avec l’eau, les alcools, les éthers et autres solvants courants.
Le tableau 1 présente quelques propriétés physiques du THF.
| Propriété | Valeur |
|---|---|
| Masse molaire | 72,1 g/mol |
| Point d'ébullition | 66 °C |
| Point de fusion | -108,5 °C |
| Température critique | 267 °C |
| Pression critique | 5,19 MPa |
| Densité critique | 0,322 g/cm3 |
| Densité à 20 °C | 0,886 |
| Indice de réfraction à 20 °C | 1.4073 |
| Capacité thermique spécifique | 1,765 J g⁻¹ K⁻¹ |
| Chaleur de vaporisation (66 °C, 101,3 kPa) | 435 J/kg |
| Chaleur de combustion | -35 141 kJ/kg |
| Limites d'explosivité dans l'air (25 °C) | 1,5 % en volume (inférieur), 12,0 % en volume (supérieur) |
| Point éclair (Abel-Pensky) | -22 °C |
| Moment dipolaire | 5,84 × 10⁻³⁰ C m |
| Constante diélectrique (20 °C) | 7.6 |
2. Réactions chimiques du tétrahydrofurane
Le tétrahydrofurane est une matière première précieuse pour des réactions importantes. Ceux-ci incluent la polymérisation cationique avec ouverture de cycle simultanée du THF pour produire des éthers de glycol bifonctionnels de poids moléculaire élevé avec différentes longueurs de chaîne.
Ces produits revêtent une importance économique dans la production de plastiques essentiels. De plus, les réactions de clivage cyclique du tétrahydrofurane sont la base de la déshydratation en butadiène, de l’oxydation en acide succinique, et carboxylation en acide adipique ou γ-valérolactone.
Le THF est le milieu réactionnel préféré pour réaliser des réactions ou des réductions de Grignard à l’aide de réactifs comme LiAlH4. Il est également utilisé comme ligand dans des complexes de coordination, tels que ceux parfois utilisés dans les polymérisations stéréospécifiques.
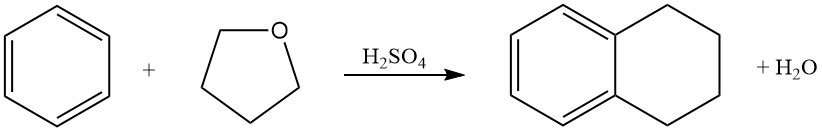
Le benzène réagit avec le tétrahydrofurane dans l’acide sulfurique pour produire de la tétraline (1,2,3,4-tétrahydronaphtalène).
Cependant, le THF réagit facilement avec l’oxygène (par exemple, au contact de l’air), formant un hydroperoxyde instable comme produit principal. L’ajout d’hydroquinone ou de 2,6-di-tert-butyl-p-crésol (BHT) (par exemple 250 mg/kg) peut inhiber la formation de peroxyde. La distillation des peroxydes contenant du tétrahydrofurane concentre les peroxydes, entraînant un risque élevé d’explosion, même à l’échelle du laboratoire.
3. Production de tétrahydrofurane
3.1. Production de tétrahydrofurane à partir d’acétylène et de formaldéhyde
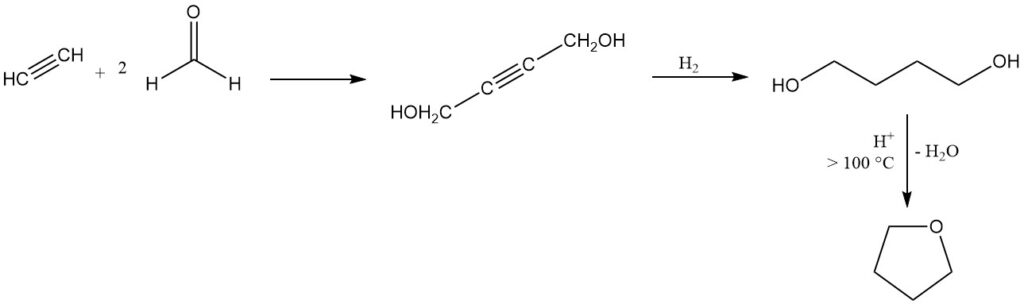
Le tétrahydrofurane est produit par le procédé Reppe, développé dans les années 1930, qui reste une méthode industrielle dominante en Europe et aux États-Unis.
Dans ce processus, l’acétylène réagit avec le formaldéhyde pour produire du 2-butyne-1,4-diol, suivi d’une hydrogénation en 1,4-butanediol qui subit ensuite une cyclisation catalysée par un acide avec élimination de l’eau au-dessus de 100 °C pour donner du THF.
Plusieurs catalyseurs conviennent à cette cyclisation, notamment les acides inorganiques, les aluminosilicates acides et les oxydes de métaux terreux ou de terres rares. Une conversion presque quantitative et un rendement proche de 100 % peuvent être obtenus dans un processus continu sous pression atmosphérique utilisant de l’alumine comme catalyseur.
Cela nécessite une distillation continue du tétrahydrofurane formé hors du mélange réactionnel tout en fournissant simultanément du 1,4-butanediol pur à un taux de consommation correspondant. Cette méthode présente une efficacité catalytique élevée, permettant une production importante de THF par unité de catalyseur.
BASF avait développé un procédé à moyenne pression pour la conversion sélective du butanediol brut en THF avec un minimum d’énergie supplémentaire.
Le mélange THF-vapeur obtenu à partir de la cyclisation est d’abord rectifié pour isoler l’azéotrope correspondant (5,3 % en poids d’eau, point d’ébullition 62,3 °C), qui est traité avec de l’hydroxyde alcalin, suivi d’une distillation pour obtenir du THF anhydre.
Les procédés industriels permettent de s’affranchir de la formation de mélanges azéotropiques par distillation sous pression.
3.2. Production de tétrahydrofurane par acétoxylation du butadiène
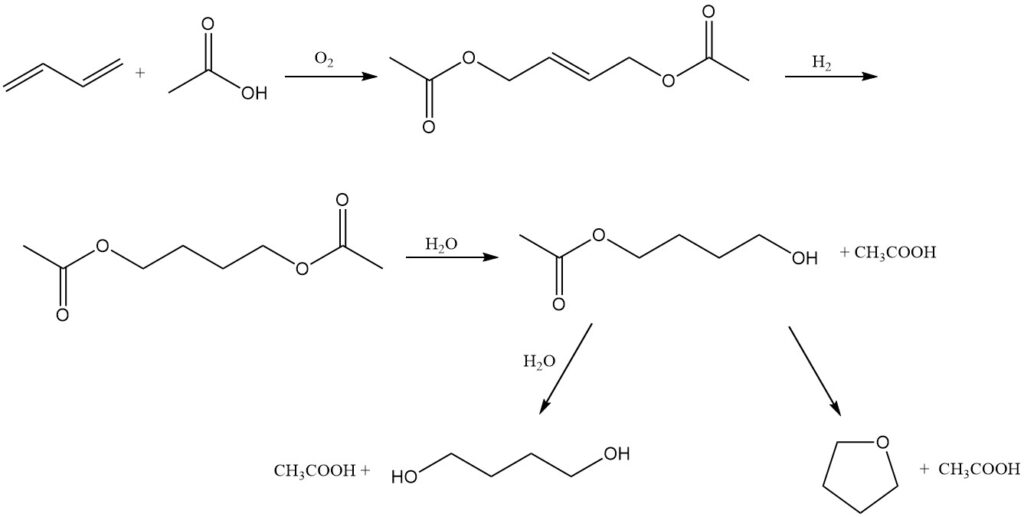
Mitsubishi-Kasei Corporation au Japon propose une voie alternative pour la coproduction de 1,4-butanediol et de tétrahydrofurane, en utilisant le butadiène comme matière première. Ce processus peut s’expliquer par les réactions suivantes :
Oxydation : Le butadiène subit une oxydation à 3 MPa et 80 °C en présence d’un catalyseur palladium-tellure, acide acétique et un mélange azote-oxygène. Cette réaction donne du 1,4-diacétoxy-2-butène.
Hydrogénation : Le 1,4-diacétoxy-2-butène obtenu est ensuite hydrogéné pour former du 1,4-diacétoxybutane.
Hydrolyse : Enfin, le 1,4-diacétoxybutane est hydrolysé en 1,4-butanediol ou THF.
3.3. Production de tétrahydrofurane par procédé à l’oxyde de propylène
Arco produit du 1,4-butanediol selon un processus qui comprend les étapes suivantes :
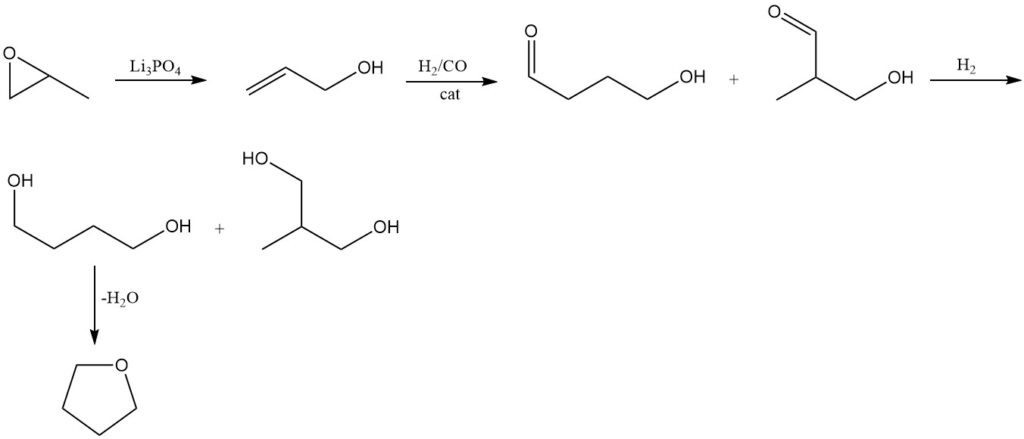
L’oxyde de propylène est isomérisé en alcool allylique à l’aide de méthodes conventionnelles à 250 – 300 °C et pression de 1 MPa sur un catalyseur d’orthophosphate de trilithium (Li3PO4).
L’alcool allylique obtenu subit une hydroformylation selon le procédé Kuraray. Cette réaction produit du 4-hydroxybutyraldéhyde comme produit principal ainsi que du 3-hydroxy-2-méthylpropionaldéhyde comme sous-produit.
L’hydrogénation ultérieure des aldéhydes obtenus forme le 1,4-butanediol comme produit principal, accompagné de la formation de 2-méthyl-1,3-propanediol.
Comme dans les méthodes précédentes, le tétrahydrofurane est produit par déshydratation du 1,4-butanediol à l’aide d’un catalyseur acide.
3.4. Production de tétrahydrofurane par hydrogénation de l’anhydride maléique
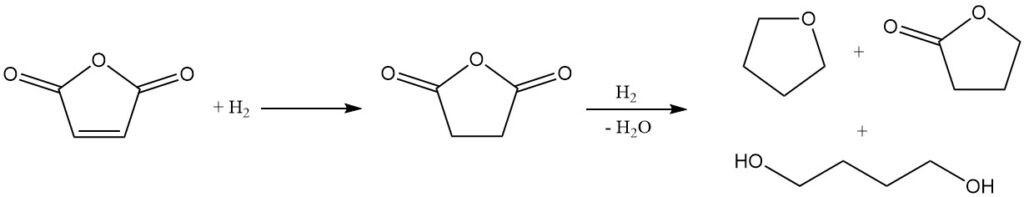
En raison de sa structure chimique, l’anhydride maléique est une matière première prometteuse pour la synthèse du butanediol, du THF et de la γ-butyrolactone. Mitsubishi-Kasei a initialement développé et mis en œuvre un procédé à l’échelle industrielle utilisant l’anhydride maléique. Cependant, ils ont depuis abandonné cette méthode au profit de leur nouveau procédé d’acétoxylation du butadiène.
Plusieurs sociétés, dont Davy-McKee Ltd., BP, Sohio et Shinwha Petrochemical, ont adopté des procédés similaires pour la production de butanediol et de tétrahydrofurane. Par exemple, Shinwha Petrochemical en Corée du Sud exploite une usine basée sur le procédé McKee, d’une capacité de 20 000 tonnes de butanediol par an.
La première étape de ce processus est l’hydrogénation en phase vapeur du maléate d’éthyle. Les conditions de réaction peuvent être manipulées pour contrôler le rapport THF/butanediol dans le mélange de produits final.
L’utilisation de l’anhydride maléique comme matière première pour la production de tétrahydrofurane suscite un intérêt croissant, et il semble gagner du terrain en tant que substitut potentiel au procédé Reppe.
3.5. Production de tétrahydrofurane par le procédé n-butane-anhydride maléique
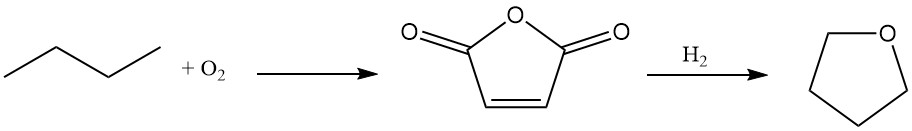
Du Pont propose un nouveau procédé en deux étapes pour la synthèse du tétrahydrofurane utilisant le n-butane comme matière première.
Le n-Butane est oxydé en anhydride maléique avec un rendement élevé (70 à 75 %) à l’aide d’un catalyseur d’oxydation unique, transportable et résistant à l’abrasion.
La solution aqueuse d’acide maléique résultante subit une hydrogénation sur un catalyseur spécialisé au palladium dopé au rhénium. Cette étape offre une flexibilité, permettant la production sélective de butanediol ou de THF en fonction des exigences du processus.
Le processus a été testé avec succès et mis en œuvre dans la province espagnole des Asturies, avec une capacité de production annuelle de 45 000 tonnes.
3.6. Production de tétrahydrofurane par les procédés Pentosan/Furfural
L’intérêt pour la production de tétrahydrofurane à partir du furfural s’est accru en raison de l’utilisation de ressources renouvelables. Les pentosanes, abondants dans les déchets agricoles, sont les matières premières.
Le processus de production de THF à partir du furfural implique deux étapes catalytiques :
- Le furfural subit une décarbonylation catalytique pour former du furane.
- Le furane est ensuite hydrogéné pour produire du THF.
4. Utilisations du tétrahydrofurane
Le tétrahydrofurane est utilisé dans divers secteurs, le plus grand volume étant celui de monomère pour le poly(oxyde de tétraméthylène) (PTMO), également connu sous le nom de poly(éther de tétraméthylène). glycol) (PTMEG) ou le polytétrahydrofuranne (PTHF). PTMO est un élément important dans la production de :
- Polyuréthanes thermoplastiques
- Fibres élastiques
- Élastomères moulés
- Copolyesters
- Copolyamides
- Revêtements en polyuréthane
Le PTMO commercial est disponible sous divers noms commerciaux, notamment Terathane (DuPont), Polytetrahydrofuran (BASF) et Polymeg (Quaker Oats).
Une plus petite partie du THF est utilisée comme solvant pour des applications telles que les revêtements, les adhésifs et les vernis spéciaux à base de matériaux tels que le poly(chlorure de vinyle) (PVC) ou les polyuréthanes. et comme cosolvant dans les encres d’imprimerie, comme agent d’extraction et comme milieu réactionnel, notamment pour les synthèses organométalliques en chimie organique.
C’est également un réactif de laboratoire courant et un intermédiaire dans les synthèses chimiques de produits de consommation et industriels tels que les produits nutritionnels, pharmaceutiques et insecticides.
5. Toxicologie du tétrahydrofurane
Des recherches approfondies menées par l’Institut d’hygiène industrielle et de pharmacologie de BASF suggèrent que le THF présente une toxicité minimale, comparable à celle de l’acétone, contrairement aux rapports antérieurs probablement basés sur des échantillons impurs.
Les études animales impliquant une exposition chronique (1 an à 1 000 ppm, 2 ans à 3 000 ppm) au THF n’ont pas révélé de symptômes d’intoxication significatifs chez les rats, les chats ou les lapins. Cependant, ces concentrations (1 000 à 3 000 ppm) provoqueraient une grave irritation des muqueuses chez l’homme.
Semblable à l’éthanol, le THF est rapidement métabolisé par l’organisme.
En raison de ses fortes propriétés solvantes, le tétrahydrofurane dissout les couches externes de kératine de la peau et des muqueuses, pénétrant rapidement dans les tissus plus profonds. Cette caractéristique entraîne une irritation sévère mais n’entraîne pas de sensibilisation (réaction allergique).
La formation de peroxyde pendant le stockage peut exacerber l’irritation cutanée et le contact avec les plaies ou sous les ongles peut provoquer une douleur importante.
Le THF est facilement absorbé par la peau, comme le méthanol. Un contact prolongé avec la peau doit être évité et une protection appropriée des mains est recommandée.
La limite d’exposition établie sur le lieu de travail pour le tétrahydrofurane est de 200 ppm (mL/m³). Cette valeur est définie pour répondre à l’irritation locale des muqueuses causée par les vapeurs de THF, et non à ses effets narcotiques, qui nécessitent des concentrations beaucoup plus élevées.
Références
- Tetrahydrofuran, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_221.pub3
- Polyethers, Tetrahydrofuran and Oxetane Polymers; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.2005201816182103.a01
- Tetrahydrofuran; Hamilton & Hardy’s Industrial Toxicology. – https://onlinelibrary.wiley.com/doi/10.1002/9781118834015.ch70
