Réactions Chimiques dans les Processus Industriels

Les réactions chimiques sont un aspect fondamental de nombreux procédés industriels.
Ces réactions impliquent la transformation d’une ou plusieurs substances en nouveaux produits, et elles peuvent être utilisées pour produire une grande variété de matériaux, notamment des carburants, des plastiques, des produits pharmaceutiques et bien d’autres.
Comprendre les principes des réactions chimiques est crucial pour les ingénieurs et les chimistes qui conçoivent et optimisent les procédés industriels.
Il existe plusieurs types de réactions chimiques qui se produisent dans les processus industriels, notamment la combustion, les réactions d’oxydo-réduction, la polymérisation, l’hydrogénation, la carbonylation, l’acylation, l’alkylation, la nitration, la déshydrogénation, l’estérification et la sulfonation.
Table des matières
1. Réactions de combustion
Les réactions de combustion peuvent être classées en deux catégories : la combustion complète et la combustion incomplète. Lors d’une combustion complète, le carburant est complètement brûlé, ne produisant que du dioxyde de carbone et de l’eau comme produits finaux.
En revanche, une combustion incomplète se produit lorsque le carburant ne brûle pas complètement, produisant un mélange de monoxyde de carbone, de suie et d’autres polluants.

Dans les procédés industriels, la combustion complète est souhaitable, car elle produit le maximum d’énergie et le moins de pollution. Cependant, il peut être difficile d’obtenir une combustion complète, en particulier lors de la combustion de combustibles difficiles à allumer ou dont l’efficacité de combustion est faible.
Pour optimiser les réactions de combustion, plusieurs facteurs doivent être pris en compte, notamment la stoechiométrie de la réaction, la température de combustion et le mélange du combustible et de l’agent oxydant.
La stoechiométrie de la réaction fait référence au rapport des réactifs nécessaires pour obtenir une combustion complète. La température de combustion est également critique car elle affecte la vitesse de la réaction et la qualité des produits finaux.
Le mélange du combustible et de l’agent oxydant est également essentiel car il affecte l’efficacité de la réaction et la qualité des produits finaux.
Outre les processus industriels, les réactions de combustion sont également impliquées dans de nombreux phénomènes naturels, tels que les incendies de forêt et les éruptions volcaniques.
Ces réactions peuvent avoir des impacts environnementaux importants, tels que la pollution de l’air et le réchauffement climatique.
Pour réduire l’impact environnemental des réactions de combustion, de nombreux efforts sont déployés pour améliorer l’efficacité de la combustion et développer des technologies plus propres et moins polluantes.
2. Réactions d’oxydoréduction
Les réactions d’oxydo-réduction, également appelées réactions redox, impliquent le transfert d’électrons entre deux espèces. Dans une réaction d’oxydation, une espèce perd des électrons, tandis que dans une réaction de réduction, une espèce gagne des électrons.

Ces réactions sont essentielles dans de nombreux processus industriels, tels que la production de métaux, la galvanoplastie et la production de produits chimiques et de carburants. Les utilisations industrielles importantes des réactions électrochimiques sont la production d’hydroxyde de sodium par électrolyse de NaCl, la production d’autres hydroxydes de métaux alcalins et la production d’eau de Javel.
Les réactions redox peuvent être classées comme spontanées ou non spontanées, selon qu’elles se produisent naturellement ou nécessitent un apport d’énergie pour se poursuivre.
Les réactions redox spontanées sont celles qui se produisent sans aucun apport d’énergie externe et sont souvent utilisées dans les batteries et autres dispositifs de stockage d’énergie.
Les réactions redox non spontanées, en revanche, nécessitent une source d’énergie externe pour se dérouler et sont utilisées dans l’électrolyse et d’autres processus chimiques.
Un exemple courant de réaction redox est la rouille du fer, qui a été mentionnée précédemment. Dans cette réaction, le fer réagit avec l’oxygène pour produire de l’oxyde de fer, qui est la substance familière brun rougeâtre que nous appelons la rouille.
La rouille est un exemple de réaction d’oxydation, où le fer perd des électrons au profit de l’oxygène. Cette réaction est importante car elle est la principale cause de corrosion des métaux, qui peut être coûteuse à réparer ou à remplacer.
Un autre exemple de réaction redox est la production de chlore gazeux, qui est utilisé dans la production de plastiques et d’autres matériaux. Le chlore gazeux est produit par l’électrolyse de l’eau salée, qui est une réaction redox non spontanée qui nécessite une source d’énergie externe pour se poursuivre.
Dans cette réaction, les ions chlorure de l’eau salée sont oxydés pour produire du chlore gazeux et de l’hydrogène gazeux. Le chlore gazeux est un puissant agent oxydant et est utilisé dans de nombreux processus industriels, y compris la production de pesticides, de produits pharmaceutiques et de plastiques.
3. Réactions de polymérisation
Les réactions de polymérisation sont un type de réaction chimique où les molécules de monomères sont chimiquement liées ensemble pour former une chaîne polymère. Le polymère résultant peut avoir une large gamme de propriétés et d’applications, des plastiques et des fibres synthétiques aux adhésifs et revêtements.

Il existe deux principaux types de réactions de polymérisation : la polymérisation par addition et la polymérisation par condensation. En plus de la polymérisation, les monomères à double liaison réagissent les uns avec les autres pour former une chaîne polymère.
La réaction est généralement initiée par un catalyseur ou par la chaleur, et le polymère résultant est une longue chaîne avec des unités répétitives du monomère d’origine. La polymérisation par condensation, quant à elle, implique la réaction de deux monomères différents avec un groupe fonctionnel qui réagit pour former une liaison covalente.
Dans ce type de réaction, une petite molécule, telle que l’eau, est généralement produite en tant que sous-produit.
Les réactions de polymérisation sont utilisées dans un large éventail d’applications industrielles, de la production de plastiques et de fibres synthétiques au développement de nouveaux matériaux pour les implants médicaux et l’administration de médicaments.
Un exemple de réaction de polymérisation est la production de polyéthylène, qui est le plastique le plus largement utilisé dans le monde. Le polyéthylène est produit par la polymérisation par addition de monomères d’éthylène, ce qui donne un polymère à longue chaîne qui peut être utilisé dans une large gamme d’applications, des emballages aux matériaux de construction.
Un autre exemple de réaction de polymérisation est la production de nylon, qui est une fibre synthétique utilisée dans les textiles et d’autres applications.
Le nylon est produit par la polymérisation par condensation de deux monomères, l’hexaméthylènediamine et l’acide adipique, qui réagissent pour former une chaîne polymère.
Le nylon est connu pour sa résistance et sa durabilité et est utilisé dans un large éventail d’applications, des vêtements aux pièces automobiles.
4. Réactions d’oxydation
Une réaction d’oxydation est une réaction dans laquelle une molécule perd des électrons. Cela va souvent de pair avec un gain d’atomes d’oxygène, mais pas toujours. Voici un aperçu des principaux aspects :
- Transfert d’électrons : le principe fondamental de l’oxydation est la perte d’électrons d’une molécule. Considérez cela comme la suppression des charges négatives, rendant la molécule plus « positive ».
- Connexion à l’oxygène : bien que souvent associée à l’obtention d’atomes d’oxygène, une réaction d’oxydation ne l’exige pas strictement. Cependant, l’oxygène est un oxydant courant en raison de sa forte électronégativité, ce qui signifie qu’il a une grande affinité pour attirer les électrons.
Différents oxydants utilisés dans l’industrie chimique, comme l’oxygène moléculaire (O2), le peroxyde d’hydrogène (H2O2) et le chlore (Cl2), acceptent les électrons de la molécule cible. Le choix du comburant dépend de facteurs tels que le coût, la sélectivité et les conditions de réaction.
Les catalyseurs industriels accélèrent la réaction sans être eux-mêmes consommés. Les métaux de transition comme le cuivre, le manganèse et le vanadium sont fréquemment utilisés. Ils peuvent améliorer la sélectivité, réduire la consommation d’énergie et améliorer l’efficacité des processus.
Les réactions d’oxydation sont utilisées dans différentes industries :
1. Production de produits chimiques en vrac :
- L’acide acrylique est important pour les fibres acryliques et les peintures et pour les adhésifs. Il est produit par oxydation du propylène avec de l’air sur des catalyseurs à base d’oxyde métallique.
- L’acide téréphtalique est l’élément constitutif des plastiques PET ; il est fabriqué par oxydation en phase liquide du p-xylène à l’aide d’air ou d’oxygène.
- L’acide nitrique est utilisé dans la production d’engrais, d’explosifs et de nylon. Il est synthétisé via le procédé Ostwald, impliquant l’oxydation de l’ammoniac avec de l’air sur des catalyseurs platine-rhodium.
2. Chimie fine et pharmaceutique :
- Oxydations sélectives : la modification précise de groupes fonctionnels spécifiques dans des molécules complexes est cruciale pour la synthèse de produits pharmaceutiques. Les enzymes ou les catalyseurs de métaux de transition permettent des oxydations ciblées avec un minimum de réactions secondaires.
- Hydroxylations : l’introduction de groupes hydroxyles est vitale pour de nombreux produits pharmaceutiques. Des méthodes telles que la dihydroxylation asymétrique de Sharpless utilisent des catalyseurs chiraux pour un stéréocontrôle élevé.
3. Assainissement de l’environnement :
- Traitement des eaux usées : l’oxydation avec de l’ozone ou des peroxydes désinfecte efficacement l’eau et dégrade les polluants organiques.
- Désulfuration des gaz de combustion : l’élimination des oxydes de soufre des émissions des centrales électriques implique un lavage humide avec des oxydants comme l’hydroxyde de calcium.
5. Réaction d’hydrogénation
Une réaction d’hydrogénation est un type spécifique de réaction de réduction dans lequel une molécule gagne des atomes d’hydrogène. Cela se produit souvent en présence d’un catalyseur et entraîne la saturation des liaisons insaturées, généralement des doubles ou triples liaisons, dans la molécule en réaction.
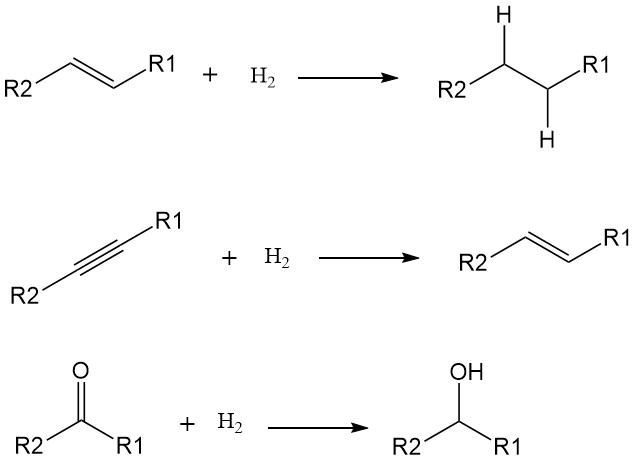
L’ajout d’atomes d’hydrogène (H) à une molécule augmente sa saturation et réduit sa réactivité. Bien que certaines hydrogénations puissent se produire à des températures élevées sans catalyseurs, leur utilisation réduit considérablement l’énergie d’activation et accélère la réaction dans des conditions plus douces.
Les métaux de transition comme le nickel, le palladium et le platine sont des catalyseurs courants d’hydrogénation.
Les hydrogénations ciblent généralement les doubles et triples liaisons, les convertissant en liaisons simples. Les exemples comprennent:
- Alcènes en alcanes : transformation d’hydrocarbures insaturés comme l’éthylène (C2H4) en hydrocarbures saturés comme l’éthane (C2H6).
- Alcynes en alcènes : conversion d’hydrocarbures à triple liaison comme l’acétylène (C2H2) en alcènes à double liaison comme l’éthylène.
- Groupes carbonyle en alcools : réduction des cétones et des aldéhydes avec des groupes carbonyle (C=O) en alcools avec des groupes hydroxyle (OH).
Les réactions d’hydrogénation sont utilisées dans diverses industries, notamment :
- Traitement des huiles végétales : durcissement des huiles liquides en convertissant les graisses insaturées en graisses saturées pour la production de margarine.
- Raffinage du carburant : désulfuration et amélioration de la qualité de l’essence et des carburants diesel.
- Production pharmaceutique : synthèse de divers produits pharmaceutiques et produits chimiques fins.
L’hydrogénation est également utilisée dans :
- Industrie agroalimentaire : transformation des graisses et des huiles pour les produits alimentaires.
- Polymérisation : création de polymères aux propriétés spécifiques.
- Pile à combustible à hydrogène : convertit l’hydrogène et l’oxygène en électricité.
6. Réaction de carbonylation
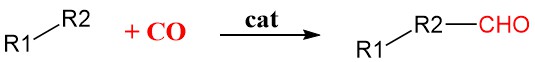
La carbonylation est une méthode générale de synthèse organique qui ajoute du monoxyde de carbone (CO) dans des molécules organiques à l’aide de catalyseurs de métaux de transition tels que le rhodium, l’iridium, le palladium ou le nickel. Ces catalyseurs fixent et activent la molécule de CO, la rendant plus réactive et lui permettant de s’incorporer au substrat organique.
Il s’agit d’une réaction hautement sélective, ce qui signifie qu’elle peut ajouter avec précision la molécule de CO à la position souhaitée dans la molécule avec un minimum de réactions secondaires.
Cela le rend précieux pour la production d’un large éventail de produits chimiques importants, notamment :
- Acide acétique : plus de 70 % de l’acide acétique synthétique mondial est produit à partir de carbonylation du méthanol catalysée par l’iridium ou le rhodium.
- Dérivés d’acides aminés : l’amidocarbonylation est un domaine d’intérêt croissant pour la création de dérivés d’acides aminés précieux utilisés dans les produits pharmaceutiques et d’autres industries.
- Intermédiaires pharmaceutiques : la carbonylation des halogénures aromatiques apparaît comme une procédure standard pour créer des éléments constitutifs importants pour les médicaments et autres molécules bioactives.
7. Réaction d’acylation
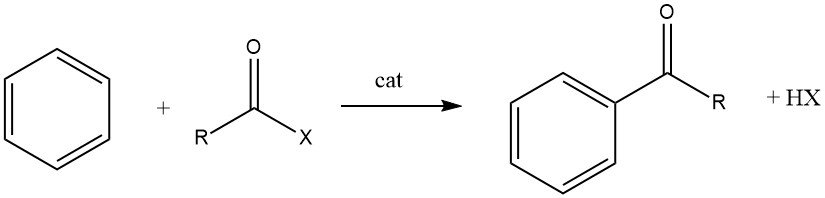
L’acylation de Friedel-Crafts implique la production d’une cétone aromatique par la réaction entre un composé aromatique et un agent acylant, qui peut être un halogénure d’acyle, un anhydride d’acide, un acide ou un ester. Cette réaction a lieu en présence d’un catalyseur acide.
L’acylation des substrats aromatiques revêt une importance industrielle significative car elle est utilisée pour la synthèse d’intermédiaires aromatiques largement utilisés dans la fabrication de produits pharmaceutiques, d’insecticides, de plastifiants, de colorants, de parfums et de divers autres produits commerciaux. Ces composés spéciaux sont généralement produits à plus petite échelle que les produits alkylés.
| Agent acylant | Composé aromatique | Produit | Utilisation finale |
|---|---|---|---|
| Anhydride acétique | benzène | acétophénone | parfums, produits pharmaceutiques, solvants, plastifiants |
| Anhydride acétique | toluène | 4-méthylacétophénone | parfums |
| Anhydride acétique | anisole | 4-méthoxyacétophénone | parfums |
| Anhydride acétique | isobutylbenzène | 4-isobutylactophénone | produits pharmaceutiques |
| Chlorure de dichloroacétyle | 1,2-dichlorobenzène | α,α,2,4-tétrachloroacétophénone | insecticides |
| Chlorobutyroyle | fluorobenzène | chloropropyl 4-fluorophényl cétone | produits pharmaceutiques |
| Tétrachlorométhane | benzène | benzophénone | produits pharmaceutiques, insecticides, parfums |
| Chlorure de benzoyle | benzène | benzophénone | |
| Phosgène | N,N-diméthylaniline | 4,4'-bis-diméthylaminobenzophénone | colorants |
| Anhydride phtalique | benzène | Acide 2-benzoylbenzoïque | anthraquinone |
8. Réaction d’alkylation
L’alkylation Friedel-Crafts des composés aromatiques implique une substitution électrophile catalysée par un acide, dans laquelle un groupe alkyle remplace un hydrogène aromatique. Une gamme diversifiée d’agents alkylants, tels que des oléfines, des halogénures d’alkyle et des alcools, est couramment utilisée à cette fin.
Cette réaction peut être appliquée à divers substrats aromatiques, notamment des composés hétéroaromatiques et même des composés comme le ferrocène. Ces réactions sont généralement rapides et exothermiques, et elles sont souvent conduites dans des conditions douces en phase liquide.
Cependant, dans certains cas, des procédés en phase vapeur soumis à des conditions plus strictes sont utilisés pour certains substrats. Lorsque des oléfines, des halogénures d’alkyle et des alcools sont utilisés comme agents alkylants, les réactions globales se déroulent comme suit :
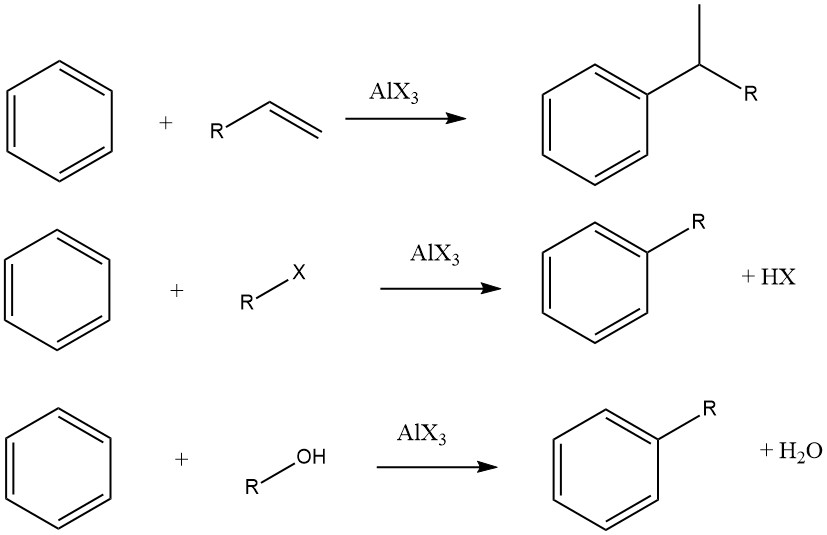
Le degré d’isomérisation du fragment alkyle et le respect de la règle de Markovnikov pendant le processus d’addition varient en fonction de l’acidité du catalyseur.
Des exemples d’utilisations de réactions d’alkylation sont la production d’éthylbenzène, de cumène et d’alkylbenzènes à partir du benzène, l’alkylation du toluène avec du propène pour produire du cymène; l’alkylation de phénols pour produire des alkylphénols; et l’alkylation de divers composés aromatiques hétérocycliques, notamment les furanes, les thiophènes et les N-hétérocycles.
9. Réaction de nitration
La réaction de nitration est l’introduction irréversible d’un ou plusieurs groupements nitro (NO2) dans un noyau aromatique, en remplacement d’un atome d’hydrogène.
La nitration est une réaction de substitution électrophile, représentée par l’équation suivante :
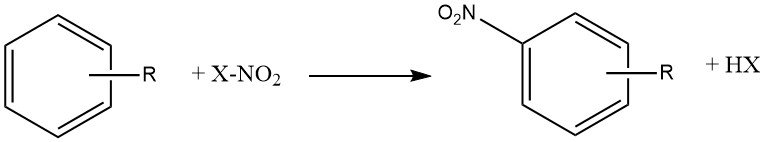
L’introduction du groupe nitro désactive le cycle vers une substitution électrophile supplémentaire, ce qui rend la dinitration un événement rare dans les conditions utilisées pour la mononitration.
Des conditions plus vigoureuses sont généralement nécessaires pour la dinitration, nécessitant un excès d’acide plus fort et une température plus élevée. Ces conditions sont souvent appliquées à des composés mononitro isolés, plutôt que d’effectuer des réactions par étapes in situ.
La réaction de nitration est fortement exothermique, comme en témoigne la mononitration du benzène (ΔH = -117 kJ/mol) et du naphtalène (ΔH = -209 kJ/mol). Par conséquent, il s’agit de l’un des processus unitaires industriels les plus potentiellement dangereux.
Les principaux produits de nitration sont des composés nitroaromatiques monosubstitués, qui se forment lorsqu’un groupe nitro est introduit dans le noyau aromatique. Les produits industriels importants issus de la nitration peuvent inclure :
- Nitrobenzène (C6H5NO2)
- Nitrotoluènes (par exemple, ortho-nitrotoluène, méta-nitrotoluène et para-nitrotoluène)
- Nitronaphtalènes (par exemple, alpha-nitronaphtalène et bêta-nitronaphtalène)
- Nitrophénols (par exemple, ortho-nitrophénol, méta-nitrophénol et para-nitrophénol)
- Nitroanilines (par exemple, ortho-nitroaniline, méta-nitroaniline et para-nitroaniline)
10. Réaction de déshydrogénation
La déshydrogénation, à l’opposé de l’hydrogénation, fait référence à une réaction chimique dans laquelle l’hydrogène (H) est éliminé de une molécule, généralement organique. Ce processus apparemment simple joue un rôle crucial dans divers aspects de la chimie, depuis les réactions fondamentales de laboratoire jusqu’aux processus industriels à grande échelle.
Cette réaction implique la rupture d’une liaison C-H, libérant du gaz H2, et est souvent endothermique, nécessitant de la chaleur ou des catalyseurs spécifiques pour surmonter la barrière énergétique d’activation.
La déshydrogénation est une réaction importante dans l’industrie chimique utilisée pour :
1. Production de produits chimiques précieux : La déshydrogénation est essentielle pour fabriquer de nombreux produits, comme :
- Styrène : monomère pour plastiques polystyrène, produit par déshydrogénation de l’éthylbenzène.
- Alcènes : hydrocarbures insaturés utilisés pour d’autres réactions dans la production de polymères, de carburants et de lubrifiants.
- Chimie fine : les produits pharmaceutiques, agrochimiques et autres molécules spécialisées impliquent souvent des étapes de déshydrogénation.
2. Dans le secteur de l’énergie, la déshydrogénation catalytique des hydrocarbures légers offre un potentiel de production de carburant plus propre par rapport aux méthodes traditionnelles.
3. Déshydratation : L’élimination de l’eau (H2O) des alcools est un cas particulier de déshydrogénation, formant des alcènes en éliminant une molécule d’eau.
11. Réaction d’estérification
L’estérification est la réaction réversible entre des acides carboxyliques et des alcools pour produire un ester et de l’eau en présence d’un catalyseur.
La réaction d’estérification se déroule selon un mécanisme en trois étapes :
- Protonation : un catalyseur acide de Brønsted protone l’oxygène carbonyle de l’acide carboxylique, renforçant ainsi son caractère électrophile.
- Attaque nucléophile : L’atome d’oxygène de l’alcool, agissant comme un nucléophile, attaque le carbone carbonyle électrophile, formant un intermédiaire tétraédrique.
- Déprotonation et perte d’eau : L’intermédiaire subit une déprotonation, souvent par le catalyseur, suivie d’une élimination de l’eau, conduisant à la formation de l’ester. et de l’eau comme sous-produit.
L’estérification est une réaction d’équilibre, et le principe de Le Chatelier dicte des stratégies pour améliorer le rendement en esters. L’utilisation d’un excès d’alcool, l’élimination de l’eau (par exemple, par distillation) et l’optimisation de la température peuvent tous déplacer l’équilibre vers la formation d’esters.
La réaction d’estérification a de nombreuses applications :
- Parfums et cosmétiques : Les esters contribuent de manière significative aux arômes agréables des fruits, des fleurs et des parfums.
- Produits pharmaceutiques : de nombreux médicaments, notamment l’aspirine et la pénicilline, intègrent des fonctionnalités esters.
- Polymères : les polyesters, une classe de polymères, sont formés via des réactions d’estérification et sont utilisés dans divers plastiques et fibres synthétiques.
- Biocarburants : l’estérification est utilisée dans la production de biocarburants comme le biodiesel.
- Additifs alimentaires : Les esters contribuent à la texture et à la saveur de certains produits alimentaires.
12. Réaction de sulfonation
La sulfonation est une réaction organique polyvalente qui introduit le groupe acide sulfonique (-SO2OH) sur les composés aromatiques. Cette transformation revêt une importance significative dans divers domaines, notamment la synthèse de détergents, de colorants et de produits pharmaceutiques.
La sulfonation se déroule généralement via un mécanisme de substitution aromatique électrophile (EAS). Les étapes clés impliquent :
- Formation de l’électrophile : Trioxyde de soufre (SO3) ou acide sulfurique fumant (H2SO4 + SO3) agit comme agent sulfonant, générant la molécule électrophile SO3.
- Substitution électrophile aromatique : l’électrophile SO3 attaque le nuage π riche en électrons du cycle aromatique, formant un intermédiaire complexe σ.
- Protonation et désulfonation : L’intermédiaire perd un proton, conduisant à la formation du produit acide arylsulfonique.
Cependant, la sulfonation est souvent réversible. Dans des conditions acides et des températures élevées, le groupe acide sulfonique peut subir une désulfonation, libérant le composé aromatique parent et du dioxyde de soufre.
La sulfonation trouve de nombreuses applications dans la synthèse de diverses molécules industriellement et biologiquement pertinentes :
- Détergents : le dodécylbenzènesulfonate de sodium (SDS), un tensioactif anionique largement utilisé, est produit par sulfonation du dodécylbenzène.
- Colorants : les colorants azoïques sulfonés présentent des couleurs vives et sont utilisés dans diverses applications textiles.
- Produits pharmaceutiques : les sulfamides, une classe d’antibiotiques, dépendent de la présence d’un groupe acide sulfonique pour leur activité antibactérienne.
Au-delà de ces exemples, la sulfonation joue un rôle important dans la synthèse de nombreux autres composés, notamment les résines échangeuses d’ions, les additifs alimentaires et les produits agrochimiques.
Références
Callister, W.D., & Rethwisch, D.G. (2018). Science et génie des matériaux: une introduction . Wiley.
En ligneChang, R. (2010). Chimie (10e éd.). McGraw-Hill.
En ligneEmsley, J. (2011). Les blocs de construction de la nature : un guide de A à Z des éléments. Presse universitaire d’Oxford.
En ligneGreen, J. (2018). Une introduction à l’industrie des procédés chimiques. Presse CRC.
Kiehl, J.T. (2013). Procédés chimiques industriels : une introduction. John Wiley et fils.
Meyers, RA (éd.). (2001). Encyclopédie de chimie analytique. Wiley.
Seader, J.D., & Henley, E.J. (2011). Principes du processus de séparation. Wiley.
Smith, J.M., Van Ness, H.C. et Abbott, M.M. (2005). Introduction à la thermodynamique du génie chimique (7e éd.). McGraw-Hill.
Sperling, LH (éd.). (2018). Introduction à la science physique des polymères (4e éd.). Wiley.
Turton, R., Bailie, R.C., Whiting, W.B. et Shaeiwitz, J.A. (2018). Analyse, synthèse et conception des processus chimiques (5e éd.). Person.
