Chemische reacties zijn een fundamenteel aspect van veel industriële processen. Deze reacties omvatten de transformatie van een of meer stoffen in nieuwe producten en ze kunnen worden gebruikt om een breed scala aan materialen te produceren, waaronder brandstoffen, kunststoffen, farmaceutische producten en vele andere.
Het begrijpen van de principes achter chemische reacties is cruciaal voor ingenieurs en chemici die industriële processen ontwerpen en optimaliseren.
Er zijn verschillende soorten chemische reacties die voorkomen in industriële processen, waaronder verbranding, oxidatie-reductiereacties, polymerisatie, hydrogenering, carbonylering, acylering, alkylering, nitrering, dehydrogenering, verestering en sulfonering.
Inhoudsopgave
1. Verbrandingsreacties
Verbrandingsreacties kunnen worden ingedeeld in twee categorieën: volledige verbranding en onvolledige verbranding. Bij volledige verbranding wordt de brandstof volledig verbrand, waarbij alleen koolstofdioxide en water als eindproducten worden geproduceerd.
Daarentegen treedt onvolledige verbranding op wanneer de brandstof niet volledig verbrandt, waarbij een mengsel van koolstofmonoxide, roet en andere verontreinigende stoffen wordt geproduceerd.

Bij industriële processen is volledige verbranding wenselijk omdat het de maximale hoeveelheid energie en de minste hoeveelheid vervuiling produceert. Het bereiken van volledige verbranding kan echter een uitdaging zijn, vooral bij het verbranden van brandstoffen die moeilijk te ontsteken zijn of een lage verbrandingsefficiëntie hebben.
Om verbrandingsreacties te optimaliseren, moeten verschillende factoren in overweging worden genomen, waaronder de stoichiometrie van de reactie, de verbrandingstemperatuur en de menging van de brandstof en het oxidatiemiddel.
De stoichiometrie van de reactie verwijst naar de verhouding van de reactanten die nodig zijn om volledige verbranding te bereiken. De verbrandingstemperatuur is ook kritisch omdat het de snelheid van de reactie en de kwaliteit van de eindproducten beïnvloedt.
De menging van de brandstof en het oxidatiemiddel is ook essentieel omdat het de efficiëntie van de reactie en de kwaliteit van de eindproducten beïnvloedt.
Naast industriële processen zijn verbrandingsreacties ook betrokken bij veel natuurlijke fenomenen, zoals bosbranden en vulkaanuitbarstingen. Deze reacties kunnen aanzienlijke gevolgen hebben voor het milieu, zoals luchtvervuiling en opwarming van de aarde.
Om de impact van verbrandingsreacties op het milieu te verminderen, worden er veel inspanningen geleverd om de efficiëntie van verbranding te verbeteren en schonere technologieën te ontwikkelen die minder vervuilende stoffen produceren.
2. Oxidatie-reductiereacties
Oxidatie-reductiereacties, ook wel redoxreacties genoemd, omvatten de overdracht van elektronen tussen twee soorten. Bij een oxidatiereactie verliest een soort elektronen, terwijl bij een reductiereactie een soort elektronen wint.

Deze reacties zijn essentieel in veel industriële processen, zoals metaalproductie, galvaniseren en de productie van chemicaliën en brandstoffen. Belangrijke industriële toepassingen van elektrochemische reacties zijn de productie van natriumhydroxide door elektrolyse van NaCl, de productie van andere alkalimetaalhydroxiden en de productie van bleekmiddel.
Redoxreacties kunnen worden geclassificeerd als spontaan of niet-spontaan, afhankelijk van of ze op natuurlijke wijze plaatsvinden of energie-input vereisen om te verlopen. Spontane redoxreacties zijn reacties die plaatsvinden zonder externe energie-input en worden vaak gebruikt in batterijen en andere energieopslagapparaten.
Niet-spontaan redoxreacties vereisen daarentegen een externe energiebron om te verlopen en worden gebruikt in elektrolyse en andere chemische processen.
Een veelvoorkomend voorbeeld van een redoxreactie is het roesten van ijzer, dat eerder werd genoemd. Bij deze reactie reageert ijzer met zuurstof om ijzeroxide te produceren, wat de bekende roodbruine substantie is die we roest noemen.
Roesten is een voorbeeld van een oxidatiereactie, waarbij ijzer elektronen verliest aan zuurstof. Deze reactie is belangrijk omdat het de primaire oorzaak is van corrosie in metalen, wat duur kan zijn om te repareren of vervangen.
Een ander voorbeeld van een redoxreactie is de productie van chloorgas, dat wordt gebruikt bij de productie van kunststoffen en andere materialen. Chloorgas wordt geproduceerd door de elektrolyse van zout water, wat een niet-spontane redoxreactie is die een externe energiebron nodig heeft om te kunnen verlopen.
Bij deze reactie worden chloride-ionen uit zout water geoxideerd om chloorgas en waterstofgas te produceren. Chloorgas is een krachtig oxidatiemiddel en wordt gebruikt in veel industriële processen, waaronder de productie van pesticiden, farmaceutische producten en kunststoffen.
3. Polymerisatiereacties
Polymerisatiereacties zijn een type chemische reactie waarbij monomeermoleculen chemisch aan elkaar worden gebonden om een polymeerketen te vormen. Het resulterende polymeer kan een breed scala aan eigenschappen en toepassingen hebben, van kunststoffen en synthetische vezels tot kleefstoffen en coatings.

Er zijn twee hoofdtypen polymerisatiereacties: additiepolymerisatie en condensatiepolymerisatie. Bij additiepolymerisatie reageren monomeren met een dubbele binding met elkaar om een polymeerketen te vormen.
De reactie wordt doorgaans geïnitieerd door een katalysator of hitte, en het resulterende polymeer is een lange keten met herhalende eenheden van het oorspronkelijke monomeer. Condensatiepolymerisatie daarentegen omvat de reactie van twee verschillende monomeren met een functionele groep die reageert om een covalente binding te vormen. Bij dit type reactie wordt doorgaans een klein molecuul, zoals water, geproduceerd als bijproduct.
Polymerisatiereacties worden gebruikt in een breed scala aan industriële toepassingen, van de productie van kunststoffen en synthetische vezels tot de ontwikkeling van nieuwe materialen voor medische implantaten en medicijnafgifte.
Een voorbeeld van een polymerisatiereactie is de productie van polyethyleen, het meest gebruikte plastic ter wereld. Polyethyleen wordt geproduceerd door de additiepolymerisatie van ethyleenmonomeren, wat resulteert in een langketenpolymeer dat kan worden gebruikt in een breed scala aan toepassingen, van verpakkingen tot bouwmaterialen.
Een ander voorbeeld van een polymerisatiereactie is de productie van nylon, een synthetische vezel die wordt gebruikt in textiel en andere toepassingen. Nylon wordt geproduceerd door de condensatiepolymerisatie van twee monomeren, hexamethyleendiamine en adipinezuur, die reageren om een polymeerketen te vormen. Nylon staat bekend om zijn sterkte en duurzaamheid en wordt gebruikt in een breed scala aan toepassingen, van kleding tot auto-onderdelen.
4. Oxidatiereacties
Een oxidatiereactie is een reactie waarbij een molecuul elektronen verliest. Dit gaat vaak hand in hand met de winst van zuurstofatomen, maar niet altijd. Hier is een overzicht van de belangrijkste aspecten:
- Elektronenoverdracht: Het kernprincipe van oxidatie is het verlies van elektronen uit een molecuul. Beschouw het als het verwijderen van negatieve ladingen, waardoor het molecuul “positiever” geladen wordt.
- Zuurstofverbinding: Hoewel het vaak geassocieerd wordt met het verkrijgen van zuurstofatomen, is het voor een oxidatiereactie niet strikt noodzakelijk. Zuurstof is echter een veelvoorkomende oxidator vanwege zijn sterke elektronegativiteit, wat betekent dat het een hoge affiniteit heeft om elektronen aan te trekken.
Verschillende oxidatoren die in de chemische industrie worden gebruikt, zoals moleculaire zuurstof, waterstofperoxide en chloor, accepteren elektronen van het doelmolecuul. De keuze van de oxidator hangt af van factoren zoals kosten, selectiviteit en reactieomstandigheden.
Industriële katalysatoren versnellen de reactie zonder zelf verbruikt te worden. Overgangsmetalen zoals koper, mangaan en vanadium worden vaak gebruikt. Ze kunnen de selectiviteit verbeteren, het energieverbruik verminderen en de procesefficiëntie verbeteren.
De oxidatiereacties worden in verschillende industrieën gebruikt:
1. Productie van bulkchemicaliën:
- Acrylzuur is belangrijk voor acrylvezels, verf en lijm. Het wordt geproduceerd door oxidatie van propyleen met lucht over metaaloxidekatalysatoren.
- Tereftaalzuur is de bouwsteen van PET-kunststoffen; het wordt geproduceerd door oxidatie van p-xyleen in de vloeibare fase met behulp van lucht of zuurstof.
- Salpeterzuur wordt gebruikt in meststoffen, explosieven en de productie van nylon. Het wordt gesynthetiseerd via het Ostwald-proces, waarbij ammoniak wordt geoxideerd met lucht over platina-rhodiumkatalysatoren.
2. Fijne chemicaliën en farmaceutica:
- Selectieve oxidaties: het nauwkeurig veranderen van specifieke functionele groepen in complexe moleculen is cruciaal voor het synthetiseren van farmaceutica. Enzymen of overgangsmetaalkatalysatoren maken gerichte oxidaties mogelijk met minimale nevenreacties.
- Hydroxyleringen: Het introduceren van hydroxylgroepen is essentieel voor veel farmaceutische producten. Methoden zoals Sharpless asymmetrische dihydroxylering gebruiken chirale katalysatoren voor hoge stereocontrole.
3. Sanering van het milieu:
- Afvalwaterbehandeling: Oxidatie met ozon of peroxiden desinfecteert water effectief en breekt organische verontreinigende stoffen af.
- Ontzwaveling van rookgasontzwaveling: Het verwijderen van zwaveloxiden uit emissies van elektriciteitscentrales omvat natte reiniging met oxidanten zoals calciumhydroxide.
5. Hydrogeneringsreactie
Een hydrogeneringsreactie is een specifiek type reductiereactie waarbij een molecuul waterstofatomen krijgt. Dit gebeurt vaak in aanwezigheid van een katalysator en resulteert in de verzadiging van onverzadigde bindingen, meestal dubbele of driedubbele bindingen, in het reagerende molecuul.
De toevoeging van waterstofatomen (H) aan een molecuul verhoogt de verzadiging en vermindert de reactiviteit. Hoewel sommige hydrogeneringen kunnen plaatsvinden bij hoge temperaturen zonder katalysatoren, verlaagt het gebruik ervan de activeringsenergie aanzienlijk en versnelt het de reactie onder mildere omstandigheden. Overgangsmetalen zoals nikkel, palladium en platina zijn veelvoorkomende katalysatoren voor hydrogenering.
Hydrogeneringen richten zich doorgaans op dubbele en driedubbele bindingen en zetten deze om in enkele bindingen. Voorbeelden zijn onder andere:
- Alkenen naar alkanen: Het omzetten van onverzadigde koolwaterstoffen zoals ethyleen in verzadigde koolwaterstoffen zoals ethaan.
- Alkynen naar alkenen: Het omzetten van drievoudig gebonden koolwaterstoffen zoals acetyleen in dubbelgebonden alkenen zoals ethyleen.
- Carbonylgroepen naar alcoholen: Het reduceren van ketonen en aldehyden met carbonylgroepen (C=O) tot alcoholen met hydroxylgroepen (OH).
Hydrogeneringsreacties worden gebruikt in verschillende industrieën, waaronder:
- Verwerking van plantaardige olie: het harden van vloeibare oliën door onverzadigde vetten om te zetten in verzadigde vetten voor de productie van margarine.
- Brandstof raffinage: ontzwavelen en verbeteren van de kwaliteit van benzine en dieselbrandstoffen.
- Farmaceutische productie: synthetiseren van verschillende farmaceutische producten en fijne chemicaliën.
Hydrogenering wordt ook gebruikt in:
- Voedings- en drankenindustrie: verwerken van vetten en oliën voor voedingsproducten.
- Polymerisatie: creëren van polymeren met specifieke eigenschappen.
- Waterstofbrandstofcellen: omzetten van waterstof en zuurstof in elektriciteit.
6. Carbonyleringsreactie
Carbonylering is een algemene methode in organische synthese die koolmonoxide (CO) toevoegt aan organische moleculen met behulp van overgangsmetaalkatalysatoren zoals rhodium, iridium, palladium of nikkel. Deze katalysatoren binden en activeren het CO-molecuul, waardoor het reactiever wordt en kan worden opgenomen in het organische substraat.
Het is een zeer selectieve reactie, wat betekent dat het het CO-molecuul nauwkeurig kan toevoegen aan de gewenste positie in het molecuul met minimale nevenreacties.
Dit maakt het waardevol voor de productie van een breed scala aan belangrijke chemicaliën, waaronder:
- Azijnzuur: Meer dan 70% van het synthetische azijnzuur ter wereld wordt geproduceerd met behulp van rhodium- of iridium-gekatalyseerde methanolcarbonylering.
- Aminozuurderivaten: Amidocarbonylering is een groeiend interessegebied voor het creëren van waardevolle aminozuurderivaten die worden gebruikt in farmaceutische en andere industrieën.
- Farmaceutische tussenproducten: carbonylering van aromatische haliden ontwikkelt zich tot een standaardprocedure voor het creëren van belangrijke bouwstenen voor geneesmiddelen en andere bioactieve moleculen.
7. Acyleringsreactie
De Friedel-Crafts-acylering omvat de productie van een aromatisch keton door de reactie tussen een aromatische verbinding en een acyleringsmiddel, dat een acylhalide, een zuuranhydride, een zuur of een ester kan zijn. Deze reactie vindt plaats in aanwezigheid van een zure katalysator.
De acylering van aromatische substraten is van groot industrieel belang, omdat het wordt gebruikt voor de synthese van aromatische tussenproducten die veelvuldig worden gebruikt bij de productie van farmaceutische producten, insecticiden, weekmakers, kleurstoffen, parfums en diverse andere commerciële producten. Deze speciale verbindingen worden doorgaans op kleinere schaal geproduceerd in vergelijking met gealkyleerde producten.
| Acyleringsmiddel | Aromatische verbinding | Product | Eindgebruik |
|---|---|---|---|
| Azijnzuuranhydride | benzeen | acetofenon | parfums, farmaceutica, oplosmiddel, weekmaker |
| Azijnzuuranhydride | tolueen | 4-methylacetofenon | parfums |
| Azijnzuur anhydride | anisole | 4-methoxyacetofenon | parfums |
| Azijnzuuranhydride | isobutylbenzeen | 4-isobutylactofenon | farmaceutica |
| Dichlooracetylchloride | 1,2-dichloorbenzeen | α,α,2,4-tetrachlooracetofenon | insecticiden |
| Chloorbutyroylchloride | fluorbenzeen | chloorpropyl 4-fluorofenylketon | farmaceutica |
| Tetrachloormethaan | benzeen | benzofenon | farmaceutica, insecticiden, parfums |
| Benzoylchloride | benzeen | benzofenon | |
| Fosgeen | N,N-dimethylaniline | 4,4'-bis-dimethylaminobenzofenon | kleurstoffen |
| Ftaalzuur anhydride | benzeen | 2-benzoylbenzoëzuur | antrachinon |
8. Alkyleringsreactie
De Friedel-Crafts-alkylering van aromatische verbindingen omvat een zuurgekatalyseerde elektrofiele substitutie, waarbij een alkylgroep een aromatische waterstof vervangt. Een breed scala aan alkyleringsmiddelen, zoals olefinen, alkylhalogeniden en alcoholen, wordt hiervoor vaak gebruikt.
Deze reactie kan worden toegepast op verschillende aromatische substraten, waaronder heteroaromatische verbindingen en zelfs verbindingen zoals ferroceen. Deze reacties zijn doorgaans snel en exotherm en worden vaak uitgevoerd onder milde omstandigheden in de vloeibare fase.
In sommige gevallen worden echter dampfaseprocessen met strengere omstandigheden gebruikt voor bepaalde substraten. Wanneer olefinen, alkylhalogeniden en alcoholen worden gebruikt als alkyleringsmiddelen, verlopen de algehele reacties als volgt:
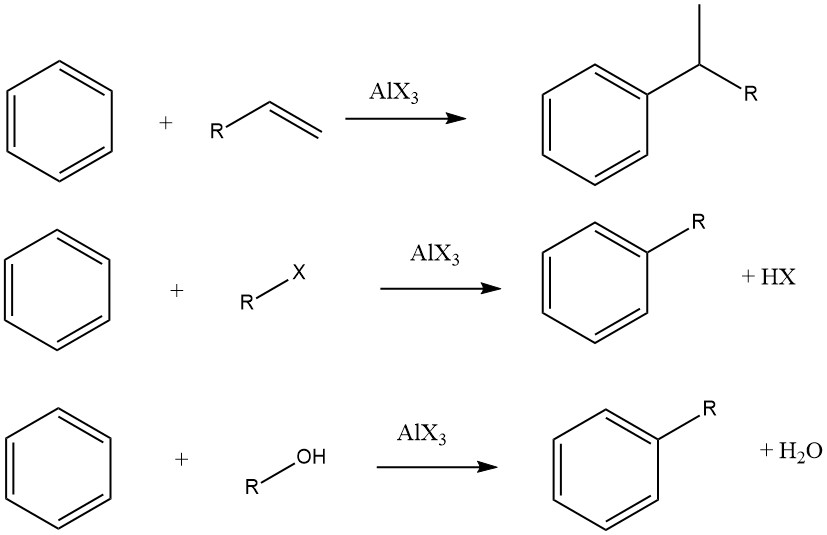
De mate van isomerisatie van de alkylgroep en naleving van de Markovnikov-regel tijdens het additieproces variëren afhankelijk van de zuurgraad van de katalysator.
Voorbeelden van toepassingen van alkyleringsreacties zijn de productie van ethylbenzeen, cumeen en alkylbenzenen uit benzeen, de alkylering van tolueen met propeen om cymeen te produceren; de alkylering van fenolen om alkylfenolen te produceren; en de alkylering van verschillende heterocyclische aromatische verbindingen, waaronder furanen, thiofenen en N-heterocyclische verbindingen.
9. Nitratiereactie
De reactie van nitratie is de onomkeerbare introductie van een of meer nitrogroepen (NO2) in een aromatische kern, ter vervanging van een waterstofatoom.
Nitratie is een elektrofiele substitutiereactie, weergegeven door de volgende vergelijking:
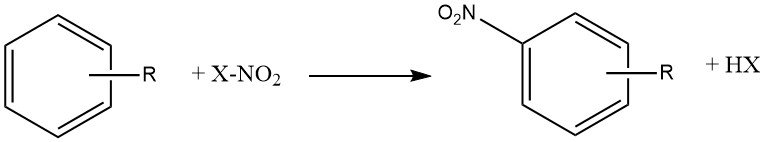
De introductie van de nitrogroep deactiveert de ring voor verdere elektrofiele substitutie, waardoor dinitratie een zeldzame gebeurtenis is onder de omstandigheden die worden gebruikt voor mononitratie.
Dinitriatie vereist doorgaans krachtigere omstandigheden, wat overmaat, sterker zuur en hogere temperaturen vereist. Deze omstandigheden worden vaak toegepast op geïsoleerde mononitroverbindingen, in plaats van stapsgewijze reacties in situ uit te voeren.
De nitratiereactie is zeer exotherm, zoals blijkt uit de mononitratie van benzeen (ΔH = -117 kJ/mol) en naftaleen (ΔH = -209 kJ/mol). Bijgevolg is het een van de potentieel gevaarlijkste industriële eenheidsprocessen.
De primaire producten van nitratie zijn monogesubstitueerde nitroaromatische verbindingen, die worden gevormd wanneer één nitrogroep in de aromatische kern wordt geïntroduceerd. Belangrijke industriële producten van nitratie kunnen zijn:
- Nitrobenzeen (C6H5NO2)
- Nitrotoluenen (bijv. ortho-nitrotolueen, meta-nitrotolueen en para-nitrotolueen)
- Nitronaftaleenen (bijv. alfa-nitronaftaleen en bèta-nitronaftaleen)
- Nitrofenolen (bijv. ortho-nitrofenol, meta-nitrofenol en para-nitrofenol)
- Nitroanilines (bijv. ortho-nitroaniline, meta-nitroaniline en para-nitroaniline)
10. Dehydrogeneringsreactie
Dehydrogenering, het tegenovergestelde van hydrogenering, verwijst naar een chemische reactie waarbij waterstof (H) wordt verwijderd uit een molecuul, meestal organisch. Dit ogenschijnlijk eenvoudige proces speelt een cruciale rol in verschillende aspecten van de chemie, van fundamentele laboratoriumreacties tot grootschalige industriële processen.
Deze reactie omvat het verbreken van een C-H-binding, het vrijkomen van H2-gas en is vaak endotherm, waarbij warmte of specifieke katalysatoren nodig zijn om de activeringsenergiebarrière te overwinnen.
Dehydrogenering is een belangrijke reactie in de chemische industrie die wordt gebruikt voor:
1. Productie van waardevolle chemicaliën: Dehydrogenering is essentieel voor het maken van talloze producten, zoals:
- Styreen: monomeer voor polystyreenkunststoffen, geproduceerd door ethylbenzeendehydrogenering.
- Alkenen: onverzadigde koolwaterstoffen die worden gebruikt voor verdere reacties in de productie van polymeren, brandstoffen en smeermiddelen.
- Fijne chemicaliën: Farmaceutica, agrochemicaliën en andere gespecialiseerde moleculen omvatten vaak dehydrogeneringsstappen.
2. In de energiesector biedt katalytische dehydrogenering van lichte koolwaterstoffen potentieel voor schonere brandstofproductie in vergelijking met traditionele methoden.
3. Dehydratie: Het verwijderen van water (H2O) uit alcoholen is een speciaal geval van dehydrogenering, het vormen van alkenen door het elimineren van een watermolecuul.
11. Veresteringsreactie
Verestering is de omkeerbare reactie tussen carbonzuren en alcoholen om een ester en water te produceren in aanwezigheid van een katalysator.
De veresteringsreactie verloopt via een mechanisme in drie stappen:
- Protonering: Een Brønsted-zuurkatalysator protoneert de carbonylzuurstof van het carbonzuur, waardoor het elektrofiele karakter ervan wordt versterkt.
- Nucleofiele aanval: Het zuurstofatoom van de alcohol, dat als nucleofiel fungeert, valt de elektrofiele carbonylkoolstof aan en vormt een tetraëdrische tussenstof.
- Deprotonering en waterverlies: Het tussenproduct ondergaat deprotonering, vaak door de katalysator, gevolgd door watereliminatie, wat leidt tot de vorming van de ester en water als bijproduct.
Esterificatie is een evenwichtsreactie en het principe van Le Chatelier dicteert strategieën om de esteropbrengst te verbeteren. Het gebruik van overtollige alcohol, het verwijderen van water (bijv. via destillatie) en het optimaliseren van de temperatuur kunnen allemaal het evenwicht verschuiven richting estervorming.
De veresteringsreactie heeft wijdverbreide toepassingen:
- Geurstoffen en cosmetica: Esters dragen aanzienlijk bij aan de aangename aroma’s van fruit, bloemen en parfums.
- Farmaceutica: Talrijke medicijnen, waaronder aspirine en penicilline, bevatten esterfunctionaliteiten.
- Polymeren: Polyesters, een klasse polymeren, worden gevormd via veresteringsreacties en worden gebruikt in verschillende kunststoffen en synthetische vezels.
- Biobrandstoffen: Verestering wordt gebruikt bij de productie van biobrandstoffen zoals biodiesel.
- Voedsel Additieven: Esters dragen bij aan de textuur en smaak van bepaalde voedingsproducten.
12. Sulfoneringsreactie
Sulfonering is een veelzijdige organische reactie die de sulfonzuurgroep (-SO2OH) introduceert op aromatische verbindingen. Deze transformatie is van groot belang in verschillende vakgebieden, waaronder de synthese van detergenten, kleurstoffen en farmaceutische producten.
Sulfonering verloopt doorgaans via een elektrofiel aromatisch substitutiemechanisme (EAS). De belangrijkste stappen zijn:
- Vorming van de elektrofiel: Zwaveltrioxide (SO3) of rokend zwavelzuur (H2SO4 + SO3) fungeert als het sulfoneringsmiddel en genereert het elektrofiele SO3-molecuul.
- Aromatische elektrofiele substitutie: De SO3-elektrofiel valt de elektronenrijke π-wolk van de aromatische ring aan en vormt een σ-complex intermediair.
- Protonering en desulfonering: De intermediair verliest een proton, wat leidt tot de vorming van het arylsulfonzuurproduct.
Sulfonering is echter vaak omkeerbaar. Onder zure omstandigheden en verhoogde temperaturen kan de sulfonzuurgroep desulfonering ondergaan, waarbij de oorspronkelijke aromatische verbinding en zwaveldioxide vrijkomen.
Sulfonering vindt talrijke toepassingen in de synthese van verschillende industrieel en biologisch relevante moleculen:
- Detergentia: Natriumdodecylbenzeensulfonaat (SDS), een veelgebruikte anionische oppervlakteactieve stof, wordt geproduceerd door dodecylbenzeen te sulfoneren.
- Kleurstoffen: Gesulfoneerde azokleurstoffen vertonen levendige kleuren en worden gebruikt in diverse textieltoepassingen.
- Farmaceutica: Sulfonamiden, een klasse antibiotica, vertrouwen op de aanwezigheid van een sulfonzuurgroep voor hun antibacteriële activiteit.
Naast deze voorbeelden speelt sulfonering een belangrijke rol in de synthese van talrijke andere verbindingen, waaronder ionenuitwisselingsharsen, voedseladditieven en agrochemicaliën.
Referenties
- Callister, W. D., & Rethwisch, D. G. (2018). Materials Science and Engineering: An Introduction. Wiley.
- Chang, R. (2010). Chemistry (10th ed.). McGraw-Hill.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press.
- Green, J. (2018). An Introduction to the Chemical Process Industry. CRC Press.
- Kiehl, J. T. (2013). Industrial Chemical Processes: An Introduction. John Wiley & Sons.
- Meyers, R. A. (Ed.). (2001). Encyclopedia of Analytical Chemistry. Wiley.
- Seader, J. D., & Henley, E. J. (2011). Separation Process Principles. Wiley.
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics (7th ed.). McGraw-Hill.
- Sperling, L. H. (Ed.). (2018). Introduction to Physical Polymer Science (4th ed.). Wiley.
- Turton, R., Bailie, R. C., Whiting, W. B., & Shaeiwitz, J. A. (2018). Analysis, Synthesis, and Design of Chemical Processes (5th ed.). Pearson.