Begin 19e eeuw werden er belangrijke vorderingen gemaakt in de synthese van aromatische nitroverbindingen. Mitscherlich verkreeg in 1834 met succes dergelijke verbindingen door koolwaterstoffen afkomstig van steenkoolteer te onderwerpen aan rokend salpeterzuur.
Laurent zette dit werk in 1835 voort, waarbij hij zich richtte op de nitrering van naftaleen, de meest direct beschikbare zuivere aromatische koolwaterstof in die tijd. In 1838 presenteerde Dale bevindingen over gemengde nitroverbindingen afkomstig van ruwe benzeen tijdens de jaarlijkse bijeenkomst van de British Association for the Advancement of Science.
Het duurde echter tot 1845 voordat Hofmann en Muspratt hun systematische onderzoek naar de nitrering van benzeen rapporteerden, wat resulteerde in mono- en dinitrobenzenen met behulp van een mengsel van salpeterzuur en zwavelzuur.
Inhoudsopgave
De eerste productie van nitrobenzeen werd op kleine schaal uitgevoerd en zorgvuldig gedistilleerd om een gele vloeistof met een bittere amandelachtige geur op te leveren. Dit product, bekend als ‘essence of mirbane’, werd verkocht aan zeep– en parfumfabrikanten.
Het ijzerreductieproces van Bechamp, dat de beschikbaarheid van aniline verhoogde, werd in 1854 gepubliceerd. Vervolgens markeerde Perkins ontdekking van aniline mauve in 1856 het begin van de Europese anilineverfindustrie, die diende als de basis voor de wereldwijde synthetische kleurstoffenindustrie, met een geschatte omzet van $ 6 x 109 in 1988.
De ontwikkeling en opschaling van de nitratie- en reductieprocessen, geïnitieerd door Perkin en voortgezet door talloze anderen, verlaagde de handelsprijs van aniline aanzienlijk van 50 Fr/kg in 1858 tot 10 Fr/kg in 1863.
In 1871 had de Europese anilineproductie 3500 t/a bereikt. In 1985 steeg de Europese anilineproductie tot 500.000 t/a, waarbij het gebruik ervan in kleurstoffen slechts 4% van de totale anilineproductie uitmaakte.
Het grootste deel van de groei werd toegeschreven aan rubberchemicaliën en isocyanaten, die meer dan 50% van de nitrobenzeenproductie verbruikten voor de productie van methyleendifenyldiisocyanaat.
Natuurlijk voorkomende nitroaromatische verbindingen zijn beperkt in aantal, waarbij chlooramfenicol de eerste was die in 1949 werd herkend, geëxtraheerd uit culturen van Streptomyces venezuelae, een bodemschimmel.
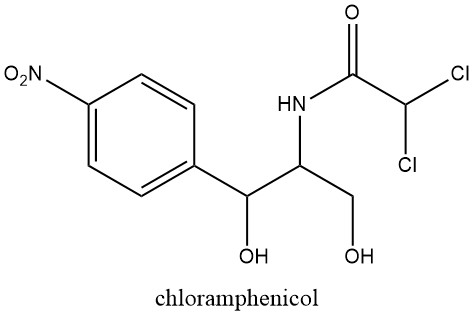
Deze ontdekking leidde tot verder onderzoek naar de farmacologische activiteit van de nitrogroep, na de eerdere ontdekking van de antibacteriële eigenschappen van nitrofuranderivaten in 1943.
Veel synthetische farmaceutische producten en agrochemicaliën bevatten ook nitroaromatische groepen, hoewel de precieze rol van de nitrogroep in deze verbindingen vaak onduidelijk blijft.
De primaire methode voor het introduceren van nitrogroepen in aromatische systemen is nitratie.
Hoewel er enkele indirecte methoden beschikbaar zijn, zoals oxidatie van nitroso- of aminoverbindingen, vervanging van diazoniumgroepen (Sandmeyer-reactie), herschikking van nitramines en nucleofiele verplaatsingsreacties, hebben ze een beperkte industriële betekenis.
Eenheidsprocessen, zoals sulfonering, halogenering of aminering, worden vaak toegepast op primaire nitro-uitgangsmaterialen, voornamelijk afgeleid van nitrobenzeen, nitrotoluenen en nitrochloorbenzenen, om verschillende belangrijke nitroverbindingen te produceren.
Nucleofiele verplaatsing van geactiveerde nitrogroepen heeft een synthetisch potentieel en de nucleofugiciteit ervan kan vergelijkbaar zijn met die van fluorsubstituenten. Bepaalde gemakkelijk verkrijgbare nitroverbindingen, zoals 1,3-dinitrobenzeen, reageren met specifieke reagentia om bruikbare derivaten te vormen.
Nitroverbindingen of hun derivaten dienen als tussenproducten voor kleurstoffen, agrochemicaliën, farmaceutica, fijne chemicaliën, synthetische materialen en explosieven, met weinig grote afzetmogelijkheden voor grootschalige productie.
1. Nitratiereactie
Het proces van nitratie kan worden beschreven als de onomkeerbare introductie van een of meer nitrogroepen in een aromatische kern, ter vervanging van een waterstofatoom.
Nitratie is een elektrofiele substitutiereactie, weergegeven door de vergelijking:
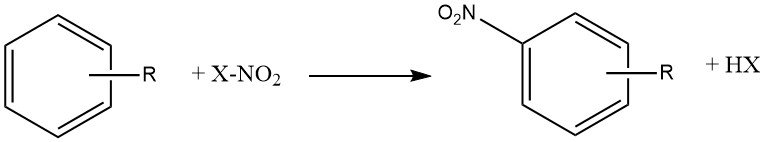
De introductie van de nitrogroep deactiveert de ring voor verdere elektrofiele substitutie, waardoor dinitratie een zeldzame gebeurtenis is onder de omstandigheden die worden gebruikt voor mononitratie.
Er zijn doorgaans krachtigere omstandigheden vereist voor dinitratie, wat overmaat, sterker zuur en hogere temperaturen vereist. Deze omstandigheden worden vaak toegepast op geïsoleerde mononitroverbindingen, in plaats van stapsgewijze reacties in situ uit te voeren.
De nitratiereactie is zeer exotherm, zoals blijkt uit de mononitratie van benzeen (ΔH = -117 kJ/mol) en naftaleen (ΔH = -209 kJ/mol). Bijgevolg is het een van de meest potentieel gevaarlijke industriële eenheidsprocessen.
De warmte die wordt gegenereerd tijdens nitratie kan ervoor zorgen dat salpeterzuur organische materialen exotherm afbreekt tot gasvormige producten met explosieve kracht.
Nitroarylverbindingen, met name die met meerdere nitrogroepen, vormen potentiële gevaren vanwege hun hoge zuurstofgehalte.
Sommige polynitroverbindingen, zoals trinitrotolueen en picrinezuur, zijn detoneerbaar en worden al lang gebruikt als explosieven. Bovendien kunnen nitroaromatische verbindingen heftige ontledingsreacties ondergaan wanneer ze worden verhit met alkali.
Het nitratieproces kan worden uitgevoerd op een batch- (discontinue) of continue basis. Batchreacties zijn geschikt voor lagere tonnagevereisten en worden uitgevoerd in nitratoren die zijn ontworpen om verschillende producten te verwerken.
Om veiligheidsredenen zijn deze reactoren doorgaans beperkt tot een capaciteit van ongeveer 6000 liter en uitgerust met efficiënte roerwerken en koelsystemen.
Aan de andere kant biedt continue reactie, geschikt voor tussenproducten met een groot tonnage zoals nitrobenzeen en nitrotoluenen, voordelen op het gebied van veiligheid en kostenefficiëntie.
Nitroaromatische productie is voornamelijk afhankelijk van processen met een hoge opbrengst, waarbij meer dan 80% van de totale kosten wordt toegeschreven aan grondstoffen. Daarom zijn de operationele besparingen beperkt.
Er zijn echter verbeteringen doorgevoerd op gebieden zoals zwavelzuurrecycling, een integrale vereiste in efficiënte nitratieprocessen, en isomeercontrole en -scheiding, wat bijdraagt aan een verbeterde procesefficiëntie.
2. Nitreringsmiddelen
Om praktische en economische redenen wordt nitratie op industriële schaal doorgaans uitgevoerd met een gemengd zuur, wat een combinatie is van salpeterzuur en zwavelzuur. Soms worden andere combinaties gebruikt, zoals waterig salpeterzuur, salpeterzuur in azijnzuur of salpeterzuur in azijnzuuranhydride.
In bepaalde belangrijke ondersteunende studies kunnen alternatieve componentzuren zoals perchloorzuur, waterstoffluoride of boortrifluoride worden gebruikt, maar hun toepassing is beperkt. Deze alternatieve reacties kunnen plaatsvinden in inerte organische oplosmiddelen zoals chloorkoolwaterstoffen of sulfolaan om homogene reactiemengsels te creëren.
De sterkte van het nitreringsmiddel (X-NO2) neemt af naarmate de elektronegativiteit van X afneemt. De meest actieve soort in deze systemen is het nitroniumion (NO2+). In het algemene systeem is de algehele vergelijking een samenstelling van verschillende evenwichten die aanwezig zijn in HNO3 – H2SO4 – H2O-mengsels, die in overweging moeten worden genomen bij het beoordelen van de substraatreactiviteit en de mate van vereiste nitrering.
Voor grootschalige aromatische mononitratie bestaat een typisch nitreringsmiddel uit 20% salpeterzuur, 60% zwavelzuur en 20% water, vaak aangeduid als “20/60/20 gemengd zuur”. In sommige situaties kan het ook worden beschreven als 15 mol % salpeterzuur, 30 mol % zwavelzuur en 55 mol % water.
Het vloeibare aromatische substraat en het genitreerde product vormen doorgaans een aparte fase van het waterige gemengde zuur. Daarom is efficiënte agitatie cruciaal om het contact met de organische fase te maximaliseren en de weerstand tegen massaoverdracht te minimaliseren.
Vaste substraten worden het beste opgelost in de zwavelzuurfase. Het is essentieel om verschillende variabelen te optimaliseren, zoals de salpeterzuurconcentratie, temperatuur en andere parameters voor elke specifieke nitrering om de gewenste isomeervorming te bereiken en nevenreacties te minimaliseren.
Vrije-radicalenreacties, doorgaans gebruikt in de dampfase met salpeterzuur of stikstofdioxide als nitreringsmiddel, worden niet vaak gebruikt bij aromatische nitrering. Ze zijn geschikter voor alifatische nitrering.
3. Nitratiereactiemechanismen
Er zijn uitgebreide experimenten uitgevoerd met aromatische nitrering sinds de bevestiging van het nitroniumion (NO2+) als de actieve soort door de Ingold-Hughes-school in 1950, met behulp van Raman-spectra-analyse.
Hoewel temperatuur en mengingsgraad een cruciale rol spelen bij alle nitreringsmiddelen, leiden andere variabelen vaak tot inconsistente resultaten. Bij commerciële nitrering met HNO3-H2SO4 vertonen de relatieve snelheidsconstanten een breed bereik, wat resulteert in reactietijden die variëren van enkele seconden voor actieve substraten tot enkele uren voor inactieve substraten.
Er is betoogd dat in de niet-ideale omstandigheden van grootschalige productie, massatransfer meer controle kan hebben over nitratie dan kinetiek, wat de aanname in veel laboratoriumstudies dat massatransferweerstand verwaarloosbaar is, in twijfel trekt.
Bovendien werd een eerdere aanname dat de snelheid van nitratie overeenkomt met de evenwichtsvorming van het nitroniumion in twijfel getrokken vanwege het besef dat verschillende mechanismen van toepassing kunnen zijn bij verschillende zuursterktes.
Figuur 1 illustreert het mechanisme dat alle beschikbare feiten over de nitratie van eenvoudige substraten zoals benzeen en tolueen (met uitzondering van fenolen of polyalkylbenzenen) kan verklaren. Dit mechanisme omvat vier snelheidsconstanten en drie significante omkeerbare reacties, waardoor de kinetiek zeer complex is, zelfs als de reactie volledig kinetisch wordt gecontroleerd.
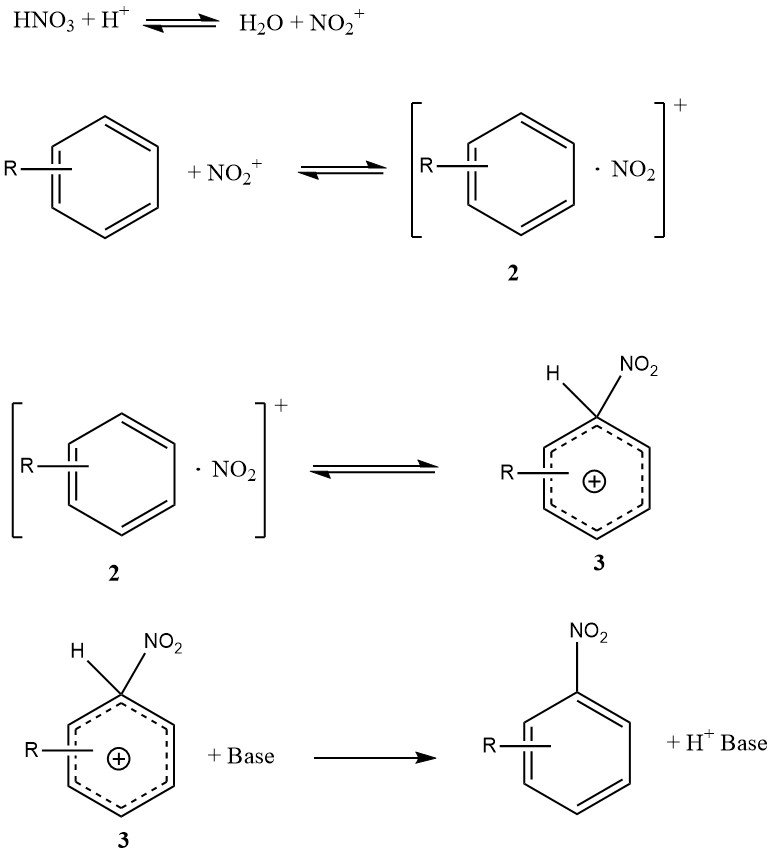
Het ontmoetingscomplex of ontmoetingspaar (2) is een nieuw kenmerk van dit mechanisme. Het is een moleculair complex van een minder specifieke aard vergeleken met het eerdere concept van een intermediair p-complex. Belangrijk is dat het ontmoetingscomplex (2) een kinetische rol speelt en inderdaad snelheidsbepalend kan zijn.
De omzetting van het s-complex (3), soms aangeduid als een Wheland-intermediair, naar het product is niet snelheidsbeperkend omdat de nitreringsreactie geen primair kinetisch isotoopeffect vertoont.
Onder specifieke omstandigheden kan de vorming van het nitroniumion snelheidsbepalend zijn, maar voor reactieve substraten in waterig zwavelzuur is de vorming van het ontmoetingscomplex (2) overwegend de snelheidsbepalende stap.
Daarentegen volgt de nitrering van tolueen, benzeen en andere minder reactieve aromatische verbindingen een algemene snelheidswet waarbij de vorming van het s-complex (3) hoofdzakelijk de snelheidsbepalende stap is.
In het geval van fenol, wanneer de ring sterk wordt geactiveerd voor elektrofiele aanval, wordt het nitrosoniumion (NO+) significant en leidt tot de vorming van een intermediaire nitrosoverbinding. Deze intermediaire verbinding wordt verder geoxideerd door salpeterzuur om het nitro-derivaat op te leveren terwijl salpeterigzuur wordt geregenereerd.
Een andere uitzondering op het algemene mechanisme is ipso-elektrofiele aanval op een substituentpositie. Met di- en polyalkylbenzenen kan het ipso-nitroareniumion (4) worden gevormd in plaats van de conventionele Wheland-intermediaire verbinding (3).
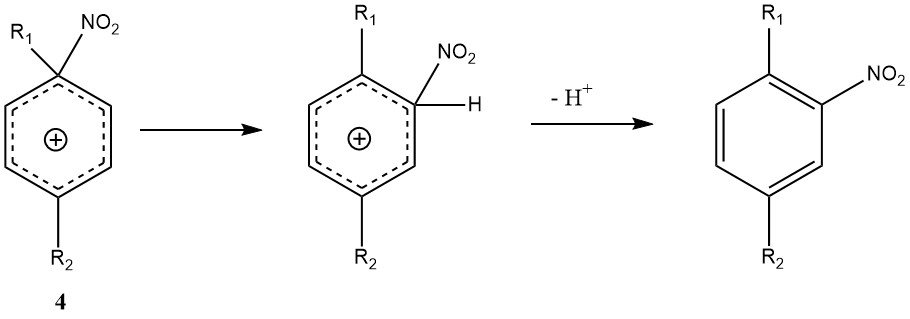
De herschikking van (4) naar het Wheland-intermediair kan voorkomen, maar gaat gepaard met nevenreacties zoals nitro-dealkylering, waardoor de nitrering van polyalkylbenzenen mogelijk meer variabele mengselproducten oplevert dan andere nitreringen.
Verbeterd begrip van de vorming van ipso-Wheland-intermediairen heeft geleid tot hun gebruik in andere reacties, met name met nucleofielen.
Referentie
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411