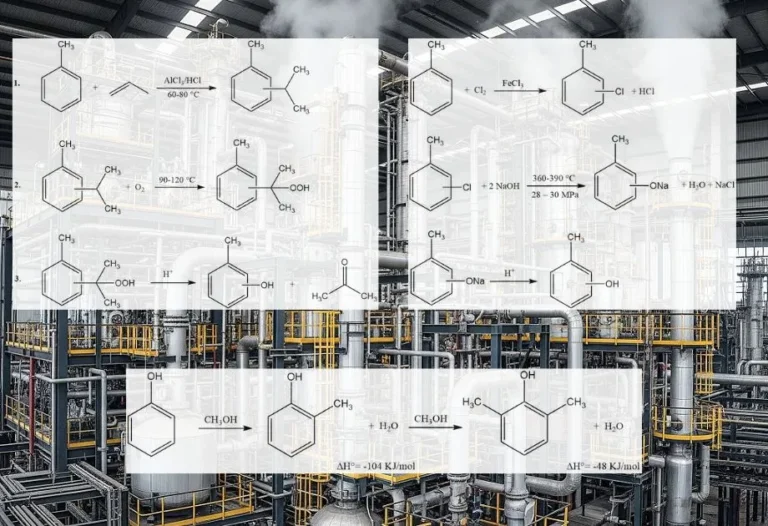
Chemische Reaktionen sind ein grundlegender Aspekt vieler industrieller Prozesse. Bei diesen Reaktionen handelt es sich um die Umwandlung eines oder mehrerer Stoffe in neue Produkte, und sie können zur Herstellung einer Vielzahl von Materialien verwendet werden, darunter Kraftstoffe, Kunststoffe, Arzneimittel und viele andere.
Das Verständnis der Prinzipien chemischer Reaktionen ist für Ingenieure und Chemiker, die industrielle Prozesse entwerfen und optimieren, von entscheidender Bedeutung.
Es gibt verschiedene Arten chemischer Reaktionen, die in industriellen Prozessen ablaufen, darunter Verbrennung, Redoxreaktionen, Polymerisation, Hydrierung, Carbonylierung, Acylierung, Alkylierung, Nitrierung, Dehydrierung, Veresterung und Sulfonierung.
Inhaltsverzeichnis
1. Verbrennungsreaktionen
Verbrennungsreaktionen können in zwei Kategorien eingeteilt werden: vollständige Verbrennung und unvollständige Verbrennung. Bei der vollständigen Verbrennung wird der Brennstoff vollständig verbrannt, wobei als Endprodukte nur Kohlendioxid und Wasser entstehen.
Im Gegensatz dazu kommt es zu einer unvollständigen Verbrennung, wenn der Kraftstoff nicht vollständig verbrennt und eine Mischung aus Kohlenmonoxid, Ruß und anderen Schadstoffen entsteht.

In industriellen Prozessen ist eine vollständige Verbrennung wünschenswert, da sie die maximale Energiemenge und die geringste Schadstoffbelastung erzeugt. Allerdings kann es eine Herausforderung sein, eine vollständige Verbrennung zu erreichen, insbesondere wenn schwer entzündliche Brennstoffe oder Brennstoffe mit geringer Verbrennungseffizienz verbrannt werden.
Um Verbrennungsreaktionen zu optimieren, müssen mehrere Faktoren berücksichtigt werden, darunter die Stöchiometrie der Reaktion, die Verbrennungstemperatur und die Mischung von Brennstoff und Oxidationsmittel.
Die Stöchiometrie der Reaktion bezieht sich auf das Verhältnis der Reaktanten, das erforderlich ist, um eine vollständige Verbrennung zu erreichen. Auch die Verbrennungstemperatur ist entscheidend, da sie die Reaktionsgeschwindigkeit und die Qualität der Endprodukte beeinflusst.
Auch das Mischen von Brennstoff und Oxidationsmittel ist wichtig, da es die Effizienz der Reaktion und die Qualität der Endprodukte beeinflusst.
Neben industriellen Prozessen sind Verbrennungsreaktionen auch an vielen Naturphänomenen wie Waldbränden und Vulkanausbrüchen beteiligt. Diese Reaktionen können erhebliche Auswirkungen auf die Umwelt haben, beispielsweise Luftverschmutzung und globale Erwärmung.
Um die Umweltauswirkungen von Verbrennungsreaktionen zu verringern, werden viele Anstrengungen unternommen, um die Effizienz der Verbrennung zu verbessern und sauberere Technologien zu entwickeln, die weniger Schadstoffe produzieren.
2. Oxidations-Reduktions-Reaktionen
Oxidations-Reduktionsreaktionen, auch Redoxreaktionen genannt, beinhalten die Übertragung von Elektronen zwischen zwei Spezies. Bei einer Oxidationsreaktion verliert eine Spezies Elektronen, während bei einer Reduktionsreaktion eine Spezies Elektronen hinzugewinnt.

Diese Reaktionen sind in vielen industriellen Prozessen von wesentlicher Bedeutung, beispielsweise in der Metallproduktion, der Galvanisierung sowie der Produktion von Chemikalien und Kraftstoffen. Wichtige industrielle Anwendungen elektrochemischer Reaktionen sind die Herstellung von Natriumhydroxid durch Elektrolyse von NaCl, die Herstellung anderer Alkalimetallhydroxide und die Herstellung von Bleichmitteln.
Redoxreaktionen können entweder als spontan oder nicht spontan klassifiziert werden, je nachdem, ob sie auf natürliche Weise ablaufen oder für ihren Ablauf eine Energiezufuhr erfordern. Spontane Redoxreaktionen sind solche, die ohne externe Energiezufuhr ablaufen und häufig in Batterien und anderen Energiespeichern eingesetzt werden.
Nichtspontane Redoxreaktionen hingegen erfordern zum Ablauf eine externe Energiequelle und werden bei der Elektrolyse und anderen chemischen Prozessen eingesetzt.
Ein häufiges Beispiel für eine Redoxreaktion ist das bereits erwähnte Rosten von Eisen. Bei dieser Reaktion reagiert Eisen mit Sauerstoff unter Bildung von Eisenoxid, der bekannten rotbraunen Substanz, die wir Rost nennen.
Rost ist ein Beispiel für eine Oxidationsreaktion, bei der Eisen Elektronen an Sauerstoff verliert. Diese Reaktion ist wichtig, da sie die Hauptursache für Korrosion in Metallen ist, deren Reparatur oder Austausch kostspielig sein kann.
Ein weiteres Beispiel für eine Redoxreaktion ist die Entstehung von Chlorgas, das bei der Herstellung von Kunststoffen und anderen Materialien verwendet wird. Chlorgas entsteht durch die Elektrolyse von Salzwasser, einer nicht spontanen Redoxreaktion, für deren Ablauf eine externe Energiequelle erforderlich ist.
Bei dieser Reaktion werden Chloridionen aus Salzwasser oxidiert, um Chlorgas und Wasserstoffgas zu erzeugen. Chlorgas ist ein starkes Oxidationsmittel und wird in vielen industriellen Prozessen verwendet, darunter bei der Herstellung von Pestiziden, Arzneimitteln und Kunststoffen.
3. Polymerisationsreaktionen
Polymerisationsreaktionen sind eine Art chemische Reaktion, bei der Monomermoleküle chemisch miteinander verbunden werden, um eine Polymerkette zu bilden. Das resultierende Polymer kann ein breites Spektrum an Eigenschaften und Anwendungen haben, von Kunststoffen und synthetischen Fasern bis hin zu Klebstoffen und Beschichtungen.

Es gibt zwei Haupttypen von Polymerisationsreaktionen: Additionspolymerisation und Kondensationspolymerisation. Bei der Polymerisation reagieren Monomere mit einer Doppelbindung miteinander und bilden eine Polymerkette.
Die Reaktion wird typischerweise durch einen Katalysator oder Wärme initiiert und das resultierende Polymer ist eine lange Kette mit wiederkehrenden Einheiten des ursprünglichen Monomers. Bei der Kondensationspolymerisation hingegen handelt es sich um die Reaktion zweier verschiedener Monomere mit einer funktionellen Gruppe, die unter Bildung einer kovalenten Bindung reagiert. Bei dieser Art von Reaktion entsteht typischerweise ein kleines Molekül wie Wasser als Nebenprodukt.
Polymerisationsreaktionen werden in einer Vielzahl industrieller Anwendungen eingesetzt, von der Herstellung von Kunststoffen und synthetischen Fasern bis hin zur Entwicklung neuer Materialien für medizinische Implantate und die Verabreichung von Medikamenten.
Ein Beispiel für eine Polymerisationsreaktion ist die Herstellung von Polyethylen, dem weltweit am häufigsten verwendeten Kunststoff. Polyethylen wird durch Additionspolymerisation von Ethylenmonomeren hergestellt, wodurch ein langkettiges Polymer entsteht, das in einer Vielzahl von Anwendungen eingesetzt werden kann, von Verpackungen bis hin zu Baumaterialien.
Ein weiteres Beispiel für eine Polymerisationsreaktion ist die Herstellung von Nylon, einer synthetischen Faser, die in Textilien und anderen Anwendungen verwendet wird. Nylon wird durch die Kondensationspolymerisation zweier Monomere, Hexamethylendiamin und Adipinsäure, hergestellt, die unter Bildung einer Polymerkette reagieren. Nylon ist für seine Festigkeit und Haltbarkeit bekannt und wird in einer Vielzahl von Anwendungen eingesetzt, von Kleidung bis hin zu Automobilteilen.
4. Oxidationsreaktionen
Bei einer Oxidationsreaktion verliert ein Molekül Elektronen. Dies geht oft mit der Gewinnung von Sauerstoffatomen einher, aber nicht immer. Hier ist eine Aufschlüsselung der wichtigsten Aspekte:
- Elektronentransfer: Das Kernprinzip der Oxidation ist der Verlust von Elektronen aus einem Molekül. Stellen Sie sich vor, dass negative Ladungen entfernt werden, wodurch das Molekül eine „positivere“ Ladung erhält.
- Sauerstoffverbindung: Während eine Oxidationsreaktion oft mit der Gewinnung von Sauerstoffatomen verbunden ist, ist dies nicht unbedingt erforderlich. Sauerstoff ist jedoch aufgrund seiner starken Elektronegativität ein häufiges Oxidationsmittel, was bedeutet, dass er eine hohe Affinität zur Anziehung von Elektronen aufweist.
Verschiedene in der chemischen Industrie verwendete Oxidationsmittel wie molekularer Sauerstoff (O2), Wasserstoffperoxid (H2O2) und Chlor (Cl2) nehmen Elektronen vom Zielmolekül auf. Die Wahl des Oxidationsmittels hängt von Faktoren wie Kosten, Selektivität und Reaktionsbedingungen ab.
Industrielle Katalysatoren beschleunigen die Reaktion, ohne selbst verbraucht zu werden. Häufig werden Übergangsmetalle wie Kupfer, Mangan und Vanadium verwendet. Sie können die Selektivität verbessern, den Energieverbrauch senken und die Prozesseffizienz verbessern.
Die Oxidationsreaktionen werden in verschiedenen Branchen eingesetzt:
1. Produktion von Massenchemikalien:
- Acrylsäure ist wichtig für Acrylfasern und Farben und Klebstoffe. Es wird durch Propylenoxidation mit Luft über Metalloxidkatalysatoren hergestellt.
- Terephthalsäure ist der Baustein von PET-Kunststoffen; Es wird durch Flüssigphasenoxidation von p-Xylol mit Luft oder Sauerstoff hergestellt.
- Salpetersäure wird in Düngemitteln, Sprengstoffen und der Nylonproduktion verwendet. Es wird über das Ostwald-Verfahren synthetisiert, bei dem Ammoniak mit Luft an Platin-Rhodium-Katalysatoren oxidiert wird.
2. Feinchemikalien und Pharmazeutika:
- Selektive Oxidationen: Die präzise Veränderung spezifischer funktioneller Gruppen in komplexen Molekülen ist für die Synthese von Arzneimitteln von entscheidender Bedeutung. Enzyme oder Übergangsmetallkatalysatoren ermöglichen gezielte Oxidationen mit minimalen Nebenreaktionen.
- Hydroxylierungen: Die Einführung von Hydroxylgruppen ist für viele Arzneimittel von entscheidender Bedeutung. Methoden wie die asymmetrische Sharpless-Dihydroxylierung nutzen chirale Katalysatoren für eine hohe Stereokontrolle.
3. Umweltsanierung:
- Abwasseraufbereitung: Durch Oxidation mit Ozon oder Peroxiden wird Wasser effektiv desinfiziert und organische Schadstoffe abgebaut.
- Rauchgasentschwefelung: Die Entfernung von Schwefeloxiden aus Kraftwerksabgasen erfolgt durch Nasswäsche mit Oxidationsmitteln wie Kalziumhydroxid.
5. Hydrierungsreaktion
Eine Hydrierungsreaktion ist eine spezielle Art von Reduktionsreaktion, bei der ein Molekül Wasserstoffatome gewinnt. Dies geschieht häufig in Gegenwart eines Katalysators und führt zur Sättigung ungesättigter Bindungen, typischerweise Doppel- oder Dreifachbindungen, im reagierenden Molekül.
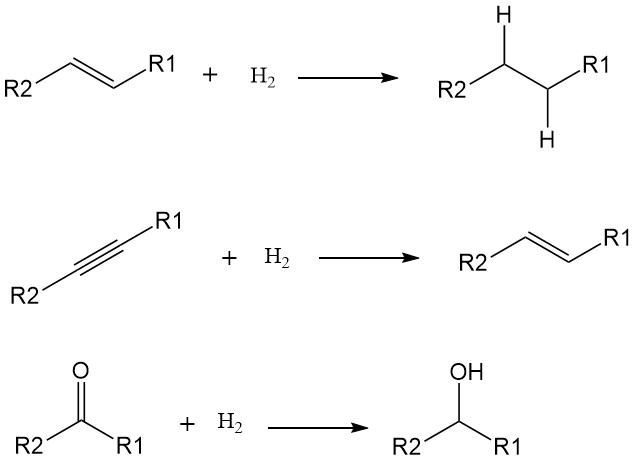
Die Zugabe von Wasserstoffatomen (H) zu einem Molekül erhöht dessen Sättigung und verringert seine Reaktivität. Während einige Hydrierungen bei hohen Temperaturen ohne Katalysatoren ablaufen können, senkt ihr Einsatz die Aktivierungsenergie erheblich und beschleunigt die Reaktion unter milderen Bedingungen. Übergangsmetalle wie Nickel, Palladium und Platin sind übliche Katalysatoren für die Hydrierung.
Hydrierungen zielen typischerweise auf Doppel- und Dreifachbindungen ab und wandeln diese in Einfachbindungen um. Beispiele beinhalten:
- Alkene zu Alkanen: Umwandlung ungesättigter Kohlenwasserstoffe wie Ethylen (C2H4) in gesättigte Kohlenwasserstoffe wie Ethan (C2H6).
- Alkine zu Alkenen: Umwandlung dreifach gebundener Kohlenwasserstoffe wie Acetylen (C2H2) in doppelgebundene Alkene wie Ethylen.
- Carbonylgruppen zu Alkoholen: Reduzierung von Ketonen und Aldehyden mit Carbonylgruppen (C=O) zu Alkoholen mit Hydroxylgruppen (OH).
Hydrierungsreaktionen werden in verschiedenen Branchen eingesetzt, darunter:
- Pflanzenölverarbeitung: Härten flüssiger Öle durch Umwandlung ungesättigter Fette in gesättigte Fette für die Margarineproduktion.
- Kraftstoffraffinierung: Entschwefelung und Verbesserung der Qualität von Benzin- und Dieselkraftstoffen.
- Pharmazeutische Produktion: Synthese verschiedener Pharmazeutika und Feinchemikalien.
Hydrierung wird auch verwendet in:
- Lebensmittel- und Getränkeindustrie: Verarbeitung von Fetten und Ölen für Lebensmittelprodukte.
- Polymerisation: Herstellung von Polymeren mit spezifischen Eigenschaften.
- Wasserstoff-Brennstoffzellen: Umwandlung von Wasserstoff und Sauerstoff in Elektrizität.
6. Carbonylierungsreaktion
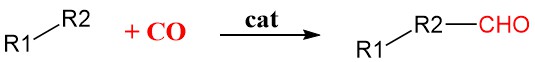
Carbonylierung ist eine allgemeine Methode in der organischen Synthese, bei der Kohlenmonoxid (CO) mithilfe von Übergangsmetallkatalysatoren wie Rhodium, Iridium, Palladium oder Nickel in organische Moleküle eingebracht wird. Diese Katalysatoren binden und aktivieren das CO-Molekül, wodurch es reaktiver wird und in das organische Substrat eingebaut werden kann.
Es handelt sich um eine hochselektive Reaktion, das heißt, sie kann das CO-Molekül mit minimalen Nebenreaktionen präzise an die gewünschte Position im Molekül anfügen.
Dies macht es für die Herstellung einer Vielzahl wichtiger Chemikalien wertvoll, darunter:
- Essigsäure: Über 70 % der weltweit hergestellten synthetischen Essigsäure werden durch Rhodium- oder Iridium-katalysierte Methanol carbonylierung hergestellt.
- Aminosäurederivate: Die Amidocarbonylierung ist ein wachsender Bereich von Interesse für die Herstellung wertvoller Aminosäurederivate, die in der Pharmaindustrie und anderen Industrien verwendet werden.
- Pharmazeutische Zwischenprodukte: Die Carbonylierung aromatischer Halogenide entwickelt sich zu einem Standardverfahren zur Herstellung wichtiger Bausteine für Arzneimittel und andere bioaktive Moleküle.
7. Acylierungsreaktion
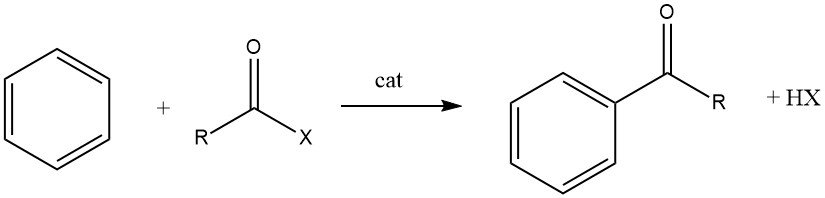
Bei der Friedel-Crafts-Acylierung handelt es sich um die Herstellung eines aromatischen Ketons durch die Reaktion zwischen einer aromatischen Verbindung und einem Acylierungsmittel, bei dem es sich um ein Acylhalogenid, ein Säureanhydrid, eine Säure oder einen Ester handeln kann. Diese Reaktion findet in Gegenwart eines sauren Katalysators statt.
Die Acylierung aromatischer Substrate ist von großer industrieller Bedeutung, da sie zur Synthese aromatischer Zwischenprodukte genutzt wird, die häufig bei der Herstellung von Pharmazeutika, Insektiziden, Weichmachern, Farbstoffen, Parfümen und verschiedenen anderen kommerziellen Produkten eingesetzt werden. Diese Spezialverbindungen werden im Vergleich zu alkylierten Produkten typischerweise in kleinerem Maßstab hergestellt.
| Acylierungsmittel | Aromatische Verbindung | Produkt | Endverwendung |
|---|---|---|---|
| Essigsäureanhydrid | Benzol | Acetophenon | Parfüme, Pharmazeutika, Lösungsmittel, Weichmacher |
| Essigsäureanhydrid | Toluol | 4-Methylacetophenon | Parfums |
| Essigsäureanhydrid | Anisol | 4-Methoxyacetophenon | Parfums |
| Essigsäureanhydrid | Isobutylbenzol | 4-Isobutylactophenon | Arzneimittel |
| Dichloracetylchlorid | 1,2-Dichlorbenzol | α,α,2,4-Tetrachloracetophenon | Insektizide |
| Chlorbutyroylchlorid | Fluorbenzol | Chlorpropyl-4-fluorphenylketon | Arzneimittel |
| Tetrachlormethan | Benzol | Benzophenon | Arzneimittel, Insektizide, Parfüme |
| Benzoylchlorid | Benzol | Benzophenon | |
| Phosgen | N,N-Dimethylanilin | 4,4'-Bis-dimethylaminobenzophenon | Farbstoffe |
| Phthalsäureanhydrid | Benzol | 2-Benzoylbenzoesäure | Anthrachinon |
8. Alkylierungsreaktion
Die Friedel-Crafts-Alkylierung aromatischer Verbindungen beinhaltet eine säurekatalysierte elektrophile Substitution, bei der eine Alkylgruppe einen aromatischen Wasserstoff ersetzt. Zu diesem Zweck werden üblicherweise verschiedene Alkylierungsmittel wie Olefine, Alkylhalogenide und Alkohole eingesetzt.
Diese Reaktion kann auf verschiedene aromatische Substrate angewendet werden, einschließlich heteroaromatischer Verbindungen und sogar Verbindungen wie Ferrocen. Diese Reaktionen sind typischerweise schnell und exotherm und werden oft unter milden Bedingungen in der flüssigen Phase durchgeführt.
In einigen Fällen werden jedoch für bestimmte Substrate Dampfphasenverfahren mit strengeren Bedingungen eingesetzt. Bei der Verwendung von Olefinen, Alkylhalogeniden und Alkoholen als Alkylierungsmittel laufen die Gesamtreaktionen wie folgt ab:
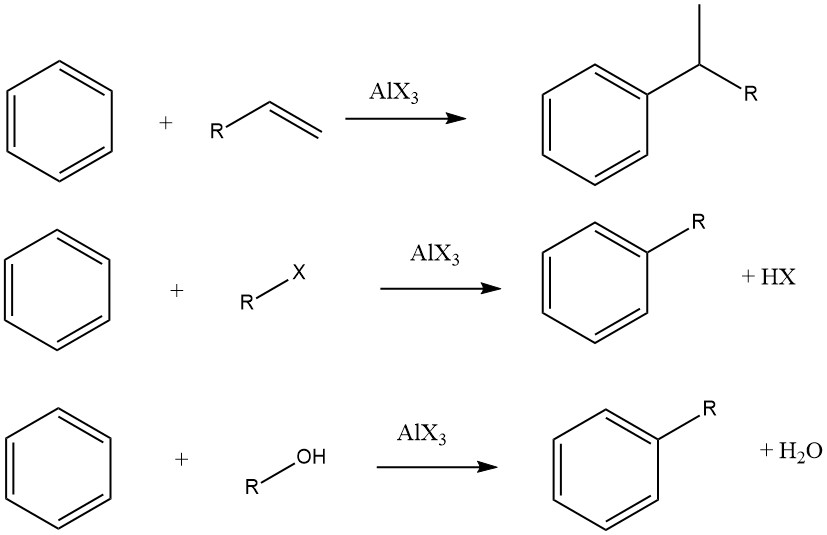
Der Grad der Isomerisierung der Alkyleinheit und die Einhaltung der Markownikow-Regel während des Additionsprozesses variieren je nach Säuregehalt des Katalysators.
Beispiele für die Verwendung von Alkylierungsreaktionen sind die Herstellung von Ethylbenzol, Cumol und Alkylbenzolen aus Benzol, die Alkylierung von Toluol mit Propen zur Herstellung von Cymol; die Alkylierung von Phenolen zur Herstellung von Alkylphenolen; und die Alkylierung verschiedener heterozyklischer aromatischer Verbindungen, einschließlich Furane, Thiophene und N-Heterozyklen.
9. Nitrierungsreaktion
Bei der Nitrierungsreaktion handelt es sich um die irreversible Einführung einer oder mehrerer Nitrogruppen (NO2) in einen aromatischen Kern, die ein Wasserstoffatom ersetzen.
Nitrierung ist eine elektrophile Substitutionsreaktion, dargestellt durch die folgende Gleichung:
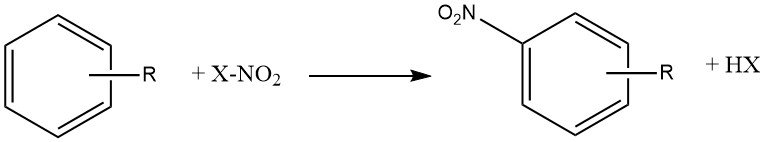
Die Einführung der Nitrogruppe deaktiviert den Ring für eine weitere elektrophile Substitution, sodass Dinitrierung unter den für die Mononitrierung verwendeten Bedingungen selten vorkommt.
Für die Dinitrierung sind in der Regel strengere Bedingungen erforderlich, die einen Überschuss, eine stärkere Säure und eine höhere Temperatur erfordern. Diese Bedingungen werden häufig auf isolierte Mononitroverbindungen angewendet, anstatt schrittweise Reaktionen in situ durchzuführen.
Die Nitrierungsreaktion ist stark exotherm, was durch die Mononitrierung von Benzol (ΔH = -117 kJ/mol) und Naphthalin (ΔH = -209 kJ/mol) belegt wird. Folglich handelt es sich um einen der potenziell gefährlichsten industriell betriebenen Einheitsprozesse.
Die Hauptprodukte der Nitrierung sind monosubstituierte nitroaromatische Verbindungen, die entstehen, wenn eine Nitrogruppe in den aromatischen Kern eingeführt wird. Wichtige Industrieprodukte der Nitrierung können sein:
- Nitrobenzol (C6H5NO2)
- Nitrotoluole (z. B. ortho-Nitrotoluol, meta-Nitrotoluol und para-Nitrotoluol)
- Nitronaphthaline (z. B. Alpha-Nitronaphthalin und Beta-Nitronaphthalin)
- Nitrophenole (z. B. ortho-Nitrophenol, meta-Nitrophenol und para-Nitrophenol)
- Nitroaniline (z. B. ortho-Nitroanilin, meta-Nitroanilin und para-Nitroanilin)
10. Dehydrierungsreaktion
Dehydrierung, das Gegenteil von Hydrierung, bezieht sich auf eine chemische Reaktion, bei der Wasserstoff (H) entzogen wird ein Molekül, normalerweise organisch. Dieser scheinbar einfache Prozess spielt in verschiedenen Aspekten der Chemie eine entscheidende Rolle, von grundlegenden Laborreaktionen bis hin zu industriellen Großprozessen.
Diese Reaktion beinhaltet das Aufbrechen einer C-H-Bindung und die Freisetzung von H2-Gas. Sie ist häufig endotherm und erfordert Wärme oder spezielle Katalysatoren, um die Aktivierungsenergiebarriere zu überwinden.
Dehydrierung ist eine wichtige Reaktion in der chemischen Industrie, die verwendet wird für:
1. Herstellung wertvoller Chemikalien: Die Dehydrierung ist für die Herstellung zahlreicher Produkte unerlässlich, wie zum Beispiel:
- Styrol: Monomer für Polystyrol-Kunststoffe, hergestellt durch Ethylbenzol-Dehydrierung.
- Alkene: ungesättigte Kohlenwasserstoffe, die für weitere Reaktionen in der Polymer-, Kraft- und Schmierstoffproduktion verwendet werden.
- Feinchemikalien: Pharmazeutika, Agrochemikalien und andere spezielle Moleküle umfassen häufig Dehydrierungsschritte.
2. Im Energiesektor bietet die katalytische Dehydrierung leichter Kohlenwasserstoffe im Vergleich zu herkömmlichen Methoden Potenzial für eine sauberere Kraftstoffproduktion.
3. Dehydrierung: Die Entfernung von Wasser (H2O) aus Alkoholen ist ein Sonderfall der Dehydrierung, bei der durch Eliminierung eines Wassermoleküls Alkene entstehen.
11. Veresterungsreaktion
Veresterung ist die reversible Reaktion zwischen Carbonsäuren und Alkoholen zur Bildung eines Esters und Wasser in Gegenwart eines Katalysators.
Die Veresterungsreaktion verläuft über einen dreistufigen Mechanismus:
- Protonierung: Ein Brønsted-Säure-Katalysator protoniert den Carbonylsauerstoff der Carbonsäure und verstärkt so deren elektrophilen Charakter.
- Nukleophiler Angriff: Das Sauerstoffatom des Alkohols, das als Nukleophil fungiert, greift den elektrophilen Carbonylkohlenstoff an und bildet ein tetraedrisches Zwischenprodukt.
- Deprotonierung und Wasserverlust: Das Zwischenprodukt wird häufig durch den Katalysator deprotoniert, gefolgt von der Wasserabspaltung, was zur Bildung des Esters führt und Wasser als Nebenprodukt.
Veresterung ist eine Gleichgewichtsreaktion, und das Prinzip von Le Chatelier bestimmt Strategien zur Steigerung der Esterausbeute. Der Einsatz von überschüssigem Alkohol, die Entfernung von Wasser (z. B. durch Destillation) und die Optimierung der Temperatur können das Gleichgewicht in Richtung Esterbildung verschieben.
Die Veresterungsreaktion hat weitreichende Anwendungen:
- Duftstoffe und Kosmetika: Ester tragen wesentlich zum angenehmen Aroma von Früchten, Blumen und Parfümen bei.
- Arzneimittel: Zahlreiche Medikamente, darunter Aspirin und Penicillin, enthalten Esterfunktionen.
- Polymere: Polyester, eine Klasse von Polymeren, entstehen durch Veresterungsreaktionen und finden Verwendung in verschiedenen Kunststoffen und synthetischen Fasern.
- Biokraftstoffe: Veresterung wird bei der Herstellung von Biokraftstoffen wie Biodiesel eingesetzt.
- Lebensmittelzusatzstoffe: Ester tragen zur Textur und zum Geschmack bestimmter Lebensmittel bei.
12. Sulfonierungsreaktion
Sulfonierung ist eine vielseitige organische Reaktion, die die Sulfonsäuregruppe (-SO2OH) in aromatische Verbindungen einführt. Diese Transformation ist in verschiedenen Bereichen von erheblicher Bedeutung, einschließlich der Synthese von Waschmitteln, Farbstoffen und Pharmazeutika.
Die Sulfonierung erfolgt typischerweise über einen Mechanismus der elektrophilen aromatischen Substitution (EAS). Die wichtigsten Schritte umfassen:
- Bildung des Elektrophils: Schwefeltrioxid (SO3) oder rauchende Schwefelsäure (H2SO4 + SO3) fungiert als Sulfonierungsmittel und erzeugt das elektrophile SO3-Molekül.
- Aromatische elektrophile Substitution: Das SO3-Elektrophil greift die elektronenreiche π-Wolke des aromatischen Rings an und bildet ein σ-Komplex-Zwischenprodukt.
- Protonierung und Desulfonierung: Das Zwischenprodukt verliert ein Proton, was zur Bildung des Arylsulfonsäureprodukts führt.
Allerdings ist die Sulfonierung oft reversibel. Unter sauren Bedingungen und erhöhten Temperaturen kann die Sulfonsäuregruppe desulfoniert werden, wodurch die aromatische Ausgangsverbindung und Schwefeldioxid freigesetzt werden.
Die Sulfonierung findet zahlreiche Anwendungen bei der Synthese verschiedener industriell und biologisch relevanter Moleküle:
- Reinigungsmittel: Natriumdodecylbenzolsulfonat (SDS), ein weit verbreitetes anionisches Tensid, wird durch Sulfonierung von Dodecylbenzol hergestellt.
- Farbstoffe: Sulfonierte Azofarbstoffe weisen leuchtende Farben auf und werden in verschiedenen Textilanwendungen eingesetzt.
- Pharmazeutika: Sulfonamide, eine Klasse von Antibiotika, beruhen für ihre antibakterielle Aktivität auf dem Vorhandensein einer Sulfonsäuregruppe.
Über diese Beispiele hinaus spielt die Sulfonierung eine wichtige Rolle bei der Synthese zahlreicher anderer Verbindungen, darunter Ionenaustauscherharze, Lebensmittelzusatzstoffe und Agrochemikalien.
Verweise
- Callister, W. D., & Rethwisch, D. G. (2018). Materials Science and Engineering: An Introduction. Wiley.
- Chang, R. (2010). Chemistry (10th ed.). McGraw-Hill.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press.
- Green, J. (2018). An Introduction to the Chemical Process Industry. CRC Press.
- Kiehl, J. T. (2013). Industrial Chemical Processes: An Introduction. John Wiley & Sons.
- Meyers, R. A. (Ed.). (2001). Encyclopedia of Analytical Chemistry. Wiley.
- Seader, J. D., & Henley, E. J. (2011). Separation Process Principles. Wiley.
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics (7th ed.). McGraw-Hill.
- Sperling, L. H. (Ed.). (2018). Introduction to Physical Polymer Science (4th ed.). Wiley.
- Turton, R., Bailie, R. C., Whiting, W. B., & Shaeiwitz, J. A. (2018). Analysis, Synthesis, and Design of Chemical Processes (5th ed.). Pearson.