Le reazioni chimiche sono un aspetto fondamentale di molti processi industriali. Queste reazioni coinvolgono la trasformazione di una o più sostanze in nuovi prodotti e possono essere utilizzate per produrre un’ampia varietà di materiali, tra cui carburanti, materie plastiche, farmaceutici e molti altri.
Comprendere i principi alla base delle reazioni chimiche è cruciale per ingegneri e chimici che progettano e ottimizzano i processi industriali.
Esistono diversi tipi di reazioni chimiche che si verificano nei processi industriali, tra cui combustione, reazioni di ossidoriduzione, polimerizzazione, idrogenazione, carbonilazione, acilazione, alchilazione, nitrazione, deidrogenazione, esterificazione e solfonazione.
Sommario
1. Reazioni di combustione
Le reazioni di combustione possono essere classificate in due categorie: combustione completa e combustione incompleta. Nella combustione completa, il combustibile viene bruciato completamente, producendo solo anidride carbonica e acqua come prodotti finali.
Al contrario, la combustione incompleta si verifica quando il combustibile non brucia completamente, producendo una miscela di monossido di carbonio, fuliggine e altri inquinanti.

Nei processi industriali, la combustione completa è auspicabile perché produce la massima quantità di energia e la minima quantità di inquinamento. Tuttavia, ottenere una combustione completa può essere difficile, soprattutto quando si bruciano combustibili difficili da accendere o con una bassa efficienza di combustione.
Per ottimizzare le reazioni di combustione, è necessario considerare diversi fattori, tra cui la stechiometria della reazione, la temperatura di combustione e la miscelazione del combustibile e dell’agente ossidante.
La stechiometria della reazione si riferisce al rapporto dei reagenti necessari per ottenere una combustione completa. Anche la temperatura di combustione è critica perché influenza la velocità della reazione e la qualità dei prodotti finali.
Anche la miscelazione del combustibile e dell’agente ossidante è essenziale perché influenza l’efficienza della reazione e la qualità dei prodotti finali.
Oltre ai processi industriali, le reazioni di combustione sono coinvolte anche in molti fenomeni naturali, come incendi boschivi ed eruzioni vulcaniche. Queste reazioni possono avere impatti ambientali significativi, come l’inquinamento atmosferico e il riscaldamento globale.
Per ridurre l’impatto ambientale delle reazioni di combustione, si stanno facendo molti sforzi per migliorare l’efficienza della combustione e sviluppare tecnologie più pulite che producano meno inquinanti.
2. Reazioni di ossidoriduzione
Le reazioni di ossidoriduzione, note anche come reazioni redox, comportano il trasferimento di elettroni tra due specie. In una reazione di ossidazione, una specie perde elettroni, mentre in una reazione di riduzione, una specie guadagna elettroni.

Queste reazioni sono essenziali in molti processi industriali, come la produzione di metalli, la galvanica e la produzione di sostanze chimiche e combustibili. Importanti usi industriali delle reazioni elettrochimiche sono la produzione di idrossido di sodio tramite elettrolisi di NaCl, la produzione di altri idrossidi di metalli alcalini e la produzione di candeggina.
Le reazioni redox possono essere classificate come spontanee o non spontanee, a seconda che avvengano naturalmente o richiedano un apporto di energia per procedere. Le reazioni redox spontanee sono quelle che avvengono senza alcun apporto di energia esterna e sono spesso utilizzate nelle batterie e in altri dispositivi di accumulo di energia.
Le reazioni redox non spontanee, d’altra parte, richiedono una fonte di energia esterna per procedere e sono utilizzate nell’elettrolisi e in altri processi chimici.
Un esempio comune di reazione redox è l’arrugginimento del ferro, menzionato in precedenza. In questa reazione, il ferro reagisce con l’ossigeno per produrre ossido di ferro, che è la familiare sostanza rosso-marrone che chiamiamo ruggine.
L’arrugginimento è un esempio di reazione di ossidazione, in cui il ferro perde elettroni a favore dell’ossigeno. Questa reazione è importante perché è la causa principale della corrosione nei metalli, che può essere costosa da riparare o sostituire.
Un altro esempio di reazione redox è la produzione di gas cloro, che viene utilizzato nella produzione di materie plastiche e altri materiali. Il gas cloro viene prodotto dall’elettrolisi dell’acqua salata, che è una reazione redox non spontanea che richiede una fonte esterna di energia per procedere.
In questa reazione, gli ioni cloruro dell’acqua salata vengono ossidati per produrre gas cloro e gas idrogeno. Il gas cloro è un potente agente ossidante ed è utilizzato in molti processi industriali, tra cui la produzione di pesticidi, prodotti farmaceutici e materie plastiche.
3. Reazioni di polimerizzazione
Le reazioni di polimerizzazione sono un tipo di reazione chimica in cui le molecole di monomero vengono legate chimicamente insieme per formare una catena polimerica. Il polimero risultante può avere un’ampia gamma di proprietà e applicazioni, dalle materie plastiche e fibre sintetiche agli adesivi e ai rivestimenti.

Esistono due tipi principali di reazioni di polimerizzazione: polimerizzazione per addizione e polimerizzazione per condensazione. Nella polimerizzazione per addizione, i monomeri con un doppio legame reagiscono tra loro per formare una catena polimerica.
La reazione è in genere avviata da un catalizzatore o dal calore e il polimero risultante è una lunga catena con unità ripetute del monomero originale. La polimerizzazione per condensazione, d’altro canto, comporta la reazione di due monomeri diversi con un gruppo funzionale che reagisce per formare un legame covalente. In questo tipo di reazione, una piccola molecola, come l’acqua, è in genere prodotta come sottoprodotto.
Le reazioni di polimerizzazione sono utilizzate in un’ampia gamma di applicazioni industriali, dalla produzione di materie plastiche e fibre sintetiche allo sviluppo di nuovi materiali per impianti medici e somministrazione di farmaci.
Un esempio di reazione di polimerizzazione è la produzione di polietilene, che è la plastica più utilizzata al mondo. Il polietilene è prodotto dalla polimerizzazione per addizione di monomeri di etilene, che si traduce in un polimero a catena lunga che può essere utilizzato in un’ampia gamma di applicazioni, dall’imballaggio ai materiali da costruzione.
Un altro esempio di reazione di polimerizzazione è la produzione di nylon, una fibra sintetica utilizzata nei tessuti e in altre applicazioni. Il nylon è prodotto dalla polimerizzazione per condensazione di due monomeri, esametilendiammina e acido adipico, che reagiscono per formare una catena polimerica. Il nylon è noto per la sua resistenza e durevolezza ed è utilizzato in un’ampia gamma di applicazioni, dall’abbigliamento ai componenti per automobili.
4. Reazioni di ossidazione
Una reazione di ossidazione è una reazione in cui una molecola perde elettroni. Questo spesso va di pari passo con l’acquisizione di atomi di ossigeno, ma non sempre. Ecco una ripartizione degli aspetti chiave:
- Trasferimento di elettroni: il principio fondamentale dell’ossidazione è la perdita di elettroni da una molecola. Immagina di rimuovere cariche negative, rendendo la molecola più “positiva” in carica.
- Connessione con l’ossigeno: sebbene spesso associata all’acquisizione di atomi di ossigeno, una reazione di ossidazione non lo richiede strettamente. Tuttavia, l’ossigeno è un comune ossidante a causa della sua forte elettronegatività, il che significa che ha un’elevata affinità per attrarre gli elettroni.
Diversi ossidanti utilizzati nell’industria chimica, come l’ossigeno molecolare, il perossido di idrogeno e il cloro, accettano elettroni dalla molecola bersaglio. La scelta dell’ossidante dipende da fattori come costo, selettività e condizioni di reazione.
I catalizzatori industriali accelerano la reazione senza consumarsi. I metalli di transizione come rame, manganese e vanadio sono usati frequentemente. Possono migliorare la selettività, ridurre il consumo di energia e migliorare l’efficienza del processo.
Le reazioni di ossidazione sono usate in diversi settori:
1. Produzione di prodotti chimici in massa:
- L’acido acrilico è importante per fibre acriliche, vernici e adesivi. È prodotto dall’ossidazione del propilene con aria su catalizzatori di ossido di metallo.
- L’acido tereftalico è l’elemento costitutivo delle plastiche PET; è prodotto tramite ossidazione in fase liquida del p-xilene usando aria o ossigeno.
- L’acido nitrico è usato nei fertilizzanti, negli esplosivi e nella produzione di nylon. È sintetizzato tramite il processo Ostwald, che prevede l’ossidazione dell’ammoniaca con aria su catalizzatori di platino-rodio.
2. Prodotti chimici e farmaceutici fini:
- Ossidazioni selettive: alterare con precisione gruppi funzionali specifici in molecole complesse è fondamentale per la sintesi di prodotti farmaceutici. Gli enzimi o i catalizzatori di metalli di transizione consentono ossidazioni mirate con reazioni collaterali minime.
- Idrossilazioni: l’introduzione di gruppi idrossilici è fondamentale per molti prodotti farmaceutici. Metodi come la diidrossilazione asimmetrica di Sharpless utilizzano catalizzatori chirali per un elevato stereocontrollo.
3. Bonifica ambientale:
- Trattamento delle acque reflue: l’ossidazione con ozono o perossidi disinfetta efficacemente l’acqua e degrada gli inquinanti organici.
- Desolforazione dei gas di combustione: la rimozione degli ossidi di zolfo dalle emissioni delle centrali elettriche comporta un lavaggio a umido con ossidanti come l’idrossido di calcio.
5. Reazione di idrogenazione
Una reazione di idrogenazione è un tipo specifico di reazione di riduzione in cui una molecola acquisisce atomi di idrogeno. Ciò si verifica spesso in presenza di un catalizzatore e determina la saturazione dei legami insaturi, in genere doppi o tripli legami, nella molecola reagente.
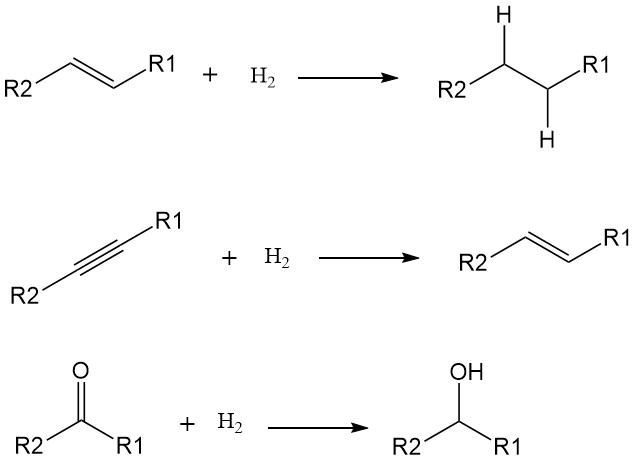
L’aggiunta di atomi di idrogeno (H) a una molecola ne aumenta la saturazione e ne riduce la reattività. Mentre alcune idrogenazioni possono verificarsi ad alte temperature senza catalizzatori, il loro utilizzo riduce significativamente l’energia di attivazione e accelera la reazione in condizioni più miti. I metalli di transizione come nichel, palladio e platino sono catalizzatori comuni per l’idrogenazione.
Le idrogenazioni in genere prendono di mira doppi e tripli legami, convertendoli in legami singoli. Esempi includono:
- Alcheni ad alcani: Trasformazione di idrocarburi insaturi come l’etilene in idrocarburi saturi come l’etano.
- Alchini ad alcheni: conversione di idrocarburi a triplo legame come l’acetilene in alcheni a doppio legame come l’etilene.
- Gruppi carbonilici ad alcoli: Riduzione di chetoni e aldeidi con gruppi carbonilici (C=O) ad alcoli con gruppi idrossilici (OH).
Le reazioni di idrogenazione sono utilizzate in vari settori, tra cui:
- Lavorazione dell’olio vegetale: indurimento degli oli liquidi mediante conversione dei grassi insaturi in grassi saturi per la produzione di margarina.
- Raffinazione del carburante: desolforazione e miglioramento della qualità di benzina e gasolio.
- Produzione farmaceutica: sintesi di vari prodotti farmaceutici e chimici fini.
L’idrogenazione è utilizzata anche in:
- Industria alimentare e delle bevande: lavorazione di grassi e oli per prodotti alimentari.
- Polimerizzazione: creazione di polimeri con proprietà specifiche.
- Celle a combustibile a idrogeno: conversione di idrogeno e ossigeno in elettricità.
6. Reazione di carbonilazione
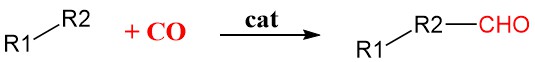
La carbonilazione è un metodo generale nella sintesi organica che aggiunge monossido di carbonio (CO) alle molecole organiche utilizzando catalizzatori di metalli di transizione come rodio, iridio, palladio o nichel. Questi catalizzatori legano e attivano la molecola di CO, rendendola più reattiva e consentendole di essere incorporata nel substrato organico.
È una reazione altamente selettiva, il che significa che può aggiungere con precisione la molecola di CO alla posizione desiderata nella molecola con reazioni collaterali minime.
Ciò lo rende prezioso per la produzione di un’ampia gamma di sostanze chimiche importanti, tra cui:
- Acido acetico: Oltre il 70% dell’acido acetico sintetico mondiale viene prodotto utilizzando la carbonilazione metanolo catalizzata da rodio o iridio.
- Derivati degli amminoacidi: L’amidocarbonilazione è un’area di crescente interesse per la creazione di preziosi derivati degli amminoacidi utilizzati in prodotti farmaceutici e in altri settori.
- Intermedi farmaceutici: la carbonilazione degli alogenuri aromatici sta emergendo come procedura standard per la creazione di importanti elementi costitutivi per farmaci e altre molecole bioattive.
7. Reazione di acilazione
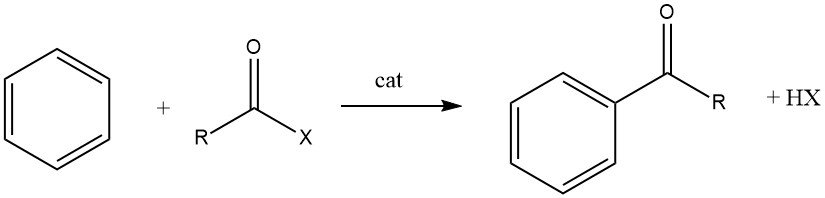
L’acilazione di Friedel-Crafts comporta la produzione di un chetone aromatico tramite la reazione tra un composto aromatico e un agente acilante, che potrebbe essere un alogenuro acilico, un’anidride acida, un acido o un estere. Questa reazione avviene in presenza di un catalizzatore acido.
L’acilazione di substrati aromatici ha una notevole importanza industriale in quanto viene utilizzata per la sintesi di intermedi aromatici ampiamente impiegati nella produzione di prodotti farmaceutici, insetticidi, plastificanti, coloranti, profumi e vari altri prodotti commerciali. Questi composti speciali sono in genere prodotti su scala più piccola rispetto ai prodotti alchilati.
| Agente acilante | Composto aromatico | Prodotto | Uso finale |
|---|---|---|---|
| Anidride acetica | benzene | acetofenone | profumi, prodotti farmaceutici, solventi, plastificanti |
| Anidride acetica | toluene | 4-metilacetofenone | profumi |
| Anidride acetica | anisolo | 4-metossiacetofenone | profumi |
| Anidride acetica | isobutilbenzene | 4-isobutilattofenone | prodotti farmaceutici |
| Cloruro di dicloroacetile | 1,2-diclorobenzene | α,α,2,4-tetracloroacetofenone | insetticidi |
| Cloruro di clorobutirrico | fluorobenzene | cloropropilene 4-fluorofenil chetone | farmaci |
| Tetraclorometano | benzene | benzofenone | farmaci, insetticidi, profumi |
| Cloruro di benzoile | benzene | benzofenone | |
| Fosgene | N,N-dimetilanilina | 4,4'-bis-dimetilamminobenzofenone | coloranti |
| Ftalico anidride | benzene | acido 2-benzoilbenzoico | antrachinone |
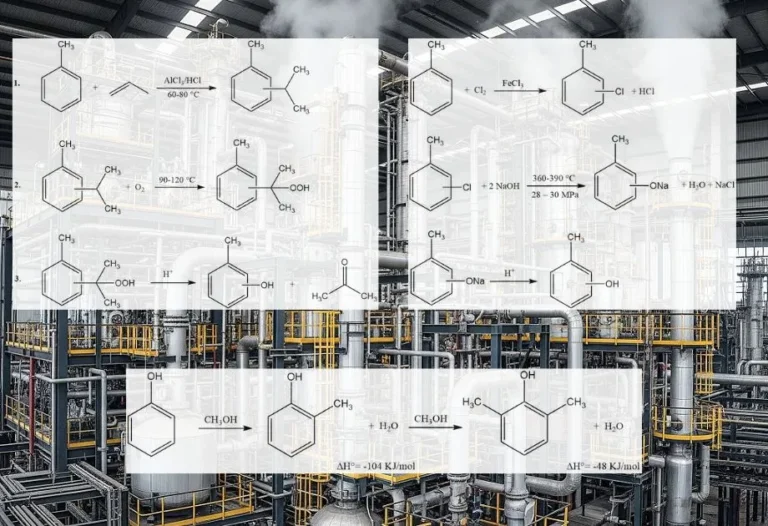
8. Reazione di alchilazione
L’alchilazione di Friedel-Crafts dei composti aromatici comporta una sostituzione elettrofila acido-catalizzata, in cui un gruppo alchilico sostituisce un idrogeno aromatico. Una vasta gamma di agenti alchilanti, come olefine, alogenuri alchilici e alcoli, è comunemente impiegata a questo scopo.
Questa reazione può essere applicata a vari substrati aromatici, inclusi composti eteroaromatici e persino composti come il ferrocene. Queste reazioni sono in genere rapide ed esotermiche e sono spesso condotte in condizioni miti nella fase liquida.
Tuttavia, in alcuni casi, vengono utilizzati processi in fase di vapore con condizioni più severe per determinati substrati. Quando olefine, alogenuri alchilici e alcoli vengono utilizzati come agenti alchilanti, le reazioni complessive procedono come segue:
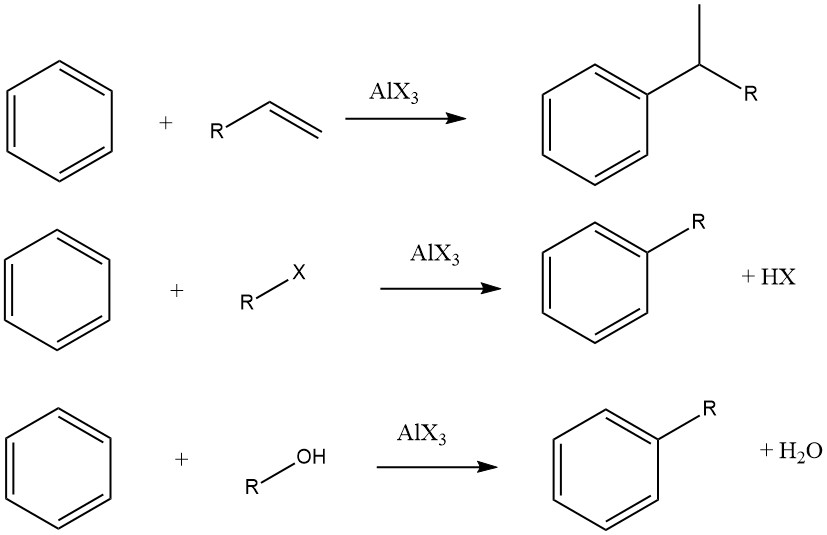
Il grado di isomerizzazione della frazione alchilica e l’aderenza alla regola di Markovnikov durante il processo di aggiunta variano a seconda dell’acidità del catalizzatore.
Esempi di usi delle reazioni di alchilazione sono la produzione di etilbenzene, cumene e alchilbenzeni dal benzene, l’alchilazione del toluene con propene per produrre cimene; l’alchilazione dei fenoli per produrre alchilfenoli; e l’alchilazione di vari composti aromatici eterociclici, tra cui furani, tiofeni e N-eterocicli.
9. Reazione di nitrazione
La reazione di nitrazione è l’introduzione irreversibile di uno o più gruppi nitro (NO2) in un nucleo aromatico, in sostituzione di un atomo di idrogeno.
La nitrazione è una reazione di sostituzione elettrofila, rappresentata dalla seguente equazione:
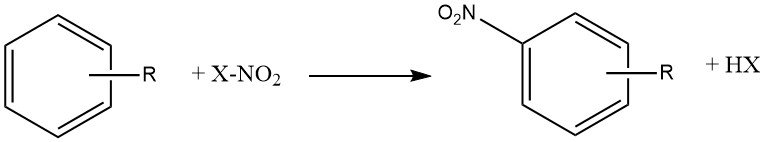
L’introduzione del gruppo nitro disattiva l’anello verso un’ulteriore sostituzione elettrofila, rendendo la dinitrazione un evento raro nelle condizioni utilizzate per la mononitrazione.
Di solito sono richieste condizioni più vigorose per la dinitrazione, che richiedono eccesso, acido più forte e temperatura più elevata. Queste condizioni sono spesso applicate a composti mononitro isolati, piuttosto che eseguire reazioni graduali in situ.
La reazione di nitrazione è altamente esotermica, come dimostrato dalla mononitrazione di benzene (ΔH = -117 kJ/mol) e naftalene (ΔH = -209 kJ/mol). Di conseguenza, è uno dei processi unitari più potenzialmente pericolosi gestiti a livello industriale.
I prodotti primari della nitrazione sono composti nitroaromatici monosostituiti, che si formano quando un gruppo nitro viene introdotto nel nucleo aromatico. I prodotti industriali importanti della nitrazione possono includere:
- Nitrobenzene (C6H5NO2)
- Nitrotolueni (ad esempio, orto-nitrotoluene, meta-nitrotoluene e para-nitrotoluene)
- Nitronaftaleni (ad esempio, alfa-nitronaftalene e beta-nitronaftalene)
- Nitrofenoli (ad esempio, orto-nitrofenolo, meta-nitrofenolo e para-nitrofenolo)
- Nitroaniline (ad esempio, orto-nitroanilina, meta-nitroanilina e para-nitroanilina)
10. Reazione di deidrogenazione
La deidrogenazione, l’opposto dell’idrogenazione, si riferisce a una reazione chimica in cui l’idrogeno (H) viene rimosso da una molecola, solitamente organica. Questo processo apparentemente semplice svolge un ruolo cruciale in vari aspetti della chimica, dalle reazioni fondamentali di laboratorio ai processi industriali su larga scala.
Questa reazione comporta la rottura di un legame C-H, il rilascio di gas H2 ed è spesso endotermica, richiedendo calore o catalizzatori specifici per superare la barriera energetica di attivazione.
La deidrogenazione è una reazione importante nell’industria chimica utilizzata per:
1. Produzione di sostanze chimiche di valore: la deidrogenazione è essenziale per realizzare numerosi prodotti, come:
- Stirene: monomero per plastiche in polistirene, prodotto dalla deidrogenazione dell’etilbenzene.
- Alcheni: idrocarburi insaturi utilizzati per ulteriori reazioni nella produzione di polimeri, carburanti e lubrificanti.
- Prodotti chimici fini: prodotti farmaceutici, agrochimici e altre molecole specializzate spesso comportano fasi di deidrogenazione.
2. Nel settore energetico, la deidrogenazione catalitica degli idrocarburi leggeri offre il potenziale per una produzione di carburante più pulita rispetto ai metodi tradizionali.
3. Disidratazione: la rimozione dell’acqua dagli alcoli è un caso speciale di deidrogenazione, che forma alcheni eliminando una molecola di acqua.
11. Reazione di esterificazione
L’esterificazione è la reazione reversibile tra acidi carbossilici e alcoli per produrre un estere e acqua in presenza di un catalizzatore.
La reazione di esterificazione procede attraverso un meccanismo in tre fasi:
- Protonazione: Un catalizzatore acido di Brønsted protona l’ossigeno carbonilico dell’acido carbossilico, migliorandone il carattere elettrofilo.
- Attacco nucleofilo: L’atomo di ossigeno dell’alcol, che agisce come nucleofilo, attacca il carbonio carbonilico elettrofilo, formando un intermedio tetraedrico.
- Deprotonazione e perdita d’acqua: L’intermedio subisce una deprotonazione, spesso da parte del catalizzatore, seguita dall’eliminazione dell’acqua, che porta alla formazione dell’estere e dell’acqua come sottoprodotto.
L’esterificazione è una reazione di equilibrio e il principio di Le Chatelier detta strategie per migliorare la resa dell’estere. L’impiego di alcol in eccesso, la rimozione dell’acqua (ad esempio tramite distillazione) e l’ottimizzazione della temperatura possono spostare l’equilibrio verso la formazione dell’estere.
La reazione di esterificazione ha applicazioni diffuse:
- Fragranze e cosmetici: gli esteri contribuiscono in modo significativo ai piacevoli aromi di frutta, fiori e profumi.
- Prodotti farmaceutici: numerosi farmaci, tra cui aspirina e penicillina, incorporano funzionalità estere.
- Polimeri: i poliesteri, una classe di polimeri, si formano tramite reazioni di esterificazione e trovano impiego in varie materie plastiche e fibre sintetiche.
- Biocarburanti: l’esterificazione è impiegata nella produzione di biocarburanti come biodiesel.
- Additivi alimentari: gli esteri contribuiscono alla consistenza e al sapore di alcuni prodotti alimentari.
12. Reazione di solfonazione
La solfonazione è una reazione organica versatile che introduce il gruppo acido solfonico (-SO2OH) nei composti aromatici. Questa trasformazione ha un’importanza significativa in vari campi, tra cui la sintesi di detergenti, coloranti e prodotti farmaceutici.
La solfonazione in genere avviene tramite un meccanismo di sostituzione aromatica elettrofila. I passaggi chiave includono:
- Formazione dell’elettrofilo: l’anidride solforica (SO3) o l’acido solforico fumante (H2SO4 + SO3) agisce come agente solfonante, generando la molecola elettrofila SO3.
- Sostituzione elettrofila aromatica: l’elettrofilo SO3 attacca la nuvola π ricca di elettroni dell’anello aromatico, formando un intermedio complesso σ.
- Protonazione e desolfonazione: l’intermedio perde un protone, portando alla formazione del prodotto acido arilsolfonico.
Tuttavia, la solfonazione è spesso reversibile. In condizioni acide e temperature elevate, il gruppo acido solfonico può subire desolfonazione, rilasciando il composto aromatico genitore e l’anidride solforosa.
La solfonazione trova numerose applicazioni nella sintesi di varie molecole rilevanti a livello industriale e biologico:
- Detergenti: il dodecilbenzenesolfonato di sodio (SDS), un tensioattivo anionico ampiamente utilizzato, viene prodotto mediante solfonazione del dodecilbenzene.
- Coloranti: i coloranti azoici solfonati presentano colori vivaci e sono impiegati in diverse applicazioni tessili.
- Prodotti farmaceutici: i sulfonamidi, una classe di antibiotici, si basano sulla presenza di un gruppo acido solfonico per la loro attività antibatterica.
Oltre a questi esempi, la solfonazione svolge un ruolo importante nella sintesi di numerosi altri composti, tra cui resine a scambio ionico, additivi alimentari e prodotti agrochimici.
Riferimenti
- Callister, W. D., & Rethwisch, D. G. (2018). Materials Science and Engineering: An Introduction. Wiley.
- Chang, R. (2010). Chemistry (10th ed.). McGraw-Hill.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press.
- Green, J. (2018). An Introduction to the Chemical Process Industry. CRC Press.
- Kiehl, J. T. (2013). Industrial Chemical Processes: An Introduction. John Wiley & Sons.
- Meyers, R. A. (Ed.). (2001). Encyclopedia of Analytical Chemistry. Wiley.
- Seader, J. D., & Henley, E. J. (2011). Separation Process Principles. Wiley.
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics (7th ed.). McGraw-Hill.
- Sperling, L. H. (Ed.). (2018). Introduction to Physical Polymer Science (4th ed.). Wiley.
- Turton, R., Bailie, R. C., Whiting, W. B., & Shaeiwitz, J. A. (2018). Analysis, Synthesis, and Design of Chemical Processes (5th ed.). Pearson.