Production et utilisations de sulfate d’ammonium
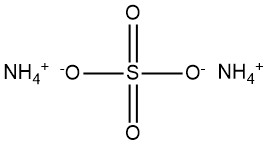
Le sulfate d’ammonium, (NH4)2SO4, est apparu comme un composé important au cours du 19ème siècle produit par l’ammoniac trouvé dans le gaz de four à coke. Au début du XXe siècle, la synthèse industrielle de l’ammoniac a pris de l’importance, ce qui a conduit à l’adoption du sulfate d’ammonium comme agent fertilisant.
Au fil du temps, cependant, son importance a diminué en raison de l’avènement d’engrais à base d’azote plus puissants. Notamment, son application a persisté à plus petite échelle pour des applications industrielles spécifiques.
Depuis environ 1960, le sulfate d’ammonium a connu une production croissante en tant que coproduit dans les procédures de synthèse organique. Dans certaines régions, le sulfate d’ammonium est produit à partir de gypse.
Table des matières
1. Propriétés du sulfate d’ammonium
Le sulfate d’ammonium, ayant une masse molaire de 132,14 g/mol, affiche une densité de 1,77 g/cm³ à 20 °C, ainsi qu’une capacité thermique spécifique moyenne de 1,423 J/g·K dans la plage de température de 2 à 55 °C .
Sa structure cristalline est bipyramidale rhombique. Il est à noter que la taille et la forme des cristaux peuvent être influencées par des substances présentes dans la solution de cristallisation, et cet aspect est important dans la production commerciale.
Le comportement thermique du sulfate d’ammonium est complexe. A la pression atmosphérique, il ne peut être fondu sans subir de décomposition, entraînant le dégagement d’ammoniac et la formation de bisulfate.
Or, dans le cas du sulfate d’ammonium anhydre pur, la pression de vapeur d’ammoniac reste pratiquement nulle jusqu’à ce que 80 °C soient atteints. Au-delà de 300 °C, la décomposition entraîne la génération de N2, SO2, SO3 et H2O, à l’exception de l’ammoniac.
Le sulfate d’ammonium ne forme pas d’hydrates. Le changement de chaleur lors de la dissolution de 1 mol de sel dans 400 mol d’eau est de +9,92 kJ à 18 °C, tandis que la chaleur intégrale de la solution est de +6,57 kJ/mol à 30 °C. La chaleur différentielle de la solution pour une solution saturée est de +6,07 kJ/mol à 30 °C.
Le sulfate d’ammonium ne présente une déliquescence qu’au-dessus de 80% d’humidité relative, ce qui permet son stockage dans de l’air sec et l’ajout d’ammoniac réduit considérablement sa solubilité.
À 10 °C, la solubilité passe de 73 g (NH4)2SO4 dans 100 g d’eau à environ 18 g de sel dans 100 g d’une solution aqueuse d’ammoniac à 24,5 %.
La solubilité du sulfate de calcium dans une solution de sulfate d’ammonium est approximativement le double de sa solubilité dans l’eau. Cette propriété favorise la réaction du gypse ou de l’anhydrite avec des solutions contenant du carbonate d’ammonium et du sulfate d’ammonium.
Le composé reste insoluble dans les solvants organiques typiques. La dissolution du sulfate d’ammonium dans l’éthanol, le propanol, le butanol, l’acétone, la pyridine et des solvants similaires entraîne la formation de deux phases distinctes : une phase aqueuse et une phase de solvant organique.
Les solutions de sulfate d’ammonium et ses solutions dans l’acide sulfurique ne corrodent pas l’acier inoxydable spécial Cr-Ni. Le fer et l’aluminium restent non réactifs dans les solutions ammoniacales. Dans les cas où les solutions contiennent des substances corrosives pour l’acier inoxydable (par exemple, Cl−), les récipients peuvent être protégés en les revêtant de briques résistantes aux acides.
2. Production de sulfate d’ammonium
Le sulfate d’ammonium est produit industriellement à partir de :
- Gaz de cokerie
- Ammoniac et acide sulfurique
- Synthèses organiques, telles que la production de caprolactame
- Gypse, ammoniac et dioxyde de carbone
2.1. Du gaz de cokerie
L’utilisation du gaz de four à coke comme précurseur pour la production de sulfate d’ammonium a connu un déclin substantiel au cours des dernières décennies. Cette tendance peut être attribuée à la fermeture partielle des aciéries et aux progrès des méthodes de cokéfaction qui produisent des quantités réduites de sulfate d’ammonium.
Dans la méthode directe, le gaz de four à coke non traité est introduit dans l’acide sulfurique, ce qui donne du sulfate d’ammonium teinté par des dérivés de goudron pigmentés.
Alternativement, le procédé indirect implique l’extraction de l’ammoniac du gaz de four à coke par lavage à l’eau, suivi d’une libération à l’aide d’une suspension de chaux et de sa combinaison avec de l’acide sulfurique.
2.2. De l’ammoniac et de l’acide sulfurique
La chaleur générée par la réaction entre l’ammoniac et l’acide sulfurique peut vaporiser efficacement l’eau si la concentration en acide dépasse 70 %. La réaction est représentée comme suit :
2NH3(g) + H2SO4(l) → (NH4)2SO4(s) ΔH = -274 kJ/mol
Dans la pratique contemporaine, la réaction a lieu au sein de saturateurs, dispositifs dérivés des cristalliseurs à évaporation utilisés antérieurement. Le procédé saturateur intègre la neutralisation et la cristallisation dans un seul appareil.
L’acide sulfurique est introduit côté aspiration, tandis que l’ammoniac est ajouté côté refoulement d’une pompe à circulation forcée. La solution métastable qui en résulte donne des particules allant de 0,5 à 3 mm de taille lors de la cristallisation.
Les processus continus de décharge, de centrifugation, de séchage et de refroidissement facilitent l’isolement du sulfate d’ammonium. Pour faciliter la croissance cristalline, de petites quantités d’acide phosphorique, d’urée ou de sels inorganiques sont ajoutées.
2.3. Coproduit dans les synthèses organiques
Le sulfate d’ammonium apparaît comme sous-produit lors de la synthèse d’intermédiaires de fibres synthétiques, tels que le caprolactame, l’acrylonitrile et le méthacrylate de méthyle, ainsi que la production d’acide formique et d’acrylamide.
La source importante est la production de caprolactame, vitale pour la synthèse du nylon 6. Les procédés traditionnels au caprolactame produisent 2,5 à 4,5 tonnes de sulfate d’ammonium par tonne de lactame. Des procédés récents développés par différentes entités ont réussi à réduire cette fourchette à 1,7 – 1,8 tonne par tonne de lactame.
2.4. Du gypse
L’anhydrite et le gypse réagissent avec NH3 et CO2 :
CaSO4(·2H2O) + (NH4)2CO3 → (NH4)2SO4 + CaCO3(·2H2O)
Ce processus, mis en place par BASF pendant la Première Guerre mondiale, reste important dans les régions ayant un accès limité à l’acide sulfurique, notamment l’Inde, le Pakistan et la Turquie. Le gypse finement broyé est exposé à une solution de carbonate d’ammonium dans une cascade de récipients agités.
Le mélange réactionnel, comprenant une solution de carbonate de calcium et de sulfate d’ammonium, est filtré à l’aide de filtres rotatifs sous vide. Le carbonate de calcium lavé qui en résulte est utilisé pour la fertilisation de la chaux, la production de nitrate d’ammonium calcique, de matière première pour le verre ou de charge pour le caoutchouc ou le PVC.
La solution de sulfate d’ammonium légèrement trouble subit une filtration à l’aide de filtres-presses, suivie d’une acidification avec H2SO4 et d’un traitement à travers des cristalliseurs d’évaporation à plusieurs étages pour produire du sulfate d’ammonium à gros grains.
Une autre technique, le Continental Engineering Process, introduit directement du NH3 et du CO2 dans une suspension de gypse à l’intérieur d’un grand récipient agité cylindrique.
2.5. Autres processus
Plusieurs méthodes utilisant du SO2 et de l’oxygène atmosphérique sont devenues obsolètes.
Il existe un intérêt croissant pour les procédés utilisant l’ammoniac pour éliminer le SO2 des gaz d’échappement des centrales électriques, par exemple le procédé Walther qui utilise un lavage en deux étapes des gaz d’échappement sans poussière pour générer une solution concentrée de sulfite d’ammonium. Cette solution est ensuite oxydée avec de l’oxygène atmosphérique et séchée par pulvérisation en poudre de sulfate d’ammonium, qui est ensuite granulée.
3. Utilisations du sulfate d’ammonium
L’application prédominante du sulfate d’ammonium est comme engrais, avec une utilisation industrielle minimale. Dans les pays industrialisés, le sulfate d’ammonium apparaît généralement comme co-produit ou sous-produit et principalement vendu comme engrais, en particulier dans les régions en développement.
Sa teneur limitée en azote dans les pays industrialisés contribue à des coûts de transport plus élevés par unité d’azote par rapport aux autres engrais à base d’azote.
En Afrique et en Asie, le sulfate d’ammonium a une fonction importante dans la fertilisation des cultures de riz, de thé et de caoutchouc. Cependant, dans des régions comme l’Europe, les États-Unis et le Brésil, il forme fréquemment un constituant d’engrais mélangés et complexes.
Dans l’industrie, le (NH4)2SO4 est utilisé pour la synthèse de persulfates, d’agents ignifuges et de poudres extinctrices.
Il démontre son utilité dans les processus de tannage, ainsi que dans des industries telles que la photographie, le textile et la production de verre. En outre, le sulfate d’ammonium sert de source de nutriments pour les cultures de levures et de bactéries.
Les références
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Industrial Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128498910000035
FAQ
Le sulfate d’ammonium est un composé chimique composé d’azote, d’hydrogène, de soufre et d’oxygène. Il se présente couramment sous la forme d’une poudre cristalline blanche ou d’une substance granuleuse.
La formule chimique du sulfate d’ammonium est (NH4)2SO4
Le sulfate d’ammonium est principalement utilisé comme engrais pour fournir les nutriments essentiels, en particulier l’azote et le soufre, aux plantes. De plus, il sert à des fins industrielles telles que la production de persulfates, d’agents ignifuges et de poudres extinctrices. Il trouve des applications dans le tannage, la photographie, les textiles, la fabrication du verre et comme nutriment pour les cultures de levures et de bactéries.
La masse molaire du sulfate d’ammonium est d’environ 132,14 grammes par mole (g/mol).
Le sulfate d’ammonium peut être produit par divers procédés. Une méthode consiste à faire réagir du gaz ammoniac avec de l’acide sulfurique pour produire (NH4)2SO4. Il peut aussi être issu de gaz de cokerie ou comme co-produit dans des synthèses organiques. Une autre approche implique la réaction du gypse avec l’ammoniac et le dioxyde de carbone.
Le sulfate d’ammonium est généralement considéré comme sûr pour les humains lorsqu’il est utilisé conformément aux directives et réglementations établies. En tant qu’engrais, il présente un risque minimal lorsqu’il est appliqué correctement aux cultures.
