Phtalimide : propriétés, réactions, production et utilisations
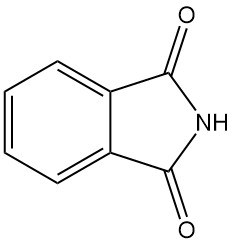
Qu’est-ce que le phtalimide ?
Le phtalimide, également connu sous le nom de 1,3-dioxoisoindoline, est un composé organique dont la formule chimique est C8H5O2N. Il s’agit d’un solide blanc légèrement soluble dans l’eau et soluble dans les solutions basiques.
Table des matières
1. Propriétés physiques du phtalimide
Le phtalimide est un composé hétérocyclique qui forme des aiguilles ou des prismes blancs lorsqu’il est cristallisé en solution et des plaquettes par sublimation.
Sa solubilité dans l’eau est limitée (0,3 g à 20 °C, 0,9 g à 50 °C et 2,2 g à 100 °C pour 100 g d’eau). Cependant, il se dissout facilement dans l’acide acétique, la solution d’hydroxyde de sodium et la solution d’hydroxyde de potassium.
Le phtalimide se sublime lorsqu’il est chauffé au-dessus de son point de fusion. Cette propriété facilite sa purification.
Certaines des propriétés physiques du phtalimide sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [85-41-6] |
| Formule | C8H5NO2 |
| Poids moléculaire | 147,14 g/mol |
| Point de fusion | 238 °C |
| pKa | 8,30 |
| Chaleur de combustion | 3 560 kJ/mol |
| Chaleur de fusion | 187,6 J/g |
| Capacité thermique spécifique (100 °C) | 1,21 J g-1 K-1 |
| Pression de vapeur | |
| à 120 °C | 0,10 mbar |
| à 150 °C | 0,95 mbar |
| à 180 °C | 5,93 mbar |
| à 220 °C | 30,7 mbar |
| à 254 °C | 187,6 mbar |
| Point d'éclair | 214 °C |
| Température d'inflammation | 530 °C |
2. Réactions du phtalimide
Le phtalimide réagit avec les bases pour former des sels hydrosolubles. Ces sels peuvent ensuite subir d’autres réactions avec des halogènes (Cl2, Br2 et I2) pour donner les dérivés N-chloro, N-bromo ou N-iodo correspondants du phtalimide.
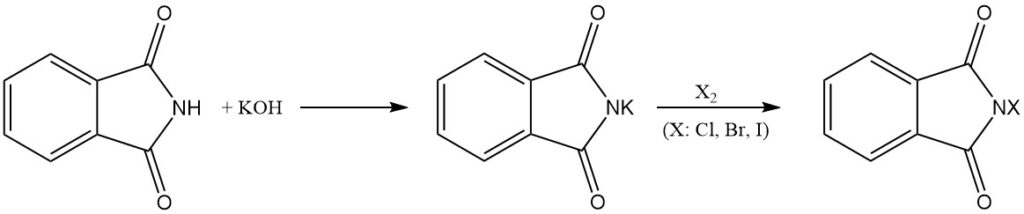
Les dérivés N-halogénés peuvent également être obtenus en traitant des phtalimides de métaux alcalins (par exemple, le phtalimide de potassium) avec de l’acide hypochloreux (HOCl) ou hypobromeux (HOBr).
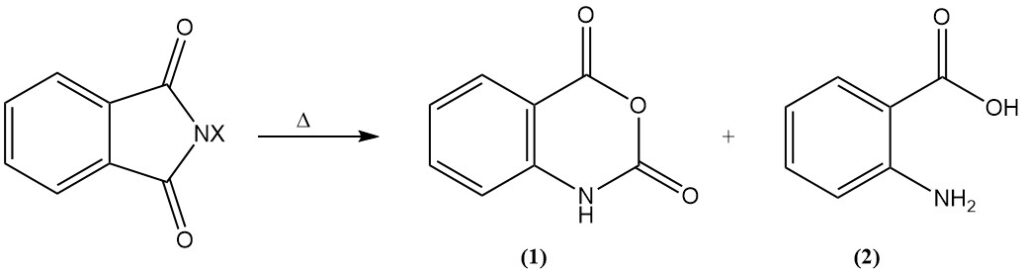
Lorsqu’ils sont chauffés, les dérivés N-halogénés subissent une dégradation d’Hofmann, ce qui entraîne la formation d’anhydride isatoïque (1) ou d’acide anthranilique (acide o-aminobenzoïque) (2).
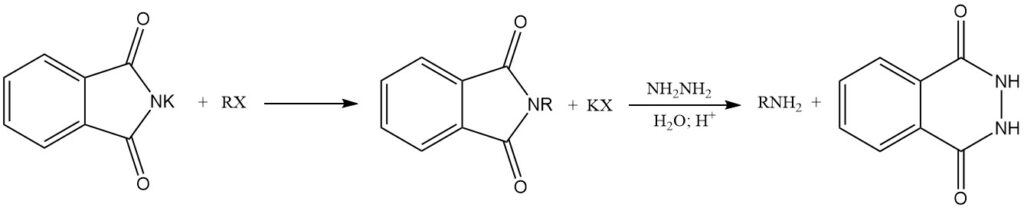
La réaction des phtalimides de métaux alcalins avec des halogénures d’alkyle (RX) produit des N-alkylphtalimides. L’hydrolyse ou le traitement ultérieur à l’hydrazine (hydrazinolyse) de ces N-alkylphtalimides forme des amines primaires. Cette séquence de réaction est connue sous le nom de synthèse de Gabriel.
3. Production industrielle de phtalimide
Le phtalimide est principalement synthétisé à partir d’anhydride phtalique et d’ammoniac, bien qu’il existe des méthodes alternatives utilisant l’urée ou l’ammoxydation de l’o-xylène.
3.1. Production de phtalimide à partir d’anhydride phtalique et d’ammoniac
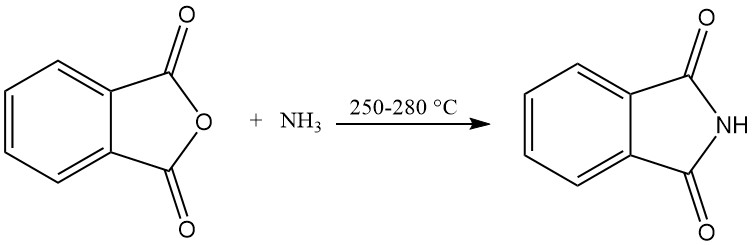
Les procédés continus sont utilisés dans la production industrielle de phtalimide.
Le procédé à tube de réaction vertical utilise un tube de réaction vertical chauffé de l’extérieur rempli de matériau de remplissage. L’anhydride phtalique fondu et l’excès d’ammoniac sont introduits en continu dans la partie supérieure du tube et réagissent à 250–280 °C.
Les gaz de réaction sont ensuite refroidis dans une chambre de sublimation, où le phtalimide solide se dépose et est évacué. L’excès d’ammoniac et d’eau est éliminé par un tuyau d’échappement. Ce procédé permet d’obtenir du phtalimide d’une pureté de 99 % et un rendement élevé de 98 %.
Dans le procédé à contre-courant, l’anhydride phtalique fondu est introduit en continu dans la partie supérieure d’un réacteur, tandis que l’ammoniac est introduit en continu dans la partie inférieure. La température augmente progressivement d’environ 150 °C en haut jusqu’à un maximum de 270 °C en bas.
Le phtalimide fondu d’une pureté de 99 % sort du réacteur et est refroidi et floconné. Il peut être dissous dans une solution alcaline aqueuse pour une utilisation ultérieure.
Les gaz d’échappement de la tête du réacteur, contenant de la vapeur d’eau, du phtalimide sublimé et des composants n’ayant pas réagi, sont épurés avec du phtalimide fondu provenant du fond du réacteur à contre-courant. Ce processus d’épuration purifie les gaz d’échappement et permet la récupération des matières de départ n’ayant pas réagi.
3.2. Production de phtalimide à partir d’anhydride phtalique et d’urée
Le phtalimide peut être produit à partir d’anhydride phtalique et d’urée dans un procédé sans solvant ou dans un solvant.
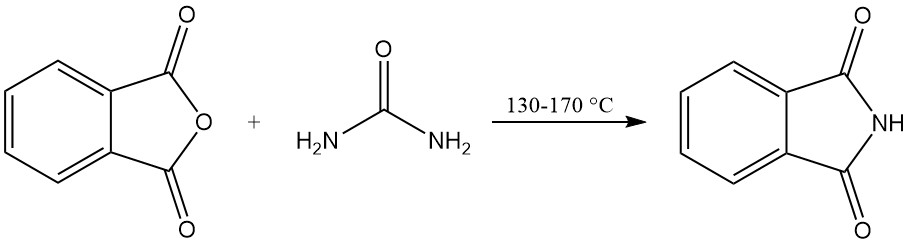
Dans le procédé sans solvant, un mélange d’anhydride phtalique et d’urée est chauffé dans un récipient hermétique. La réaction se déroule à 130–140 °C, avec du dioxyde de carbone et de la vapeur d’eau comme gaz sous-produits. La température monte à environ 160 °C en raison de la réaction exothermique.
La réaction est terminée lorsque le dégagement gazeux cesse. Le mélange réactionnel solidifié est ensuite refroidi, broyé et utilisé directement sans purification supplémentaire. Cette méthode offre des rendements élevés, supérieurs à 90 %.
Dans le procédé utilisant un solvant, le solvant est généralement un hydrocarbure substitué ou non substitué, un composé aromatique ou un composé hétéroaromatique (par exemple, n-propylbenzène, cumène, 1,2-dichlorobenzène, picoline).
Le solvant doit être choisi de telle sorte que l’urée soit insoluble tandis que l’acide phtalique ou l’anhydride ait une solubilité limitée. La réaction se produit en dessous du point d’ébullition du solvant (généralement 160–170 °C). Une fois terminé, le produit phtalimide pur est isolé par filtration et lavage à l’eau, ce qui permet d’obtenir des rendements de 95–100 %.
3.3. Production de phtalimide à partir d’o-xylène
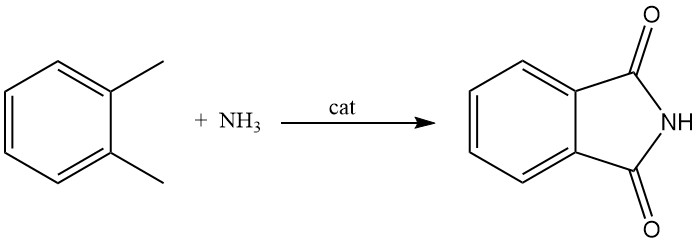
Bien que moins courant que les méthodes utilisant l’anhydride phtalique, le phtalimide peut également être produit à partir d’o-xylène. Ce procédé consiste à faire réagir l’o-xylène en phase gazeuse avec de l’ammoniac en présence d’un catalyseur à base d’oxyde métallique. Ce catalyseur agit également comme donneur d’oxygène.
En fonction des conditions de réaction et du contrôle, ce procédé peut produire sélectivement du phtalimide, du phtalamide ou du phtalonitrile.
4. Utilisations du phtalimide
Le phtalimide est utilisé comme matière première dans plusieurs industries. C’est un précurseur pour la production d’acide anthranilique par dégradation d’Hofmann et est utilisé dans la synthèse de Gabriel pour produire une large gamme d’amines primaires.
Le phtalimide est utilisé comme groupe protecteur en chimie organique, notamment dans la synthèse des peptides. En réagissant avec le groupe amino, il empêche les réactions indésirables tandis que le reste de la molécule peut être transformé. Il peut être éliminé sélectivement pour donner l’amine libre.
Il est également utilisé comme intermédiaire dans la production de pesticides agricoles, de produits de préservation du bois, de certains pigments et de produits pharmaceutiques tels que la thalidomide, l’amphotalide, le taltrimide, le talmétoprime et l’aprémilast.
5. Toxicologie du phtalimide
Bien que les données sur la toxicité du phtalimide soient limitées, les informations disponibles suggèrent qu’il présente une faible toxicité.
Le phtalimide se décompose dans l’organisme en acide phtalique et en ammoniac.
Des études sur des rats et des souris indiquent une faible toxicité orale aiguë (DL50 > 5000 mg/kg). Aucune irritation cutanée ou oculaire n’a été observée dans les études sur des lapins.
Des études par inhalation sur des rats à diverses concentrations n’ont révélé aucun effet indésirable lié à la substance. Des études à long terme font défaut.
Le test d’Ames n’a montré aucun effet génotoxique (dommages à l’ADN).
Aucune donnée fiable sur la toxicité pour la reproduction n’est disponible.
Références
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- PRACTICAL CONSIDERATIONS IN PREPARATION OF AMINES. – https://www.sciencedirect.com/science/article/abs/pii/B9780080119137500136
- https://go.drugbank.com/categories/DBCAT000722
