Méthodes de production d’alcools aliphatiques
Industriellement, plusieurs alcools vitaux ont une importance significative. Ceux-ci comprennent le méthanol, l’éthanol, le 1-propanol, le 1-butanol et le 2-méthyl-1-propanol (également connu sous le nom d’alcool isobutylique).
En outre, les alcools plastifiants (allant de C6 à C11) et les alcools gras (C12-C18) sont largement utilisés dans la production de détergents. Ces alcools sont obtenus principalement par différents procédés : gaz de synthèse (méthanol), synthèse oxo d’oléfines, ou procédé Ziegler.
Outre les applications mentionnées, les alcools servent de solvants et de diluants efficaces pour les peintures, utilisant principalement des alcools C1-C6. Ils agissent également comme intermédiaires essentiels dans la production d’esters et de divers composés organiques. Les alcools trouvent des applications comme agents de flottation, lubrifiants et additifs pour carburants, notamment le méthanol, l’éthanol et l’alcool tert-butylique.
Pour les applications industrielles, les mélanges d’isomères sont souvent préférés en raison de considérations de coût, car les alcools purs peuvent être coûteux. De plus, des mélanges avec des nombres d’atomes de carbone variables peuvent offrir des avantages à des fins spécifiques. En conséquence, la disponibilité sur le marché des mélanges d’alcools est comparable à celle des alcools purs individuels.
Table des matières
Introduction
La production d’alcools aliphatiques se fait par divers procédés industriels, dont certains sont énumérés ci-dessous :
- Synthèse à partir de monoxyde de carbone et d’hydrogène (C1)
- Synthèse oxo, souvent accompagnée d’une hydrogénation des aldéhydes initialement formés (C3 – C20)
- Hydrogénation d’aldéhydes, d’acides carboxyliques ou d’esters
- Condensation aldol des aldéhydes inférieurs suivie d’une hydrogénation des alcénals (C3 → C6, C4 → C8, C8 → C16)
- Oxydation de composés de trialkylaluminium (procédé Ziegler)
- Oxydation des hydrocarbures saturés
- Hydratation des oléfines (C2–C4)
- Homologation des alcools
- Hydrocarbonylation par le procédé Reppe
- Hydrocarboxyméthylation
- Processus de fermentation (C2–C5)
- Procédé Guerbet
Parmi ces procédés, la synthèse de méthanol et d’éthanol est d’une importance primordiale, avec des productions annuelles d’environ 49 × 106 t et 99 × 106 t, respectivement. La synthèse oxo revêt également une importance industrielle importante, représentant environ 6,3 million tons de production annuelle.
De plus, l’hydratation de l’éthylène et du propène pour donner de l’éthanol et du 2-propanol, ainsi que l’oxydation des composés de trialkylaluminium (procédé Alfol ou procédé Ziegler), ont acquis une importance commerciale substantielle.
De plus, les processus de fermentation, en particulier pour la production d’éthanol, ont repris de l’importance dans certaines régions en raison de la hausse des prix du pétrole.
1. Synthèse à partir de monoxyde de carbone et d’hydrogène
Seul le méthanol est produit commercialement à partir de gaz de synthèse. Dans le passé, des procédés tels que Synol, isobutylol et oxyl étaient utilisés, conduisant à des mélanges de composés contenant de l’oxygène avec des alcools comme composants principaux. Cependant, ces méthodes ne sont plus utilisées dans le monde occidental. Des développements plus récents génèrent soit des composés contenant de l’oxygène, soit des mélanges d’alcools.
Un de ces procédés est la méthode IFP (Inst. Français du Pétrole) pour les alcools supérieurs. Il utilise des catalyseurs hautement activés dans des conditions de synthèse de méthanol à basse pression. Le catalyseur est constitué d’oxydes mixtes de cuivre et de cobalt, combinés avec au moins un autre métal (Al, Ce, Cr, Fe, La, Mn, Pr, Nd, Y ou Zn), ainsi qu’au moins un groupe I ou Composé métallique II.
En ajustant la composition du catalyseur, la teneur en alcool la plus élevée dans le produit peut varier entre 20 et 50 % en poids. Cependant, ce processus entraîne la formation de plusieurs sous-produits, tels que des hydrocarbures, des esters et des cétones.
Malgré ces avancées, aucun des nouveaux procédés mentionnés ci-dessus n’est actuellement utilisé dans l’industrie. Cependant, de petites quantités d’alcools supérieurs sont produites comme sous-produits dans la synthèse Fischer-Tropsch.
2. Synthèse Oxo
La synthèse oxo est une méthode utilisée pour préparer des alcools dans la gamme C3-C20. Dans ce processus, les oléfines (hydrocarbures insaturés) réagissent avec le gaz de synthèse (un mélange de monoxyde de carbone et d’hydrogène) pour former des aldéhydes. Par la suite, ces aldéhydes sont hydrogénés pour produire les alcools souhaités.
Une version spécifique de la synthèse oxo est connue sous le nom de procédé Shell, utilisant le catalyseur HCo(CO)3PR3, qui présente une forte activité hydrogénante. Ce catalyseur facilite l’hydrogénation directe de l’aldéhyde initialement formé dans le réacteur oxo.

Le procédé Shell a été appliqué commercialement pour la première fois en utilisant du propène en 1963 pour la production de 1-butanol et de 2-éthylhexanol. Plus tard, en 1965, il a été développé pour fabriquer des alcools détergents. Son application principale est la production d’alcools supérieurs.
Un avantage significatif du procédé Shell est sa capacité à hydroformyler des oléfines avec des doubles liaisons internes. Les conditions de réaction favorisent l’isomérisation de la double liaison, conduisant à la formation d’α-oléfines.
Par exemple, les fractions d’ω-oléfines obtenues à partir d’éthylène par le « procédé SHOP » de Shell peuvent être converties en alcools à l’aide de gaz de synthèse. Les mélanges d’alcools qui en résultent sont constitués jusqu’à 80 % de composés linéaires et trouvent une utilisation dans les industries des plastifiants et des détergents.
3. Hydrogénation des aldéhydes, des acides carboxyliques et des esters
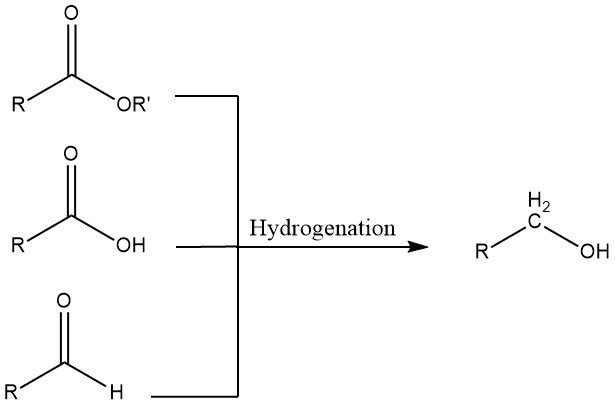
Les aldéhydes peuvent subir une hydrogénation en utilisant des catalyseurs homogènes ou hétérogènes. Les systèmes homogènes sont avantageux lorsque les matières premières contiennent du soufre, qui empoisonnerait les catalyseurs hétérogènes, ou lorsque l’hydrogène utilisé pour l’hydrogénation contient du monoxyde de carbone.
Cependant, dans la plupart des cas, les catalyseurs hétérogènes sont préférés. Ces catalyseurs sont efficaces à la fois dans les réactions en phase gazeuse à des températures de 90 à 180 °C et à des pressions de 25 bar, et dans les réactions en phase liquide à 80 à 220 °C et à des pressions allant jusqu’à 300 bar. La température d’hydrogénation utilisée dans les procédés industriels est choisie comme un compromis entre une utilisation optimale de l’énergie et une longue durée de vie du catalyseur.
Pour les procédés continus, les systèmes à lit fixe avec catalyseurs sont privilégiés. L’aldéhyde, soit sous forme vapeur diluée avec un excès d’hydrogène, soit sous forme liquide avec de l’hydrogène, est envoyé dans la conduite haute pression contenant le lit catalytique.
Pour dissiper la chaleur générée par la réaction, on fait circuler de l’hydrogène dans un échangeur de chaleur. L’hydrogénation du 2-éthyl-2-hexenal, une réaction particulièrement importante, est typiquement effectuée en une seule étape en utilisant un catalyseur contenant du nickel.
Des procédés similaires en une seule étape ont été proposés. Cependant, les procédés en deux étapes sont également courants, où l’hydrogénation primaire se produit en phase gazeuse (par exemple, en utilisant des catalyseurs contenant du cuivre), et l’hydrogénation secondaire se produit en phase liquide ou en lit ruisselant (par exemple, avec des catalyseurs contenant du nickel). catalyseurs).
Ces catalyseurs sont généralement supportés sur de l’oxyde d’aluminium ou du gel de silice. En plus du nickel et du cuivre, des catalyseurs réussis ont été développés en utilisant du zinc, du chrome et des combinaisons de ces métaux.
Pour la production d’alcools gras, les esters d’acides carboxyliques correspondants sont hydrogénés. Les graisses et huiles naturelles servent de matières premières, qui sont initialement transestérifiées pour former des esters méthyliques, puis réduites en alcools, soit par sodium (réduction Bouveault – Blanc), soit par hydrogénation catalytique.
La réduction du sodium permet la préparation d’alcools gras insaturés à partir des esters d’acides gras insaturés.
L’hydrogénation des acides gras et des esters d’acides gras nécessite des conditions plus sévères par rapport à l’hydrogénation des aldéhydes. Le procédé peut être conduit en continu ou en discontinu à l’aide de catalyseurs cuivre-oxyde de chrome (catalyseurs d’Adkins), soit en suspension, soit en lit fixe.
Des températures de réaction de 240 à 300 °C et des pressions de 200 à 300 bar sont typiques. En modifiant les catalyseurs (par exemple, en ajoutant du cadmium), les esters d’acides gras insaturés peuvent être directement convertis en alcools gras insaturés.
4. Condensation aldol des aldéhydes inférieurs et hydrogénation des alcénals
Dans les procédés industriels, la synthèse oxo est la seule source d’aldéhydes utilisés pour la condensation d’aldol.
Après l’élimination des isoaldéhydes et des sous-produits, la réaction de condensation est catalysée par des acides ou des bases. La réactivité de chaque aldéhyde est influencée par sa longueur de chaîne et son degré de ramification, nécessitant des conditions de réaction spécifiques adaptées à chaque composé individuel.
Les aldols formés lors de la condensation subissent une déshydratation, entraînant la formation d’alcénals. Ces alcénals sont ensuite hydrogénés à l’aide de catalyseurs hétérogènes. Typiquement, les mêmes catalyseurs employés pour l’hydrogénation des aldéhydes oxo sont utilisés pour ce procédé.
Grâce à cette méthode, le 2-éthylhexanol, le 2-méthylpentanol et des quantités limitées d’alcools isomères C16 et C18 hautement ramifiés peuvent être préparés.
Cependant, le procédé aldox, qui consiste à soumettre le mélange d’aldéhydes formé dans la synthèse oxo à une condensation d’aldol dans le réacteur oxo, n’a pas été largement accepté en raison de la présence d’aldols mixtes dans les produits finaux. Néanmoins, certains aldols mixtes, tels que ceux de l’acétaldéhyde avec des aldéhydes supérieurs, ont une importance dans des applications spécifiques.
5. Oxydation des composés de trialkylaluminium
L’éthylène a la capacité de subir une addition avec du triéthylaluminium, résultant en un mélange de composés de trialkylaluminium avec une masse moléculaire plus élevée. Ces produits peuvent subir une oxydation à l’air conduisant à la formation des alcoxydes d’aluminium correspondants.
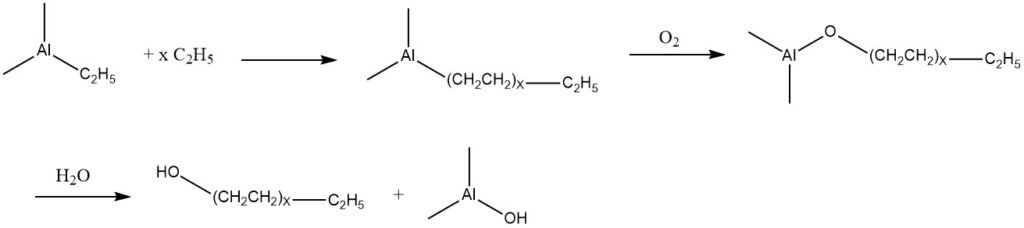
Par la suite, ces alcoxydes subissent une hydrolyse, produisant un mélange d’alcools primaires linéaires qui possèdent le même nombre d’atomes de carbone que les groupes alkyle présents dans les composants trialkylaluminium.
Sur la base de cette réaction, connue sous le nom de procédé Ziegler, deux procédés commerciaux ont été développés. L’un est par Conoco, qui est opérationnel aux États-Unis depuis 1962 et en Allemagne par Condea Chemie (Conoco et Deutsche Texaco) depuis 1964.
L’autre est par Ethyl Corp., en activité depuis 1965. Les principales différences entre les deux procédés résident dans la distribution de la longueur de chaîne et la linéarité des alcools résultants, ainsi que dans les caractéristiques techniques impliquées dans la génération et le contrôle de ce processus. distribution.
Dans le procédé à l’alcool Alfol (procédé Conoco), la réaction de croissance de chaîne est conduite à la température la plus basse possible pour éviter les réactions de déplacement qui pourraient conduire à la formation d’oléfines. Les alcools résultants présentent une distribution de longueur de chaîne ressemblant à une courbe de Poisson et sont pratiquement linéaires à 100 %.
Le processus d’alcool Alfol produit généralement une large gamme d’alcools (C2-C28), et bien que des ajustements puissent être apportés pour augmenter ou diminuer les longueurs de chaîne des alcools fabriqués, le schéma de distribution reste cohérent.
D’autre part, Ethyl Corp. a développé avec succès un procédé à croissance de chaîne linéaire contrôlée, qui produit principalement des alcools en C12 et C14. Ces alcools ont une structure linéaire jusqu’à 95 %.
6. Oxydation des hydrocarbures saturés
L’oxydation Bashkirov implique l’oxydation d’hydrocarbures aliphatiques avec de l’air en présence d’acide borique, ce qui donne des rendements élevés en esters d’acide borique.
Ces esters sont ensuite hydrolysés dans une étape ultérieure, produisant des alcools secondaires où les groupes hydroxyle sont répartis statistiquement le long de la chaîne moléculaire. La réaction se déroule via un hydroperoxyde secondaire intermédiaire.
L’oxydation est généralement effectuée en phase liquide à des températures comprises entre 150 et 170 ° C, avec la présence de 4 à 5% en poids d’acide métaborique. Un mélange azote-oxygène (environ 3,5 % O2) est utilisé à pression normale ou légèrement élevée.
Certaines usines plus récentes incorporent des amines comme co-catalyseurs. Pour atteindre des sélectivités économiquement acceptables de 80 à 85 %, le taux de conversion est maintenu en dessous de 20 %.
L’évaporation flash est utilisée pour éliminer les matières premières et les sous-produits d’oxydation, suivie d’un nettoyage dans des épurateurs alcalins et à eau, les n-hydrocarbures étant recyclés.
Les esters d’acide métaborique ou boroxines obtenus sont résistants à l’oxydation et thermiquement stables. Après distillation fractionnée, des alcools d’une pureté supérieure à 98% sont obtenus.
Le processus se termine par une « hydrofinition » (hydrogénation sur des catalyseurs hétérogènes au nickel) pour éliminer les substances colorées et odorantes.
L’acide orthoborique dans la solution aqueuse est converti en acide métaborique par déshydratation, et la récupération peut également être obtenue par cristallisation.
Dans certaines variantes récentes du procédé, le concentré d’acide borique est mélangé avec les n-hydrocarbures, et le mélange est déshydraté pour éviter les agglomérations et les arrêts. La bouillie séchée est ensuite renvoyée dans le réacteur d’oxydation.
Bashkirov a initialement développé le travail allemand en un processus commercial dans les années 1950. La première usine a commencé la production à Shebekino/Belgorod, URSS, en 1959. Des usines ont également été exploitées en Union soviétique et au Japon. Cependant, l’usine Union Carbide (UCC) aux États-Unis a fermé ses portes en 1977.
Les alcools secondaires produits dans ce procédé sont généralement convertis en éthoxydes d’alkylphénol et utilisés comme détergents. Cependant, en raison de la recirculation coûteuse des hydrocarbures et de l’acide borique, ainsi que des inconvénients de l’application des alcools secondaires, ce procédé n’a pas acquis une importance significative dans le monde occidental.
Outre l’oxydation de Bashkirov, une autre utilisation importante de l’oxydation catalysée par l’acide borique est la préparation de cyclohexanol et de cyclohexanone à partir de cyclohexane, en tant que produits intermédiaires dans la fabrication de caprolactame, d’acide adipique et de phénol.
De plus, il est utilisé dans la synthèse du cyclododécanol (un produit intermédiaire dans la synthèse du nylon 12) et de la cyclododécanone à partir du cyclododécane. Le processus implique une oxydation avec des hydroperoxydes d’alkyle, où les porphyrines de fer servent de catalyseurs utiles.
Les alcools peuvent être obtenus à partir d’acides gras par estérification d’acides bruts fractionnés (principalement dans la gamme C10-C15) avec du méthanol ou du butanol, suivie d’une hydrogénation. Lorsque des hydrocarbures linéaires sont utilisés comme matières de départ, des alcools linéaires peuvent être produits.
Cependant, selon l’hydrocarbure spécifique, le catalyseur et les conditions de réaction, le mélange d’alcools peut contenir 5 à 15 % d’alcools à chaîne ramifiée. En raison des impuretés présentes dans les acides gras, les alcools qui en sont dérivés peuvent contenir des substances odorantes, limitant leur champ d’application.
7. Hydratation des oléfines
L’hydratation des alcènes est une méthode courante pour la production d’alcools inférieurs. Selon la règle de Markovnikov, des alcools secondaires et tertiaires sont formés dans cette réaction (sauf dans le cas de l’éthylène).
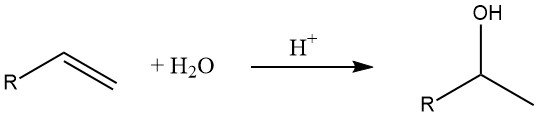
La vitesse de la réaction d’hydratation dépend de la stabilité de l’ion carbénium intermédiaire, les ions carbénium tertiaires étant plus stables que les ions secondaires et primaires.
Par conséquent, l’hydratation de l’isobutène se produit facilement à température ambiante en présence de faibles concentrations d’ions H⁺ en raison de la stabilité relative de l’ion carbénium tertiaire intermédiaire. D’autre part, l’hydratation de l’éthylène nécessite des températures et des pressions élevées.
En milieu industriel, deux variantes de la réaction d’hydratation sont utilisées. Dans le procédé indirect, la réaction en phase liquide se déroule en deux étapes. Initialement, l’oléfine réagit avec l’acide sulfurique pour former des mono- et dialkylsulfates, qui sont ensuite hydrolysés pour produire l’alcool après dilution avec de l’eau. Cependant, ce procédé nécessite une étape coûteuse de reconcentration pour recycler l’acide sulfurique.
Dans le procédé direct, l’hydratation a lieu en phase gazeuse. Comme la réaction est exothermique et conduit à une réduction de volume (2 moles de réactif forment 1 mole de produit), la formation d’alcool est favorisée par une pression élevée et une température basse.
En raison d’une conversion incomplète, un recyclage coûteux des gaz est nécessaire dans ce procédé. Des catalyseurs efficaces pour la réaction d’hydratation directe comprennent des matériaux contenant de l’acide phosphorique comme la célite, bien que des échangeurs d’ions soient également de plus en plus utilisés.
L’hydratation directe est principalement utilisée dans la production d’éthanol à partir d’éthylène et d’alcool isopropylique à partir de propène. Il joue également un rôle important dans la fabrication de 2-butanol à partir d’un mélange de 1-butène et de 2-butène (raffinat II) et d’alcool tert-butylique à partir d’isobutène.
8. Homologation des Alcools
L’homologation est une réaction chimique dans laquelle les alcools réagissent avec le gaz de synthèse en présence de systèmes catalytiques complexes à plusieurs composants. Selon les conditions de réaction spécifiques, les produits obtenus peuvent être soit des aldéhydes, soit des alcools avec un groupe CH2 supplémentaire par rapport aux matières premières.
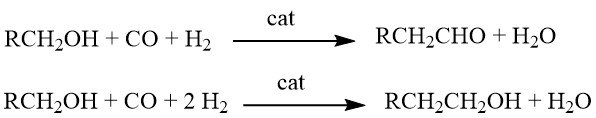
A l’origine, cette réaction a été développée pour la synthèse d’éthanol à partir de méthanol. Cependant, ses applications ont été étendues pour inclure la production d’aldéhydes homologues (tels que l’acétaldéhyde à partir de méthanol), d’acides carboxyliques (par exemple, l’acide propionique à partir de l’acide acétique), d’esters d’acide carboxylique (par exemple, l’acétate d’éthyle à partir de l’acétate de méthyle), et même le synthèse du styrène (par homologation de l’alcool benzylique en 2-phényléthanol, suivie d’une déshydratation).
Malgré des progrès significatifs dans ce domaine, le processus d’homologation n’a pas été mis en œuvre à l’échelle industrielle en raison de plusieurs défis. La conversion et la sélectivité obtenues jusqu’à présent sont encore insuffisantes pour une utilisation industrielle pratique, et il existe des difficultés associées au recyclage des catalyseurs d’homologation complexes. En conséquence, l’application à l’échelle industrielle de la réaction d’homologation reste limitée.
9. Processus Reppe
Le procédé d’hydrocarbonylation de Reppe implique la réaction d’oléfines avec du monoxyde de carbone et de l’eau, en utilisant des sels d’ammonium de fer tétracarbonyldihydrido comme catalyseur, pour produire des alcools. Semblable à la synthèse oxo, ce procédé donne également des produits à chaîne ramifiée, résultant en un rapport molaire des alcools linéaires à chaîne ramifiée d’environ 9: 1.

Par exemple, le propène réagit à des températures de 90 à 110 °C et à des pressions comprises entre 5 et 20 bars pour produire des butanols avec un rendement élevé de 90 %. Environ 4 % du propène est hydrogéné pour former du propane. Cependant, la conversion des oléfines supérieures nécessite des conditions de réaction plus sévères.
Malgré son potentiel, le procédé d’hydrocarbonylation de Reppe ne peut rivaliser avec l’hydroformylation en termes d’importance industrielle. La seule usine connue utilisant ce procédé pour fabriquer du butanol à partir de propène (Japan Butanol Co., d’une capacité de 30 000 t/a) a cessé ses activités au début des années 1980.
10. Hydrocarboxyméthylation
L’hydrocarboxyméthylation est une variante du procédé Reppe dans lequel les oléfines supérieures subissent une réaction avec le monoxyde de carbone et le méthanol, en utilisant un catalyseur au cobalt-pyridine.
Les produits résultants sont des esters d’acides carboxyliques qui ont un atome de carbone de plus dans la chaîne mère par rapport à la charge d’oléfine d’origine. Ces esters peuvent être encore hydrogénés pour donner les alcools correspondants.
Cependant, malgré son potentiel, le procédé n’a pas acquis une importance industrielle significative en raison de considérations économiques. À l’heure actuelle, les produits peuvent être préparés de manière plus économique en utilisant des matières premières naturelles. En conséquence, l’hydrocarboxyméthylation n’a pas encore atteint une importance généralisée dans les applications industrielles.
11. Fermentation
La fermentation, considérée comme l’une des plus anciennes méthodes de production d’éthanol, est encore largement pratiquée à grande échelle. A plus petite échelle, les pentanols sont récupérés à partir des alcools de fusel.
Récemment, il y a eu une importance croissante dans la fermentation butanol-acétone des matières premières glucidiques.
Des entreprises comme Gevo et Butamax (une joint-venture entre BP et DuPont) ont entrepris des recherches approfondies sur la production de butanol à partir de matières premières renouvelables. Cela signifie un intérêt croissant pour l’utilisation de procédés de fermentation pour fabriquer du butanol à partir de sources durables.
12. Alcools Guerbet
Dans le procédé Guerbet, les alcools primaires saturés sont dimérisés pour produire des alcools primaires α-ramifiés. Typiquement, la réaction est conduite par reflux de l’alcool en présence d’un agent de condensation alcalin et d’un catalyseur d’hydrogénation-déshydrogénation, comme indiqué ci-dessous :
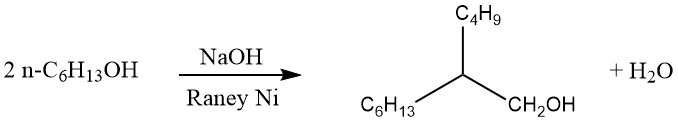
L’eau et les petites quantités d’hydrogène générées au cours de la réaction sont éliminées en continu. Si le chauffage est prolongé, des alcools primaires trimériques α-ramifiés peuvent également se former.
Le rendement en alcools dimères dans le procédé Guerbet est d’environ 80 %. Ce rendement peut être amélioré en recyclant les résidus et en ajoutant progressivement du catalyseur frais. Alors que diverses substances, y compris le sodium métallique, ont été proposées comme agents de condensation, les hydroxydes de métaux alcalins sont couramment préférés pour les applications industrielles.
Les alcools à chaîne courte avec des longueurs de chaîne plus courtes que l’alcool cétylique (C16) sont de préférence dimérisés à une pression plus élevée. Grâce à ce procédé, il est possible de convertir des alcools à chaîne courte en alcools C10-C20. Par exemple, le 2-hexyldécanol et le 2-octyldodécanol sont produits, qui trouvent une application dans les cosmétiques en tant que composants huileux avec des propriétés de solvant bénéfiques.
Cependant, la réaction de Guerbet n’a pas acquis d’importance industrielle car les alcools avec une ramification α typique sont plus facilement préparés en utilisant d’autres méthodes. Par exemple, le 2-éthyl-1-hexanol peut être obtenu par hydroformylation du propène pour produire du butanal, suivie d’une étape de condensation aldolique.
En raison de la disponibilité de procédés alternatifs pour synthétiser des alcools α-ramifiés, la réaction de Guerbet n’a pas été établie comme un procédé industriel à grande échelle.
13. Autres processus
L’époxydation d’a-oléfines linéaires suivie d’un clivage par hydrogénation ultérieur présente un intérêt commercial significatif. Ce procédé conduit à la production d’alcools plastifiants (C6-C10) ou d’alcools détergents (C10-C16).
Pour l’étape de clivage hydrogénant, différents catalyseurs peuvent être utilisés. La sélectivité vis-à-vis des alcools primaires peut être influencée par le choix du catalyseur, les conditions du procédé d’hydrogénation et l’utilisation de solvants.
De plus, l’hydrolyse des esters d’acide carboxylique revêt une certaine importance dans les applications industrielles.
Référence
- Alcohols, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_279.pub2
