Butanone: Réactions, production et utilisations
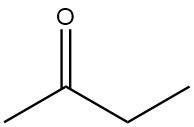
La butanone également connue sous le nom de méthyléthylcétone, MEK, est une cétone aliphatique et, à côté de l’acétone, la cétone la plus importante produite commercialement. C’est un liquide incolore, de faible viscosité et inflammable avec une odeur caractéristique de type cétone similaire à celle de l’acétone.
La butanone est principalement synthétisée par le processus de déshydrogénation du 2-butanol, similaire à la production d’acétone par déshydrogénation d’alcool isopropylique gazeux à l’aide de catalyseurs au cuivre, au zinc ou au bronze à des températures allant de 400 à 550 ° C.
La conversion du 2-butanol atteint 80 à 95 % et la sélectivité en butanone dépasse 95 %. Les sous-produits comprennent les butènes formés par déshydratation et les cétones supérieures résultant de l’autocondensation. La production mondiale de méthyléthylcétone (MEK) a atteint environ 1 million de tonnes en 2005.
Table of Contents
Depuis les années 1980, il y a eu un intérêt croissant pour l’utilisation de la 2-butanone comme solvant dans les peintures et les adhésifs. Le MEK, en particulier, est considéré comme un concurrent de l’acétate d’éthyle, en particulier lorsqu’il est utilisé comme solvant à bas point d’ébullition.
Sa polyvalence en tant que solvant s’étend à diverses applications telles que la nitrocellulose, l’acétate-butyrate de cellulose, l’éthylcellulose, les résines acryliques, les acétates de vinyle et le copolymère chlorure de vinyle-acétate de vinyle, principalement dans la préparation de revêtements de surface synthétiques.
Son aptitude en tant que solvant de laque est attribuée à sa faible viscosité, sa concentration élevée en solides et sa large gamme de diluants compatibles.
Le retrait du MEK de la liste des polluants atmosphériques dangereux (HAP) en 2005 a joué un rôle important dans le maintien de la position de marché de la butanone aux États-Unis.
De plus, la butanone trouve une utilité en tant qu’activateur dans les réactions oxydatives, agent d’extraction sélectif, solvant spécialisé pour le déparaffinage des fractions d’huile minérale et intermédiaire chimique.
1. Propriétés physiques de la butanone
La butanone est un solvant à faible point d’ébullition et à évaporation rapide avec un point d’ébullition de 79,6 °C. Il n’est que partiellement miscible avec l’eau, alors qu’il est complètement miscible avec la plupart des solvants organiques.
La MEK forme des mélanges azéotropiques binaires et ternaires en combinaison avec de l’eau et plusieurs composés organiques.
Les propriétés physiques de la butanone comprennent :
- Masse molaire = 72,1 g/mol
- point de fusion = -86,7 °C
- Densité de liquide à 25 °C = 0,7995
- Indice de réfraction à 25 °C = 1,736
- Viscosité liquide à 25 °C = 0,395 mPa.s
- Solubilité à 20 °C dans l’eau = 27,5 %
2. Réactions chimiques de la butanone
Dans des conditions normales et en l’absence d’oxygène atmosphérique, la butanone est stable. Des précautions doivent être prises après un stockage prolongé car le peroxyde de méthyléthylcétone se forme en présence d’oxygène. Des explosions peuvent se produire en raison de la décomposition instantanée des peroxydes.
Le 2-butanone est insaponifiable et résistant à la chaleur et à la lumière. Cependant, il se décompose après une exposition prolongée aux UV pour donner de l’éthane, du méthane, du monoxyde de carbone, de l’éthylène et du diacétyle.
Le diacétyle est formé par oxydation de MEK avec de l’air en présence de catalyseurs spéciaux.
Le peroxyde de méthyléthylcétone, un catalyseur de polymérisation, est formé par oxydation de la butanone avec une solution de peroxyde d’hydrogène.
L’acide nitrique et d’autres oxydants forts oxydent la butanone en un mélange d’acide formique et d’acide propionique.
Le 2-butanol est obtenu par réduction catalytique de la butanone avec de l’hydrogène, par réduction électrolytique dans une solution d’acétate de sodium ou par réduction avec de l’amalgame d’ammonium ou de l’hydrure de lithium et d’aluminium.
Un autre produit de réduction est le 3,4-diméthyl-3,4-hexanediol qui est obtenu par réduction électrolytique de MEK en milieu acide ou par réduction avec un amalgame de magnésium.
La méthyléthylcétone présente une réactivité vis-à-vis du cyanure d’hydrogène, des hydrogénosulfites de sodium et de potassium, entraînant la formation de produits d’addition.
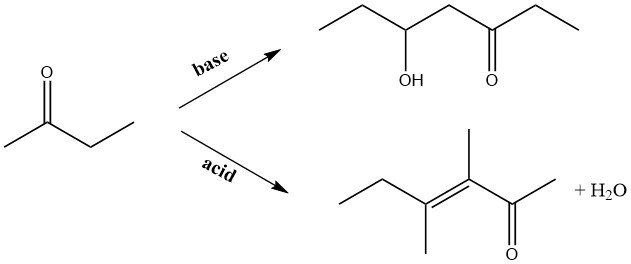
Dans des conditions alcalines, la 2-butanone subit des réactions de condensation avec des aldéhydes, conduisant à la production de cétones insaturées supérieures. Notamment, lorsque le formaldéhyde est utilisé, la méthylisopropylcétone est produite comme intermédiaire pour les synthèses ultérieures, présentant un domaine d’intérêt spécifique.
Lors de l’autocondensation catalysée par une base en phase liquide ou de la condensation en phase gazeuse sur des catalyseurs au cuivre alcalinisés, le groupe carbonyle de la molécule réagit avec le groupe méthyle. Inversement, dans la condensation catalysée par un acide, le groupe méthylène adjacent au groupe carbonyle devient le site d’attaque.
La condensation de la butanone et du citral entraîne la formation de méthylpseudoionone, qui peut ensuite subir une cyclisation pour donner de la méthylionone. Ce composé est utilisé dans la production de parfums violets synthétiques.
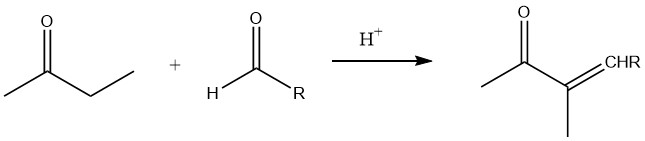
En présence d’aldéhydes de faible poids moléculaire, en particulier lors de l’aldolisation catalysée par une base et catalysée par un acide, la position α du groupe carbonyle est principalement impliquée dans la réaction.
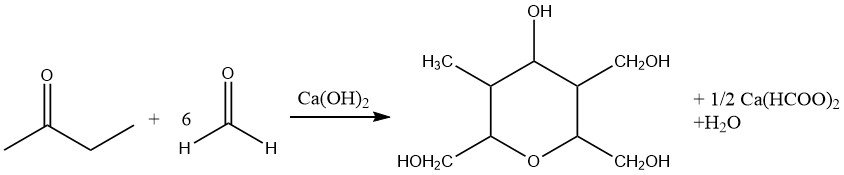
Ainsi, l’utilisation de quantités inférieures à la quantité stoechiométrique de formaldéhyde dans l’aldolisation catalysée par une base conduit à la formation de 2-méthyl butane-1-ol-3-one. De plus, une hydroxyméthylation exhaustive accompagnée d’une réduction du groupe carbonyle (réaction de Cannizzaro croisée) produit la désoxyanhydroèneaheptite.
Lorsque la méthyléthylcétone réagit avec des alcools primaires et secondaires, elle donne des cétones plus élevées. La réaction avec l’alcool sec-butylique conduit spécifiquement à la formation d’éthyl amyl cétone.
La méthyléthylcétone présente une réactivité vis-à-vis des composés polyoxy ou époxydes, conduisant à la formation de produits cycliques.
Le nitrite d’amyle attaque sélectivement le groupe CH2 en position α par rapport au groupe carbonyle, donnant la monooxime du diacétyle.
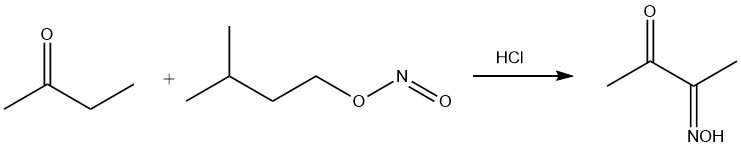
Le groupe carbonyl subit une réaction avec les groupes amino, entraînant l’élimination de l’eau. En combinaison avec l’hydroxylamine, cette réaction donne du méthyléthylcétoxime, un agent anti-peau.
La condensation de la butanone avec des esters et des anhydrides aliphatiques produit des β-dicétones.
Les phénols subissent des réactions avec la méthyléthylcétone, formant des composés oxyphénylène. Lorsqu’il réagit avec le phénol, le 2,2-hydroxyphényl butane, un homologue de l’hydroxyphényl propane (bisphénol A), est obtenu. Le bisphénol A est un matériau important utilisé dans la production de résines synthétiques.
La méthyléthylcétone peut être soumise à une halogénation en position α. De plus, il réagit avec les composés de Grignard, entraînant la formation d’alcools tertiaires.
En présence d’acétylène et d’amidure de sodium, le 3-méthyl-1-pentyn-3-ol est synthétisé. En combinant la 2-butanone avec le N-méthylformamide, le N-méthyl-formyl-aminobutane peut être obtenu. De plus, la réaction de Reformatzky permet la production de β-oxyesters à l’aide d’esters monobromés.
3. Production de butanone
La principale méthode de production de butanone implique la déshydrogénation du 2-butanol (alcool sec-butylique, SBA). Cette technique est utilisée dans environ 92 % des capacités de production mondiales, comme indiqué en 2006.
Le 2-butanol peut être facilement obtenu par un procédé en deux étapes d’hydratation des n-butènes dérivés de raffinats pétrochimiques en C4. L’acide sulfurique liquide est utilisé comme catalyseur dans ce processus. Alternativement, une procédure en une seule étape implique l’addition directe d’eau à une résine échangeuse d’ions acide stabilisée, qui sert de catalyseur.
Les 8% restants de méthyléthylcétone sont produits par une méthode de production fatale via la synthèse Fischer-Tropsch ou par oxydation catalytique du n-butane liquide, entraînant la production d’acide acétique et de MEK comme sous-produit.
3.1. Déshydrogénation catalytique de l’alcool sec-butylique (SBA) en phase gazeuse
La déshydrogénation de l’alcool sec-butylique (SBA) à l’aide de catalyseurs au cuivre, au zinc ou au bronze est une réaction endothermique avec un changement de chaleur (ΔH) de -51 kJ/mol. L’augmentation de la température conduit à une élévation de la concentration de butanone dans le mélange réactionnel, qui se stabilise à environ 350 ° C, en supposant qu’aucune réaction ultérieure ne se produise.
Dans la déshydrogénation en phase gazeuse, le cuivre est le catalyseur préféré, tandis que les catalyseurs au zinc ou au bronze nécessitent généralement des températures de déshydrogénation plus élevées (400 ° C).
Les catalyseurs à base d’oxyde de zinc présentent souvent une sélectivité plus faible en raison d’une réaction secondaire impliquant la déshydratation du SBA en n-butènes. Pour la déshydrogénation du SBA, des catalyseurs tels que le platine sur alumine, le cuivre ou le chrome, et le cuivre et le zinc sur alumine sont recommandés, en particulier lorsque le SBA contient des quantités importantes d’eau.
Les catalyseurs commerciaux sont réactivés par oxydation à l’air après 3 à 6 mois d’utilisation. La réactivation devient nécessaire lorsque le taux de conversion de l’alcool diminue avec le temps en raison de la contamination des sites actifs catalytiques par l’eau, les dépôts d’oligomères de butène et de di-sec-butyl éther.
Des températures plus élevées et une oxydation sont utilisées pour éliminer ces contaminants. Typiquement, les catalyseurs commerciaux présentent une durée de vie de plusieurs années ou plus.
Deutsche Texaco a développé une technologie pour la production de MEK basée sur la déshydrogénation de l’alcool sec-butylique anhydre à l’aide d’un catalyseur de précipitation à base de cuivre à des températures de 240-260 °C sous pression normale.
Dans cette technologie, l’alcool sec-butylique est produit par l’hydratation directe de n-butènes catalysée par une résine échangeuse d’ions acide stabilisée par température.
Malgré cette procédure hétérogène améliorée, l’acide sulfurique concentré reste le principal catalyseur dans le monde pour la production de SBA par voie indirecte.
Dans la voie indirecte, le sulfate de mono- ou di-sec-butyle intermédiaire résultant de la première étape de réaction est hydrolysé dans une étape de réaction ultérieure.
L’alcool sec-butylique liquide est vaporisé dans un évaporateur et le flux d’alcool gazeux résultant est dirigé vers un réacteur multitube, où la déshydrogénation a lieu sur un catalyseur en cuivre. Le courant de produit gazeux sort du réacteur et, après refroidissement à température ambiante, est séparé en une phase liquide de méthyléthylcétone brute et une phase gazeuse d’hydrogène.
Le courant liquide contient encore du SBA non converti, ainsi que de la 5-méthyl-3-heptanone, des cétones supérieures et de l’eau, en plus de la MEK souhaitée. La formation de 5-méthyl-3-heptanone, de cétones supérieures et d’eau se produit par autocondensation de deux ou plusieurs molécules de MEK.
La 2-butanone est purifiée par trois étapes de distillation consécutives sous pression atmosphérique. Dans la première étape, un courant butanone-eau azéotropique est collecté en tant que produit de tête, qui est ensuite purifié dans une colonne de distillation discontinue séparée.
La deuxième colonne donne le MEK pur souhaité (généralement avec une pureté supérieure à 99 %) ainsi que du SBA mélangé à des cétones supérieures en tant que produit de fond. Dans l’étape de distillation finale, le SBA non converti est distillé en tant que produit de tête et renvoyé dans le réservoir d’alimentation du procédé. Les produits de fond de cette étape sont constitués des cétones supérieures formées comme sous-produits au cours du processus de synthèse.
3.2. MEK en tant que sous-produit du procédé Fischer-Tropsch Coal-to-Liquid
Dans le procédé Fischer-Tropsch, une conversion catalytique du monoxyde de carbone et de l’hydrogène, connue sous le nom de gaz de synthèse, a lieu pour produire des hydrocarbures liquides. Ce procédé donne une large gamme d’hydrocarbures à longue chaînes et une quantité importante de divers sous-produits.
Développé à l’origine dans les années 1920 par les chercheurs allemands Franz Fischer et Hans Tropsch, le procédé Fischer-Tropsch a été utilisé commercialement et amélioré par SASOL Ltd., une société sud-africaine, depuis 1955 pour la production de carburants synthétiques à partir du charbon.
Le processus implique une technique en deux étapes. Initialement, le charbon minéral est gazéifié pour générer du gaz de synthèse, qui subit ensuite une purification approfondie par absorption dans des systèmes d’épuration, utilisant la technologie Rectisol. Le gaz de synthèse purifié est ensuite converti catalytiquement en hydrocarbures.
En plus des produits primaires tels que les oléfines, le carburant synthétique et les cires, une large gamme de composés oxygénés solubles dans l’eau sont produits en tant que sous-produits, représentant une sélectivité d’environ 3 à 6 % dans le flux d’eau pendant la réaction.
Les technologies de séparation traditionnelles sont utilisées pour purifier ces composés oxygénés, qui comprennent les alcools, les acides organiques, les aldéhydes, la butanone et d’autres cétones, en solvants de grande valeur.
3.3. Oxydation en phase liquide du n-butane
Dans l’oxydation en phase liquide du n-butane en acide acétique, la 2-butanone est un sous-produit de la réaction. Ce processus implique l’auto-oxydation ou l’oxydation directe du n-butane en phase liquide par une voie de réaction radicalaire.
L’oxydation initiale produit du MEK en tant que produit intermédiaire, qui, lors d’une oxydation supplémentaire, forme de l’hydroperoxyde de MEK. L’hydroperoxyde de MEK est ensuite clivé en deux molécules, ce qui donne l’acide acétique souhaité comme produit final.
Union Carbide Corp. a mis au point un procédé à écoulement continu qui permet la collecte partielle de la butanone intermédiaire. Ce processus implique une oxydation en phase liquide non catalysée à 180 ° C et 5,3 MPa, avec un certain rétromélange. Grâce à ce processus, on obtient à la fois du MEK et de l’acide acétique.
Dans des conditions d’oxydation continue avec un écoulement piston à 150 °C, 6,5 MPa et un temps de séjour de 2,7 minutes, de la méthyléthylcétone et de l’acide acétique se forment à des rapports massiques allant jusqu’à 3/1.
Celanese Corp. utilise l’acide acétique comme solvant, en employant un système de catalyseur d’oxydation dissous de manière homogène composé d’acétate de cobalt et d’acétate de sodium. Ce procédé discontinu est conduit à des températures comprises entre 160 et 165 °C et à une pression de 5,7 MPa. Les produits résultants sont la butanone et l’acide acétique, avec un rapport massique de 0,4/1,0.
3.4. Oxydation du sec-butylbenzène
La technologie SPAM de Hock Phenol Synthesis Shell, qui combine du phénol, de l’acétone et du butanone, est basée sur l’oxydation d’un mélange de sec-butylbenzène et de cumène en leurs composés hydroperoxydes respectifs. Ces hydroperoxydes sont ensuite clivés de manière classique à l’aide d’un acide inorganique, de préférence l’acide sulfurique, ce qui donne un mélange de phénol, de MEK et d’acétone comme produits souhaités.
Dans le procédé, le flux de cétone brut est séparé du phénol par distillation et ensuite purifié pour obtenir les composants cétone purs souhaités. Le clivage catalytique de l’hydroperoxyde de sec-butylbenzène (sBHP) avec un acide inorganique pour produire du phénol et de la butanone est un processus bien connu depuis de nombreuses années.
Cependant, malgré l’importance industrielle de la 2-butanone par rapport à l’acétone, cette voie alternative n’a pas été commercialisée en raison d’un défi majeur rencontré lors de l’étape d’oxydation. La vitesse d’oxydation autocatalytique du sec-butylbenzène est plusieurs fois plus lente que celle du cumène, ce qui conduit à des réactions secondaires indésirables qui affectent négativement le rendement global des produits souhaités.
Selon les recherches de Shell, la diminution de la vitesse de réaction lors de l’oxydation du sec-butylbenzène est attribuée à la formation de produits clivés agissant comme des capteurs de radicaux dans le mélange réactionnel, présents en concentrations de parties par million (ppm). Ces acides piégeurs comprennent l’acide formique, l’acide acétique et le phénol.
Pour surmonter l’impact négatif sur la vitesse de réaction, les options suivantes ont été suggérées :
1. Utilisation d’un mélange de sec-butylbenzène et de cumène pour établir des quantités initiales d’hydroperoxyde de cumène (CHP) dans la première étape de réaction, qui agit comme un initiateur.
2. Réduire la formation de méthanol ou d’éthanol en tant que produits clivés dans les courants de recyclage, minimisant ainsi la production des acides piégeurs susmentionnés.
3. Introduire une solution aqueuse d’ammoniaque dans une certaine mesure, permettant aux acides de former leurs sels d’ammonium tout en évitant la séparation de phase.
3.5. Oxydation directe des n-butènes (procédé Hoechst-Wacker)
Le procédé Hoechst-Wacker implique l’oxydation directe des n-butènes, où l’oxygène est transféré dans une phase homogène à l’aide d’un couple de sels redox, PdCl2/2CuCl. Par la suite, la paire de sel subit une réoxydation.
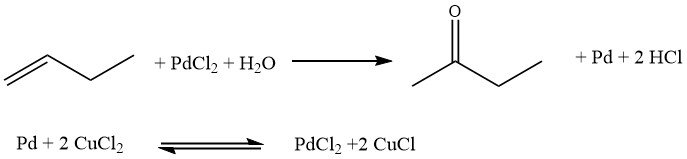
Cependant, ce procédé présente certains inconvénients. Elle conduit à la formation de butanones chlorées et de n-butanal, qui sont des sous-produits indésirables. De plus, des problèmes de corrosion peuvent survenir en raison de la présence d’acides libres.
Dans ce processus, l’oxygène est transféré à l’aide d’une solution aqueuse de sulfate de palladium et de sulfate ferrique. Des principes de transfert d’oxygène similaires ont été employés dans d’autres procédés développés par le Consortium for Electrochemistry et Eastman Kodak.
4. Utilisations de Butanone
La butanone, également connue sous le nom de méthyléthylcétone (MEK), est un solvant précieux aux propriétés similaires à celles de l’acétone. Il offre plusieurs avantages par rapport à d’autres solvants ayant des taux d’évaporation similaires :
- Pouvoir de dissolution élevé : Le butanone présente une forte capacité à dissoudre diverses substances.
- Rapport élevé de matière dissoute à la viscosité : Il peut dissoudre une grande quantité de matière tout en maintenant une viscosité favorable.
- Miscibilité avec les hydrocarbures : La butanone peut se mélanger avec de nombreux hydrocarbures sans affecter la teneur en solides ou la viscosité.
- Rapport volume/masse favorable : Du fait de sa faible densité, il offre un équilibre avantageux entre volume et masse.
Le 2-butanone a la capacité de dissoudre un large éventail de substances naturelles, de plastiques et de résines, y compris la colophane, les résines d’ester, la nitrocellulose, les dérivés de cellulose (tels que l’acétate de cellulose et l’acétobutyrate de cellulose), les résines époxy, les résines alkydes, les résines phénoliques, les résines vinyliques. polymères d’acétate, et bien d’autres.
Cependant, il ne peut dissoudre que partiellement le triacétate de cellulose, l’acétate de cellulose à haut poids moléculaire, le poly(chlorure de vinyle), le poly(butyral de vinyle), le caoutchouc polysulfure et la gomme laque.
Le solvant trouve des applications dans diverses industries telles que la production de peinture, de laque et de vernis, ainsi que dans les diluants à peinture, les adhésifs, les ciments, les mastics, les bandes magnétiques, le cuir artificiel, le papier transparent, les encres d’imprimerie, les nettoyants pour équipements électroniques, les cosmétiques, les produits pharmaceutiques, dégraissage des surfaces métalliques et procédés d’extraction.
La butanone est également utilisée comme agent aromatisant synthétique dans les aliments et les produits pharmaceutiques, comme stérilisateur pour les instruments chirurgicaux et les équipements dentaires, et dans la fabrication de poudre sans fumée.
Bien que son utilisation principale soit comme solvant, la butanone a une importance limitée en tant que matière première chimique. Cependant, il peut subir diverses réactions, telles que la condensation avec du formaldéhyde pour produire de la méthylisopropénylcétone, une autocondensation pour former de l’éthylamylcétone et une condensation mixte avec de l’acétone pour obtenir de la méthylamylcétone.
Le MEK est utilisé dans la production de parfums, d’antioxydants, de catalyseurs, de peroxydes et de diacétals. La méthyléthylcétoxime dans une application mineure est utilisée comme agent anti-peau dans les laques.
De plus, le peroxyde de butanone sert d’initiateur de polymérisation pour les polyesters insaturés.
Dans l’industrie de la parfumerie, la 2-butanone réagit avec le citral pour produire des composants de parfum comme la méthylpseudoionone. De plus, il a été approuvé comme dénaturant d’alcool en République fédérale d’Allemagne depuis 1962 (comme décrété par le Bundesmonopolverwaltung à Offenbach).
Références
- 2-Butanone, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_475.pub2
