Anhydride acétique : réactions, production et utilisations
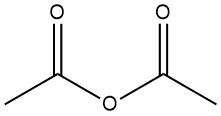
L’anhydride acétique est un composé organique de formule chimique (CH3CO)2O. C’est un liquide incolore avec une odeur âcre et il est couramment utilisé comme agent acétylant et agent déshydratant. Il a été préparé en 1852 par la réaction du chlorure de benzoyle et de l’acétate de potassium fondu.
Depuis lors, l’anhydride acétique est devenu un intermédiaire organique de premier plan revêtant une importance considérable dans diverses applications de recherche et industrielles. Actuellement, il est largement utilisé en synthèse industrielle.
L’anhydride acétique se trouve à l’état de traces dans le raisin de cuve (Vitis vinifera), mais il est principalement produit industriellement.
Table des matières
1. Propriétés physiques de l’anhydride acétique
L’anhydride acétique, de formule chimique C4H6O3 et d’une masse molaire de 102,09 g/mol, présente certaines propriétés physiques importantes. C’est un liquide incolore caractérisé par une odeur piquante et possède de fortes propriétés lacrymogènes. Les principales données physiques associées à l’anhydride acétique sont fournies ci-dessous.
| Propriété | Valeur |
|---|---|
| Formule moléculaire | (CH3CO)2O |
| Poids moléculaire | 102,09 g/mol |
| Apparence | Liquide incolore |
| Densité | 1,08 g/cm3 |
| Point d'ébullition | 140,1 °C |
| Point de fusion | -73,1 °C |
| Solubilité dans l'eau | Réagit violemment ; miscible |
| Odeur | Piquant |
| Pression de vapeur | 13 mmHg à 25 °C |
| Point d'éclair | 49 °C (coupe fermée) |
| Température d'auto-inflammation | 485 °C |
| Indice de réfraction | 1.392 |
| Viscosité | 1,3 cP à 25 °C |
| Limites explosives | 2,3 - 10,6 % (volume) |
À une température de -73,1 °C, l’anhydride acétique subit une transition de phase solide à liquide (point de fusion). En revanche, il bout à 140 °C sous une pression de 101,3 kPa (point d’ébullition).
L’anhydride acétique démontre une miscibilité avec les solvants polaires et présente une solubilité dans l’alcool froid, mais avec une vitesse de décomposition lente. Lorsqu’il est dissous dans l’eau à une température de 20 ° C, la solubilité de l’anhydride acétique est d’environ 2,6 % en poids, accompagnée d’un processus de décomposition progressive.
Inversement, à une température de 15 °C, la solubilité de l’eau dans l’anhydride acétique est d’environ 10,7 % en poids, également avec une tendance à la décomposition progressive.
2. Réactions chimiques de l’anhydride acétique
L’anhydride acétique présente un large éventail de réactions chimiques et a été largement étudié en tant qu’anhydride d’acide carboxylique aliphatique.
Au cours des 25 dernières années, l’anhydride acétique a été utilisé dans de nombreuses publications et brevets, en particulier pour l’acétylation de groupes hydroxyle (OH) ou amino (NH), servant d’étape principale dans ces réactions.
2.1. Acétylation
2.1.1. O-acétylation
L’anhydride acétique convient parfaitement aux réactions d’estérification avec des alcools, qui sont souvent difficiles ou impossibles à réaliser avec l’acide acétique. Au cours de ce processus, de l’acide acétique est libéré. Des catalyseurs tels que des bases, des acides forts et des sels comme l’acétate de sodium sont couramment utilisés.
Des exemples notables de réaction de l’anhydride acétique avec des groupes hydroxyle comprennent la formation d’acétylcellulose, d’acide acétylsalicylique (communément appelé aspirine) et de triacétate de glycérol.
Lorsque l’anhydride acétique réagit avec le peroxyde d’hydrogène, il produit de l’acide peracétique ou du peroxyde de diacétyle, le résultat dépendant du rapport molaire des réactifs :
(CH3CO)2O + 2H2O2 → 2CH3CO3H
(CH3CO)2O + H2O2 → CH3COOH + CH3CO3H
(CH3CO)2O + CH3CO3H → CH3COOOCOCH3 + CH3COOH
2.1.2. N-acétylation
L’acétylation des composés contenant des groupes NH donne des acétamides, suivant l’équation générale :
RR’NH + (CH3CO)2O → RR’NCOCH3 + CH3COOH
Ici, R et R’ représentent l’hydrogène (H) ou des groupes alkyle. Les amines aliphatiques réagissent généralement sans nécessiter de chauffage. L’aniline, par exemple, produit de l’acétanilide, qui empêche l’oxydation lors de la nitration ultérieure.
Les réactions de N-acétylation se produisent généralement plus rapidement que l’acétylation des groupes OH, permettant une acétylation partielle de composés avec plusieurs groupes fonctionnels. Les exemples incluent la production d’acides N-acétylaminés comme le N-acétylméthionine-S-oxyde (1) et les acides N-acétyl anthraniliques (2).

Les amides et les carbamides avec des groupes NH libres, à la fois aliphatiques et aromatiques, peuvent être acétylés à l’aide d’anhydride acétique.
L’acide sulfurique est couramment utilisé comme catalyseur. Cette réaction trouve son application dans la synthèse de divers produits tels que la N,N,N’,N’-tétraacétyléthylènediamine ((CH3CO)2NCH2CH2N(COCH3)2) et le 2,4,6,8-tétraacétylazabicyclo[3.3.1]nonane-3, 7-dione.
![2,4,6,8-tetraacetylazabicyclo[3.3.1]nonane-3,7-dione.](https://chemcess.com/wp-content/uploads/2023/07/2468-tetraacetylazabicyclo3.3.1nonane-37-dione.jpg)
2.1.3. C-acétylation
Les composés avec des liaisons CH réactives peuvent subir une acétylation avec de l’anhydride acétique, nécessitant parfois un catalyseur. Des exemples notables incluent la production d’α-cyanoacétoacétate d’éthyle (CH3COCH(CN)COOC2H5) en utilisant du carbonate de potassium comme catalyseur et la réaction de Friedel-Crafts entre l’anhydride acétique et des hydrocarbures aromatiques comme le benzène, entraînant la formation d’acétophénone.
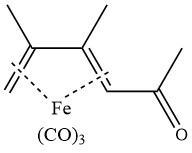
L’acétylation du fer 2,3-diméthylbutadiène tricarbonyle en présence de chlorure d’aluminium donne le complexe suivant :
La réaction des cétones avec l’anhydride acétique, catalysée par le trifluorure de bore, conduit à la formation de β-dicétones.
Le triacétylméthane peut être directement synthétisé à partir d’acétate d’isopropényle, d’anhydride acétique et d’un catalyseur de chlorure d’aluminium.
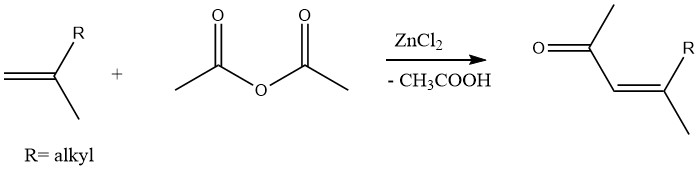
De même, des méthylcétones insaturées peuvent être produites par acétylation d’oléfines avec de l’anhydride acétique en présence de chlorure de zinc comme catalyseur :
2.1.4. Acétylation des acides minéraux
La réaction de l’anhydride acétique avec l’acide nitrique conduit à la formation de nitrate d’acétyle, fréquemment employé comme agent nitrant en chimie organique. Le nitrate d’acétyle peut également être synthétisé à l’aide de pentoxyde de diazote et d’anhydride acétique.
D’autres acides forts comme l’acide sulfurique, les acides sulfoniques et l’acide chlorhydrique peuvent former des anhydrides mixtes avec l’anhydride acétique. La réaction de l’anhydride acétique avec de l’acide phosphoreux produit de l’acide 1-hydroxyéthane-1,1-diphosphonique.

2.1.5. Acétylation des oxydes
Le trioxyde d’antimoine réagit avec l’anhydride acétique pour donner du triacétate d’antimoine (Sb(OCOCH3)3). Une réaction similaire avec le trioxyde de chrome conduit à des solutions d’acétate de chromyle, souvent utilisées dans l’oxydation des oléfines et des hydrocarbures, mais il faut faire preuve de prudence car elles peuvent parfois être explosives.
2.1.6. Acétylation des sels
Divers sels réagissent avec les anhydrides d’acide carboxylique d’une manière similaire à leurs acides libres correspondants :
Li−C−CR + (CH3CO)2O → CH3CO−C−CR + CH3COOLi
Le peroxyde de baryum traité à l’anhydride acétique produit du peroxyde de diacétyle :
BaO2 + (CH3CO)2O → (CH3CO)2O2 + BaO
Un procédé général de production de vinylcétones implique la réaction de bromures de vinylmagnésium avec de l’anhydride acétique.
2.1.7. Production d’acétoxysilanes
L’anhydride acétique réagit avec les silanes selon l’équation :

où X = H, Cl, OR, NR2.
2.1.8. Addition aux composés hétérocycliques avec clivage du cycle
Ces réactions sont conceptuellement similaires à celles décrites ci-dessus. Par exemple, le diacétate d’éthylène glycol peut être produit à partir d’oxyde d’éthylène en présence de catalyseurs fortement acides ou basiques, et les diacétates d’oxyméthylène peuvent être obtenus à partir de trioxane.
2.1.9. Addition oxydative aux doubles liaisons carbone-carbone
Les réactions d’addition oxydative conduisent à la formation de diacétates correspondants. Par exemple, l’addition d’éthylène à l’anhydride acétique donne du diacétate d’éthylène glycol. De même, le butadiène peut être converti en 1,4-diacétoxy-2-butène par un processus similaire.
2.1.10. Production de peroxydes de diacyle mixtes
Les peroxydes de diacyle peuvent être synthétisés en faisant réagir de l’oxygène avec des mélanges d’aldéhydes aliphatiques et d’anhydride acétique en présence d’acétate de sodium.
2.1.11. Réaction avec les N-oxydes
Les réactions avec les N-oxydes donnent divers produits basés sur le type spécifique de N-oxyde. La pyridine-N-oxyde, par exemple, produit la 2-acétyloxypyridine, tandis que la 4-picoline-N-oxyde forme un mélange de 4-acétyloxyméthylènepyridine et de 3-acétyloxy-4-méthylpyridine. La réaction de Polonovski des N-oxydes entraîne la formation de formaldéhyde, d’aldéhydes insaturés et d’amides acides.
2.1.12. Réaction avec les S-oxydes
La réduction des sulfoxydes en sulfures à l’aide d’anhydride acétique est connue sous le nom de réaction de Pummerer. Par exemple, CH3SOR réagit avec (CH3CO)2O pour donner CH3COOCH2SR et CH3COOH.
Cette réaction est également utilisée pour oxyder les alcools primaires et secondaires, même ceux qui sont stériquement encombrés, en utilisant des mélanges de diméthylsulfoxyde ou de tétraméthylène sulfoxyde avec de l’anhydride acétique, entraînant la formation des composés carbonylés correspondants.
2.1.13. Production d’acyls et d’acétates de vinyle
Les aldéhydes réagissent avec l’anhydride acétique en présence de catalyseurs acides pour former des acylals. Si l’aldéhyde possède un atome d’hydrogène en a, l’élimination de l’acide acétique conduit à la formation de l’acétate de vinyle correspondant. L’addition de zinc facilite le clivage de la fraction acide acétique. Ce procédé est particulièrement adapté à la synthèse de l’acétate de 2,2-dichlorovinyle.
2.1.14. Trifluorure de bore
L’anhydride acétique et les anhydrides acétiques substitués peuvent être transformés en acétylcétones à l’aide d’un complexe de trifluorure de bore qui se décompose dans l’eau chaude.
2.2. Déshydratation
L’anhydride acétique trouve une application en tant qu’agent déshydratant dans diverses industries, y compris l’industrie des explosifs. Un exemple notable de sa propriété déshydratante est la production d’hexogène (1,3,5-trinitrohexahydro-1,3,5-triazine).

Dans la synthèse du nitroester de 1,2,4,5-tétrahydroxy-3,6-dinitrocyclohexane, l’anhydride acétique est utilisé pour sa capacité de liaison à l’eau :

De plus, l’anhydride acétique est utilisé dans la production de cyanures d’alkyle en déshydratant les aldoximes :
RCH=NOH + (CH3CO)2O → RCN + 2CH3COOH
De plus, l’anhydride acétique sert d’agent déshydratant dans de nombreuses réactions de cyclisation.
2.3. Réactions des protons α
La réaction de Perkin est une méthode largement utilisée pour la synthèse d’acides α, β-insaturés à partir d’aldéhydes aromatiques, y compris le benzaldéhyde. Cette réaction a généralement lieu en présence d’acétate de potassium ou d’acétate de sodium. Il est également utilisé pour la production d’acide cinnamalacétique.
Des réactions similaires incluent la carboxyméthylation oxydative, où l’anhydride acétique et des agents oxydants sont utilisés, et la conversion d’alcènes à longue chaîne en leurs dérivés d’acide carboxylique correspondants.
2.4. Réactions d’un seul groupe carbonyle
Dans certains cas, il est possible qu’un seul des groupes carbonyle de l’anhydride acétique participe à une réaction. Par exemple, lorsque l’anhydride acétique réagit avec le cyanure d’hydrogène en présence d’une base, il forme le composé (3). De même, en présence d’un réactif de Grignard (RMgBr), l’anhydride acétique donne le composé (4).

2.5. Production de céténide d’argent
Lorsque l’acétate d’argent et l’anhydride acétique sont mis à réagir en présence de pyridine à température ambiante, ils subissent une réaction pour former un complexe pyridine de céténide d’argent. Si un excès d’anhydride acétique est utilisé, le mélange résultant peut être soumis à une distillation fractionnée de pyridine et d’acide acétique, conduisant à l’isolement du céténide d’argent.
3. Production d’anhydride acétique
Historiquement, la méthode la plus ancienne de production d’anhydride acétique impliquait la conversion de l’acétate de sodium avec un excès d’un chlorure inorganique, tel que le chlorure de thionyle, le chlorure de sulfuryle ou le chlorure de phosphoryle.
Dans ce processus, la moitié de l’acétate de sodium est convertie en chlorure d’acétyle, qui réagit ensuite avec l’acétate de sodium restant pour former de l’anhydride acétique.
Un autre développement a été la conversion de l’acide acétique avec du phosgène en présence de chlorure d’aluminium, permettant un fonctionnement continu :
2 CH3COOH + COCl2 → (CH3CO)2O + 2 HCl + CO2
Deux autres méthodes utilisées dans le passé comprenaient le clivage du diacétate d’éthylidène pour former de l’acétaldéhyde et de l’anhydride acétique en présence de catalyseurs acides comme le chlorure de zinc, ainsi que la réaction de l’acétate de vinyle avec de l’acide acétique sur des catalyseurs au palladium(II) pour former de l’acétaldéhyde et anhydride acétique. Cependant, ces procédés n’ont plus d’importance industrielle.
Actuellement, la production d’anhydride acétique est principalement réalisée soit par le procédé au cétène, soit par l’oxydation de l’acétaldéhyde. Une autre méthode, connue sous le nom de carbonylation de l’acétate de méthyle (procédé Halcon), a été introduite en 1983.
En Europe occidentale, environ 77% de l’anhydride acétique est produit par le procédé au cétène, tandis que 23% est produit par l’oxydation de l’acétaldéhyde.
Aux États-Unis, depuis l’introduction du procédé Halcon à l’usine de Tennessee-Eastman, 25 % de l’anhydride acétique est produit par cette méthode, tandis que 75 % est produit par le procédé au cétène.
3.1. Processus cétène
Le processus du cétène implique deux étapes : le clivage thermique de l’acide acétique pour former le cétène et la réaction ultérieure du cétène avec l’acide acétique pour produire l’anhydride acétique. Les réactions globales peuvent être résumées comme suit :
1. Clivage thermique de l’acide acétique :
CH3COOH → CH2=C=O + H2O (ΔH = 147 kJ/mol)
2. Réaction du cétène avec l’acide acétique :
CH2=C=O + CH3COOH → (CH3CO)2O (ΔH = -63 kJ/mol)
Le clivage thermique de l’acide acétique pour produire du cétène et de l’eau est réalisé en chauffant de la vapeur d’acide acétique chaude à une température de 700-750°C en présence de traces de catalyseur à base d’acide phosphorique.
La pression du réacteur est généralement réduite pour permettre l’isolement du cétène avant qu’il ne réagisse avec l’acide acétique ou l’eau. Le processus de clivage se déroule dans un réacteur multicoil avec des bobines en alliages d’acier hautement résistants à la chaleur, tels que le Sicromal.
Le procédé cétène implique plusieurs étapes et configurations d’équipement, en fonction de la capacité de production souhaitée.
Dans les opérations à petite échelle, des fours de préchauffage et de clivage séparés sont utilisés, tandis que les fours de taille moyenne sont souvent construits comme des fours à chambre unique chauffés au gaz ou au mazout.
Les fours à grande échelle fonctionnent efficacement avec des systèmes à trois ou quatre chambres et des flux de gaz partiels. Plusieurs fours peuvent également fonctionner avec de l’acide acétique fourni par un évaporateur central.
Après le clivage thermique de l’acide acétique, le cétène résultant est ensuite mis à réagir avec de l’acide acétique pour produire de l’anhydride acétique. Deux procédés sont couramment utilisés pour cette réaction : le procédé de lavage et le procédé Wacker.
Dans le processus d’épurateur, le cétène est absorbé par la circulation d’acide acétique glacial dans des épurateurs remplis d’anneaux de Raschig. Le cétène est principalement absorbé dans le premier épurateur, et le mélange liquide contenant l’anhydride brut est collecté et refroidi.
Dans le procédé Wacker, le cétène est pompé à travers une pompe à anneau liquide, où il réagit avec l’acide acétique à température et pression contrôlées. L’anhydride brut est collecté en continu et une partie de celui-ci est renvoyée à la pompe de réaction.
L’anhydride brut obtenu à partir de la réaction est ensuite purifié par distillation. Des méthodes de distillation continue et discontinue sont utilisées.
Dans la distillation discontinue, trois fractions sont obtenues : la première, la deuxième et l’anhydride pur.
La distillation continue implique plusieurs colonnes pour séparer les différentes fractions. La pureté de l’anhydride est typiquement d’environ 99% en distillation discontinue mais peut être améliorée en opérant sous pression réduite.
Le processus Wacker est également utilisé pour le processus de traitement, permettant le traitement des déchets acides sans avoir besoin de matériaux supplémentaires. Le processus présente des caractéristiques de haute fiabilité et d’économie d’énergie.
Pour la production de 100 kg d’anhydride acétique, il faut environ 122 kg d’acide acétique compte tenu de l’acide acétique dilué reconcentré. Le rendement du procédé est supérieur à 96 % à environ 75 % de clivage.
3.2. Oxydation de l’acétaldéhyde
L’anhydride acétique peut également être obtenu directement par oxydation en phase liquide de l’acétaldéhyde. Ce processus implique la réaction de l’acide peracétique, formé à partir d’oxygène et d’acétaldéhyde, avec une seconde molécule d’acétaldéhyde pour produire de l’anhydride acétique et de l’eau.
Un refroidissement efficace et l’utilisation de catalyseurs appropriés sont cruciaux dans ce processus. Des combinaisons de sels métalliques, telles que l’acétate de manganèse et l’acétate de cuivre, l’acétate de cobalt et l’acétate de nickel, ou les sels de cobalt et de cuivre d’acides gras supérieurs, sont des catalyseurs couramment utilisés.
Pour maintenir la température de réaction et empêcher une hydrolyse rapide de l’anhydride acétique, le procédé est typiquement mis en oeuvre entre 40°C et 60°C.
Un refroidissement efficace est nécessaire en raison de la nature exothermique de la réaction, et l’ajout de solvants à bas point d’ébullition comme l’acétate de méthyle et l’acétate d’éthyle, qui forment des mélanges azéotropiques avec l’eau, aide à la séparation de l’eau du mélange réactionnel.
Le rapport de l’anhydride acétique à l’acide acétique dans le produit final dépend du rapport initial de l’acétate d’éthyle à l’acétaldéhyde.
En pratique, un mélange d’acétaldéhyde et d’acétate d’éthyle est oxydé avec l’ajout de catalyseurs d’acétate de cobalt et d’acétate de cuivre. Les conditions de réaction optimisées peuvent conduire à un rapport anhydride acétique sur acide acétique plus élevé. Divers solvants, y compris le chlorure de méthylène, l’éther diisopropylique, la cyclohexanone et le diacétate d’éthylidène, peuvent être utilisés comme diluants dans le procédé.
Le mélange gazeux contenant de l’oxygène et de l’acétaldéhyde est introduit dans le réacteur où l’oxydation a lieu en phase liquide en présence de catalyseurs. L’effluent du réacteur passe ensuite à travers un condenseur refroidi à l’eau, qui sert également de séparateur pour les gaz non condensables.
L’acétaldéhyde frais est introduit dans une colonne à garnissage, où il se combine avec les gaz de dégagement du condenseur. Les condensats du condenseur et de la colonne sont distillés pour obtenir le produit souhaité.
L’acétaldéhyde est récupéré du courant de gaz non condensable. Les effluents gazeux peuvent contenir des produits combustibles à bas point d’ébullition et des solvants, qui peuvent être brûlés.
Le procédé décrit ci-dessus fournit un exemple, et des variations de configurations de réacteurs et de conditions de réaction spécifiques peuvent être employées par différents fabricants.
3.3. Carbonylation de l’acétate de méthyle
Le procédé classique de production d’anhydride acétique implique la décomposition thermique de l’acide acétique pour former du cétène, ce qui nécessite une quantité importante d’énergie.
Cependant, des procédés alternatifs ont été développés, comme le procédé de production d’acide acétique par Monsanto et la carbonylation de l’acétate de méthyle.
La carbonylation de l’acétate de méthyle pour former de l’anhydride acétique a été brevetée par Halcon en 1973, et la première usine utilisant ce procédé était opérationnelle en 1983. Dans ce procédé, l’acétate de méthyle est carbonylé en phase liquide à des températures allant de 160°C à 190°C. C et une pression partielle de monoxyde de carbone de 2-5 MPa.
Divers catalyseurs peuvent être utilisés pour la réaction de carbonylation, notamment des composés de rhodium et de nickel activés par des iodures ou d’autres substances contenant de l’iode. Les catalyseurs au rhodium présentent une activité plus élevée que les catalyseurs au nickel, et les deux catalyseurs présentent une sélectivité supérieure à 95 %.
L’ajout d’un faible pourcentage d’hydrogène au monoxyde de carbone utilisé dans la synthèse améliore l’activité et la durée de vie des catalyseurs. Des composés de chrome peuvent également être utilisés pour raccourcir la phase d’induction de la réaction.
Le processus de carbonylation peut commencer à partir de l’acétate de méthyle ou de l’éther diméthylique, ce dernier étant converti en acétate de méthyle avant sa transformation en anhydride acétique.
Le procédé Halcon, par exemple, consiste à alimenter en continu de l’acétate de méthyle séché dans un réacteur garni d’Hastelloy, où il est carbonylé à 175°C en présence d’un mélange catalytique.

La chaleur générée pendant la réaction est éliminée par échange de chaleur et utilisée pour préchauffer l’acétate de méthyle et générer de la vapeur à basse pression. Le monoxyde de carbone n’ayant pas réagi est recyclé après élimination des gaz condensables.
Un courant latéral est lavé avec de l’anhydride acétique pur pour empêcher l’accumulation de gaz inertes. Le produit de réaction liquide quittant le réacteur subit une distillation éclair pour séparer le liquide contenant le catalyseur en vue de son recyclage.
L’anhydride brut est ensuite purifié par distillation dans trois colonnes consécutives, la colonne finale produisant de l’anhydride acétique d’une pureté de 99 %.
Pour réduire la teneur en iodure dans l’anhydride pur, une solution d’acétate de potassium dans l’anhydride acétique peut être ajoutée pendant le processus de distillation.
Ces procédés alternatifs offrent des avantages par rapport à la voie de décomposition thermique conventionnelle en termes de consommation d’énergie et d’utilisation des matières premières, permettant la production d’anhydride acétique à partir de sources autres que le pétrole, comme le charbon.
4. Utilisations de l’anhydride acétique
L’anhydride acétique est largement utilisé à la fois comme agent acétylant et comme agent déshydratant. Une application importante est l’acétylation de la cellulose à grande échelle. Cependant, il existe plusieurs autres domaines où l’anhydride acétique est utilisé:
1. Production de mousse dure de poly(méthylacrylimide), où elle agit comme un liant pour l’ammoniac libéré lors de la conversion des groupes amide en groupes imide.
2. Auxiliaires plastiques acétylés, y compris le triacétate de glycérol, le citrate d’acétyle tributyle et le ricinolate d’acétyle.
3. Production d’explosifs, notamment dans la fabrication d’hexogène.
4. Production de certains types de liquides de frein.
5. Production d’auxiliaires pour fluides de forage.
6. Industrie des détergents, en particulier dans la production d’activateurs de blanchiment à froid comme la tétraacétyléthylènediamine.
7. L’industrie de la teinture, où l’anhydride acétique, en combinaison avec l’acide nitrique, est utilisé comme agent nitrant, en utilisant ses propriétés solvantes et déshydratantes.
8. Préparation de divers intermédiaires organiques, tels que le chlorure de chloroacétyle, le peroxyde de diacétyle, les anhydrides carboxyliques supérieurs, les acétates et le complexe de trifluorure de bore.
9. Production de produits pharmaceutiques, y compris l’acide acétylsalicylique (aspirine), le p-acétylaminophénol, l’acétanilide, l’acétophénacétine, la théophylline, le chlorure d’acétylcholine, les sulfamides, les hormones, les vitamines et l’agent de contraste pour rayons X 2,4,6-triiodo-3,5 -acide diacétylamidobenzoïque.
10. Applications dans l’industrie alimentaire, principalement dans l’acétylation des graisses animales et végétales pour atteindre les solubilités souhaitées, la production d’acétostéarines (matériaux d’emballage comestibles) et la clarification des huiles végétales.
11. Arômes et parfums, lorsqu’ils sont utilisés dans la production d’esters et de coumarine.
12. Herbicides comme le métolachlore (Dual) et l’alachlore (Lasso).
Référence
- Acetic Anhydride and Mixed Fatty Acid Anhydrides; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_065
- https://lotus.naturalproducts.net/compound/lotus_id/LTS0216280
Questions fréquemment posées sur l'anhydride acétique
L’anhydride acétique est un composé organique de formule chimique (CH3CO)2O. C’est un liquide incolore avec une odeur piquante et est couramment utilisé comme agent acétylant et agent déshydratant.
L’anhydride acétique réagit violemment avec l’eau, les alcools et d’autres substances contenant des atomes d’hydrogène actifs. Cette réaction peut être exothermique et entraîner des risques d’incendie ou d’explosion.
L’anhydride acétique a diverses applications, notamment :
– Acétylation de la cellulose dans la production d’acétate de cellulose, un matériau utilisé dans les fibres, les films et les plastiques.
– Production de produits pharmaceutiques, tels que l’acide acétylsalicylique (aspirine), l’acétaminophène et certaines hormones.
– Fabrication de produits chimiques, notamment d’agents d’acétylation, d’anhydrides carboxyliques supérieurs et de certains esters.
– Synthèse d’arômes, de parfums et d’herbicides.
– Utilisation comme agent déshydratant dans divers procédés industriels.
Lorsque vous travaillez avec de l’anhydride acétique, il est important de suivre ces précautions de sécurité :
– Portez un équipement de protection individuelle (EPI) approprié, y compris des gants, des lunettes et une blouse de laboratoire, pour vous protéger contre tout contact avec la peau et les yeux.
– Travailler dans un endroit bien aéré ou utiliser des hottes aspirantes pour éviter l’inhalation de vapeurs.
– Tenir l’anhydride acétique à l’écart des flammes nues, des étincelles ou des sources d’inflammation car il est inflammable.
– Manipuler avec soin pour éviter tout contact avec de l’eau ou d’autres substances réactives.
– Stocker l’anhydride acétique dans un endroit frais, sec et bien ventilé, à l’écart des matières incompatibles.
L’anhydride acétique est un meilleur agent acylant que l’acide acétique car il donne facilement un groupe acétyle (CH3CO) aux réactifs. L’anhydride acétique réagit plus efficacement en raison de l’absence d’eau, ce qui peut entraver la réaction d’acylation. L’absence d’eau dans l’anhydride acétique permet des rendements plus élevés et des vitesses de réaction plus rapides dans les réactions d’acylation.
La densité de l’anhydride acétique est d’environ 1,08 gramme par centimètre cube (g/cm³) à température ambiante.
Lorsque l’acide salicylique réagit avec l’anhydride acétique en présence d’un catalyseur acide, tel que l’acide sulfurique, il subit une réaction d’acétylation. L’anhydride acétique donne un groupe acétyle au groupe hydroxyle de l’acide salicylique, entraînant la formation d’acide acétylsalicylique, communément appelé aspirine.
L’anhydride acétique lui-même n’est pas intrinsèquement explosif. Cependant, il peut former des mélanges explosifs avec l’air lorsque sa concentration atteint certains niveaux. L’anhydride acétique doit être manipulé avec précaution en raison de sa réactivité et de son inflammabilité. Il est important de stocker et de manipuler l’anhydride acétique en suivant les protocoles de sécurité appropriés pour minimiser les risques d’accidents.
