Alcool allylique : production, réaction et utilisations
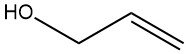
L’alcool allylique est un composé organique de formule chimique C3H6O. C’est un liquide clair et incolore avec une odeur piquante d’ail et est classé à la fois comme alcool primaire et comme alcool insaturé en raison de la présence d’une double liaison dans sa structure moléculaire.
La double liaison est située entre les deuxième et troisième atomes de carbone de la molécule et le groupe hydroxyle (-OH) est attaché au premier atome de carbone.
Table des matières
1. Propriétés physiques de l’alcool allylique
L’alcool allylique (nom IUPAC : prop-2-en-1-ol) est un liquide incolore et mobile avec une odeur irritante. Il a une formule moléculaire de C₃H₆O et une masse molaire de 58,08 g/mol. Le point de fusion est de -129 °C et le point d’ébullition est de 96,9 °C (101,3 kPa). L’alcool allylique est miscible à l’eau et aux solvants organiques.
| Propriété | Valeur |
|---|---|
| Densité relative |
|
| Indice de réfraction |
|
| Température critique | Tcrit = 271,9 °C |
| Chaleur de vaporisation à 101,3 kPa | 39,98 kJ/mol |
| Capacité calorifique spécifique de la vapeur | Cp (g), (20 °C et 101,3 kPa) = 2,428 kJ/kg.K |
| Capacité calorifique spécifique du liquide | Cp (l), (20,5 – 95,5 °C) = 2,784 kJ/kg.K |
| Chaleur de combustion à p constant | 1 853,8 kJ/mol |
| Viscosité |
|
| Tension superficielle |
|
| Moment dipolaire | 1.63 D |
| Constante diélectrique | à 16,2 °C, λ = 60 cm : 20,3 |
| Limites d'allumage dans l'air | à 100 °C, 101,3 kPa = 2,5 – 18,0 vol % |
| Point d'éclair (coupe fermée) | 22,2 °C |
L’alcool allylique est miscible à l’eau et aux solvants organiques en toutes proportions à 20 °C. Il forme des azéotropes binaires avec l’eau, le benzène, l’éther diallylique, le chlorure d’allyle, le trichloréthylène et des azéotropes ternaires avec (eau, benzène) et (eau, éther diallylique).
2. Réactions chimiques de l’alcool allylique
L’alcool allylique est un composé polyvalent qui peut subir diverses réactions, notamment des réactions d’oxydation, de réduction, d’hydrogénation, de condensation et d’addition.
A température ambiante, l’alcool allylique est stable sous forme de substance liquide. Cependant, le chauffage de l’alcool allylique à des températures supérieures à 100°C entraîne la création de polymères solubles dans l’eau (alcools polyallyliques), qui réagissent avec les acides alcénoïques pour donner des huiles siccatives.
Il peut également être greffé sur des polyimides ou copolymérisé avec du styrène en présence d’oxygène.
Les mousses de polyuréthane ignifuges sont produites par réaction de condensation entre l’alcool allylique et les polyéthers de glucoside de méthyle, suivie d’une bromation et de l’ajout ultérieur d’isocyanates.
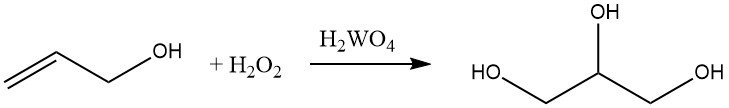
L’alcool allylique peut être hydroxylé avec du peroxyde d’hydrogène en présence d’acide de tungstène pour former du glycérol. Cette réaction est commercialement importante pour la production de glycérol.
L’hydroxylation à l’aide d’hydroperoxydes organiques avec un catalyseur au vanadium donne du glycidol (oxiranylméthanol), qui peut également être obtenu par réaction d’alcool allylique avec des peracides.
La déshydrogénation en phase gazeuse avec de l’air en présence de catalyseurs tels que le palladium, l’argent ou le cuivre conduit à la formation d’acroléine.
L’oxydation en phase liquide de l’alcool allylique à l’aide d’un catalyseur au palladium produit de l’acide acrylique et de l’acroléine avec une sélectivité de 83 %.
L’hydrogénation catalytique de l’alcool allylique donne le 1-propanol.
La chloration de l’alcool allylique dans une solution aqueuse produit des mono- et dichlorohydrines de glycérol qui peuvent être encore hydrolysées pour donner du glycérol.
La bromation dans une solution aqueuse tamponnée par du chlorure de calcium entraîne la formation de 2,3-dibromo-1-propanol, un composé utilisé dans les matériaux ignifuges.
La réaction de l’alcool allylique avec le chlorure d’allyle produit de l’éther diallylique (point d’ébullition : 94°C), tandis qu’avec le chlorure de méthallyle, on obtient l’éther allylméthallylique.
L’alcool allylique peut s’ajouter au tétrachlorure de carbone par initiation radicalaire pour former du 2,4,4,4-tétrachloro-1-butanol (intermédiaire utilisé dans les retardateurs de flamme).
Il peut être hydroformylé en présence de cobalt carbonyle pour former du 4-hydroxybutyraldéhyde. Avec les catalyseurs au complexe de rhodium, le rendement en 4-hydroxybutyraldéhyde est amélioré à 80 %. L’aldéhyde peut ensuite être hydrogéné en 1,4-butanediol qui est un monomère précieux pour la synthèse de polyuréthanes.
Si l’hydroformylation de l’alcool allylique se produit en phase vapeur en utilisant des complexes de triphénylphosphine de rhodium supportés sur des supports poreux, un rendement élevé en tétrahydro-2-furanol est atteint (94 %).
L’alcool allylique peut être carbonylé dans une solution d’acide acétique avec un catalyseur de chlorure de palladium pour former de l’acide 3-buténoïque.
3. Production de L’alcool allylique
L’alcool allylique est généralement produit à partir de propène, qui est un hydrocarbure gazeux. Il existe une variété de façons de produire de l’alcool allylique à partir de propène, mais les deux méthodes les plus courantes sont : le procédé au chlorure d’allyle et le procédé à l’oxyde de propylène.
3.1. Hydrolyse du chlorure d’allyle
L’hydrolyse du chlorure d’allyle est un procédé commercial de production d’alcool allylique. Le chlorure d’allyle est mis à réagir avec une solution diluée d’hydroxyde de sodium à 150 °C et 1,3 – 1,4 MPa, donnant 85 – 95 % d’alcool allylique.
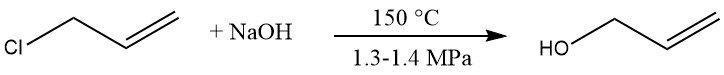
Les sous-produits sont l’éther diallylique (5 à 10 %), les chloropropènes, le propionaldéhyde et les matières à point d’ébullition élevé.
Le chlorure d’allyle et la solution alcaline aqueuse doivent être soigneusement mélangés pour maintenir une valeur de pH constante. Le chlorure d’allyle doit être converti presque quantitativement car il est corrosif et ne peut pas être récupéré économiquement. La réaction est donc effectuée dans un réacteur de recyclage, le nickel étant le matériau de réacteur le plus approprié.
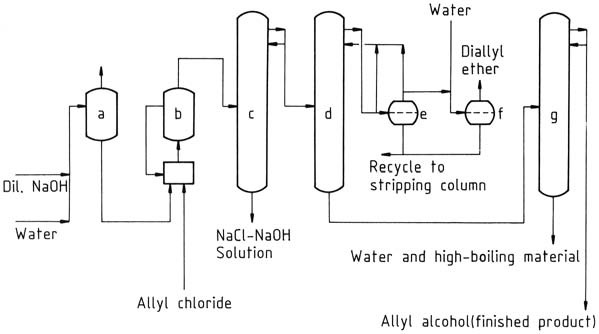
Une installation commerciale pour la production d’alcool allylique par hydrolyse continue du chlorure d’allyle est représentée sur la figure 1. L’eau est éliminée de l’alcool allylique brut par distillation azéotropique avec de l’éther diallylique comme entraîneur. L’azéotrope alcool allylique brut – eau (alcool allylique à 72 %) peut être utilisé sans autre purification pour certaines réactions.
Voici quelques détails supplémentaires sur l’hydrolyse du chlorure d’allyle :
- La réaction est exothermique, il est donc important de contrôler la température pour éviter la formation de sous-produits.
- La réaction est également corrosive, il est donc important d’utiliser des matériaux résistants à la corrosion pour le réacteur et la tuyauterie.
- Les sous-produits de la réaction peuvent être recyclés ou vendus comme sous-produits.
- L’étape de distillation azéotropique est utilisée pour éliminer l’eau de l’alcool allylique brut. Cette étape est nécessaire pour obtenir un produit d’alcool allylique de haute pureté.
3.2. Isomérisation de l’oxyde de propène
Le réarrangement catalytique de l’oxyde de propène est maintenant plus largement utilisé dans la production commerciale que l’hydrolyse du chlorure d’allyle. Le catalyseur préféré pour cette réaction est le phosphate de lithium.
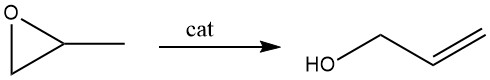
Dans le procédé en phase vapeur, la vapeur d’oxyde de propène est dirigée sur un catalyseur au phosphate de lithium, avec des températures allant de 250 à 350°C. Ce catalyseur est composé jusqu’à 30% de matériau inerte dans une structure à lit fixe. Les conversions sont d’environ 70 à 75 %, accompagnées d’une sélectivité en alcool allylique de 97 %.
Les rendements espace-temps qui en résultent sont de 0,5 kg d’alcool allylique par litre de catalyseur et par heure. Olin Mathieson utilise un catalyseur au phosphate de lithium incorporant 1 % d’hydroxyde alcalin ; cependant, ce catalyseur doit être régénéré après 40 heures par lavage à l’acétone.
Un catalyseur distinct, formulé par Chemische Werke Hüls, contient 73,6 % de phosphate de lithium et 17,5 % de silice, ne nécessitant aucune régénération. Remarquablement, même après 1200 heures, il maintient une sélectivité en alcool allylique de 97,3 %.
Bien que l’arséniate de lithium ait été suggéré comme catalyseur d’isomérisation, il n’offre aucun avantage substantiel par rapport au phosphate de lithium. Une méthode antérieure, catalysée par l’oxyde de chrome et développée par Wyandotte Chemical Corp., démontre des conversions et des sélectivités significativement plus faibles.
Dans le procédé en phase liquide, le procédé Progil utilise un catalyseur de phosphate de lithium finement broyé en suspension dans des solvants à point d’ébullition élevé tels que le terphényle ou les alkylbenzènes. L’oxyde de propène est introduit dans la suspension à 280°C.
Cette variante permet d’atteindre un taux de conversion de 60%, une sélectivité en alcool allylique de 92% et un rendement espace-temps de 1 kg d’alcool allylique par litre par heure. La durée de vie des catalyseurs s’étend de 500 à 1000 heures.
Une technique comparable, brevetée par Jefferson Chemical Co., utilise un mélange solvant de biphényle et de diphényléther.
3.3. Hydrolyse de l’acétate d’allyle
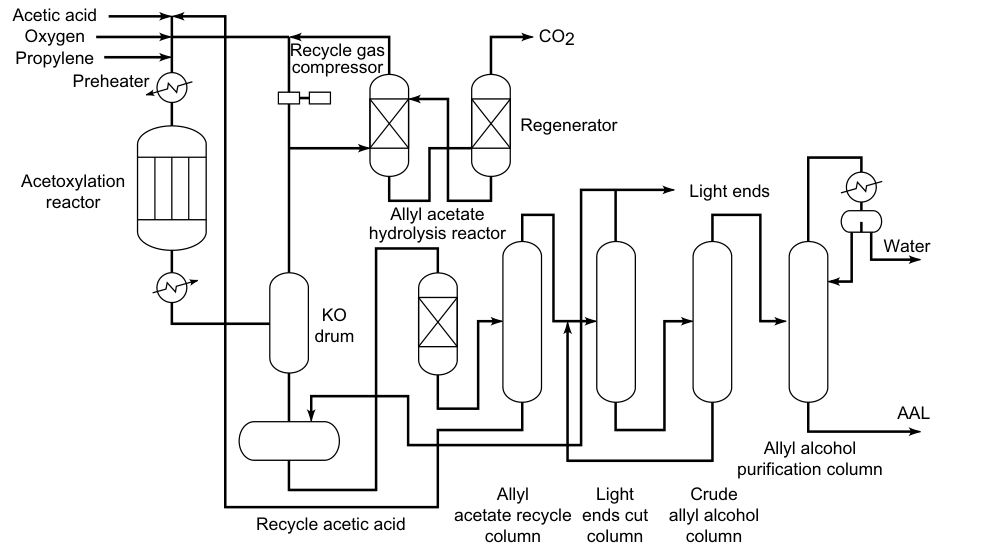
Le propène, l’acide acétique et l’oxygène réagissent en phase gazeuse sur des catalyseurs au palladium pour former de l’acétate d’allyle :
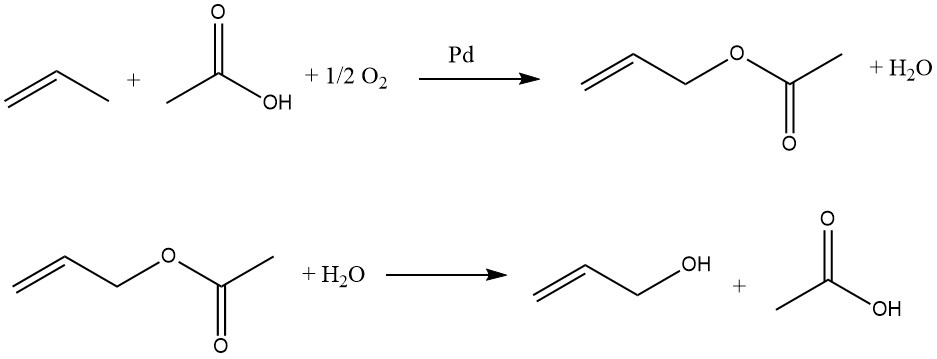
Cette réaction est exothermique, la température du réacteur doit donc être contrôlée. L’acétate d’allyle est ensuite hydrolysé en alcool allylique dans un réacteur séparé. L’acide acétique est récupéré et réutilisé dans l’oxydation du propène. Par conséquent, seuls le propène et l’oxygène sont nécessaires comme matières premières pour la préparation de l’alcool allylique.
Ce processus ne nécessite pas de chlore, ce qui le rend plus écologique que les autres méthodes de production d’alcool allylique. L’acétate d’allyle peut être hydrolysé en le chauffant à environ 230 ° C et 3 MPa.
Dans le procédé Bayer, l’hydrolyse est effectuée catalytiquement sur un échangeur de cations acide (polystyrène sulfoné) à 100 °C. Le rendement global en alcool allylique est de 90 %.
3.4. Hydrogénation de l’acroléine
L’alcool allylique est synthétisé par hydrogénation catalytique de l’acroléine en phase vapeur. En utilisant des catalyseurs cadmium-zinc, un rendement allant jusqu’à 70% peut être atteint, et des résultats similaires peuvent être obtenus en utilisant des alliages argent-cadmium supportés sur des supports inertes comme l’alumine ou la silice.
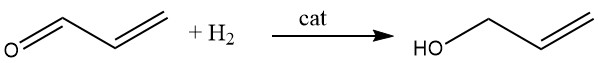
En variante, l’acroléine peut être réduite par de l’éthanol ou de l’alcool isopropylique en présence d’un mélange d’oxyde de magnésium et d’oxyde de zinc. Cette réaction se produit en phase vapeur à 400 °C, ce qui donne des rendements en alcool allylique aussi élevés que 80 %.
4. Utilisations de l’alcool allylique
Les utilisations de l’alcool allylique sont les suivantes :
- Production de glycérol : L’alcool allylique était initialement utilisé comme matière première dans la fabrication de glycérol par des sociétés telles que Daicel Chemical Company.
- Monomère pour diéthylène glycol bis (allyl carbonate): Avant 1985, l’alcool allylique était utilisé comme monomère dans la production de diéthylène glycol bis (allyl carbonate), qui est utilisé dans la création de lentilles optiques en plastique.
- Production d’épichlorhydrine : Showa Denko K.K. a commencé à utiliser l’alcool allylique comme précurseur dans la production d’épichlorhydrine, un composé utilisé dans diverses applications. D’autres fabricants d’épichlorhydrine ont également envisagé de passer au procédé à l’alcool allylique.
- Production de 1,4-butanediol : ARCO Chemical Company a établi une importante usine de production d’alcool allylique et a utilisé l’alcool allylique comme matière première dans la fabrication de 1,4-butanediol. Il s’agit d’une application notable, marquant la première étape de la production industrielle de 1,4-butanediol à l’aide d’alcool allylique.
- Production d’esters allyliques : l’alcool allylique sert de matière première principale pour la production d’esters allyliques, en particulier de phtalates de diallyle et de méthacrylate d’allyle.
- Production d’éther allylique: L’alcool allylique est également utilisé dans la production d’éther allylique, en particulier d’éther allylique glycidylique.
- Copolymère styrène-alcool allylique : Un copolymère styrène-alcool allylique est fabriqué par Monsanto Chemical Company. Ce copolymère trouve des applications dans les peintures solubles dans l’eau, les résines alkydes et les uréthanes en tant que polyols.
- L’alcool allylique subit des réactions de copolymérisation avec d’autres monomères pour produire des intermédiaires utilisés dans la fabrication de matériaux ignifuges ou comme nématocide, fongicide ou conservateur.
5. Toxicologie et santé au travail
L’alcool allylique a été largement étudié pour ses effets irritants et toxiques. Son odeur peut être perçue à environ 0,8 ppm.
Des concentrations comprises entre 6 et 12 ppm provoquent une irritation nasale, tandis que 25 ppm provoquent une grave irritation des yeux avec des symptômes tels que larmoiement, sensibilité à la lumière, vision floue et douleur oculaire.
Des concentrations plus élevées peuvent entraîner une nécrose cornéenne et une cécité temporaire. Les personnes sensibles peuvent ressentir une irritation des yeux à des concentrations aussi faibles que 2 à 5 ppm.
Dans les études animales, l’inhalation quotidienne de vapeurs d’alcool allylique à des concentrations de 2 à 7 ppm pendant 7 heures par jour pendant 6 mois a été tolérée par les chiens, les lapins, les cobayes et les rats.
La valeur limite de seuil (TLV) et la concentration maximale admissible (MAK) pour l’alcool allylique sont toutes deux fixées à 2 ppm. La limite d’exposition à court terme est plus élevée, à 4 ppm.
L’alcool allylique a montré des effets hépatotoxiques, avec une nécrose des cellules hépatiques observée chez le rat après administration orale et intrapéritonéale. Des applications orales uniques ont provoqué une nécrose du foie chez le rat, entraînant des décès. La DL50 pour les lapins est comprise entre 50 et 80 mg/kg, et pour les rats, elle est de 64 mg/kg.
Le contact cutané avec l’alcool allylique présente un risque d’intoxication systémique en raison de son taux d’absorption élevé. Même de petites quantités, comme une seule goutte (environ 50 mg), peuvent provoquer des effets systémiques en plus d’une irritation locale.
Des rats exposés à 50 ppm d’alcool allylique dans leur eau potable pendant 15 semaines ont montré une tolérance sans effets indésirables notables.
Ces résultats mettent en évidence la nature toxique et irritante de l’alcool allylique, avec différents seuils de concentration et des effets potentiels sur différentes voies d’exposition. Les consignes de sécurité au travail et les risques potentiels associés à l’exposition cutanée sont des considérations importantes lors de la manipulation de ce composé.
Références
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
Allyl Alcohol and Monoallyl Derivatives; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0112122514010701.a01.pub2
FAQ
Qu'est-ce que l'alcool allylique ?
L’alcool allylique est un composé organique de formule chimique C3H6O. Il appartient à la classe des alcools et contient à la fois un groupe hydroxyle (-OH) et un groupe allyle (-CH2CH=CH2). C’est un intermédiaire chimique important utilisé dans diverses industries.
Quel est le nom commun de l'alcool allylique ?
Le nom commun de l’alcool allylique est « propènol« .
A quoi sert l'alcool allylique ?
L’alcool allylique est utilisé comme précurseur pour la production de glycérol, d’esters allyliques et d’autres produits chimiques. Il est également utilisé dans la synthèse de polymères, de matériaux ignifuges et de produits pharmaceutiques.
L'alcool allylique est-il toxique ?
Oui, l’alcool allylique est toxique et peut être nocif s’il est ingéré, inhalé ou absorbé par la peau. Il peut provoquer une irritation des yeux, de la peau et des voies respiratoires.
Où trouve-t-on l'alcool allylique ?
L’alcool allylique est principalement un composé synthétisé industriellement et ne se trouve pas couramment dans les sources naturelles. Il est généralement produit par des procédés chimiques dans des environnements contrôlés.
Comment l'alcool allylique est-il produit ?
L’alcool allylique est produit par l’hydrolyse du chlorure d’allyle ou de l’acétate d’allyle et le réarrangement de l’oxyde de propène. Ces processus impliquent des réactions chimiques qui convertissent les composés précurseurs en alcool allylique.
L'alcool allylique est-il miscible à l'eau ?
Oui, l’alcool allylique est miscible dans l’eau dans une certaine mesure en raison de son groupe hydroxyle hydrophile.
